盐浓度对欧洲鳗肌原纤维蛋白理化性质和凝胶形成性能的影响
2023-08-25李婕妤石林凡任中阳翁武银
杨 玉,李婕妤,石林凡,任中阳,翁武银,
(1.福清市产品质量检验所,福建福清 350300;2.集美大学海洋食品与生物工程学院,鳗鲡现代产业技术教育部工程研究中心,福建厦门 361021)
鳗鱼是一种江河性洄游鱼类,全世界常见的鳗鱼种类有19 种,其中欧洲鳗、日本鳗和美洲鳗属于重要的养殖品种[1]。我国是鳗鱼养殖、生产和出口大国,2021 年全国鳗鲡养殖总产量已经超过25 万吨[2]。目前,鳗鱼大多被加工成白烧鳗和蒲烧鳗,产品单一。热处理是烤鳗加工的关键环节,加热会导致蛋白分子变性和聚集,进而影响蛋白凝胶特性。作为鱼肉主要蛋白的肌原纤维蛋白在加工过程中的变化是影响鱼肉品质的主要因素[3]。有研究报道,肌原纤维蛋白的性质会影响加工鱼肉的质地及感官特性[4]。近年来,热处理对鲈鱼肌原纤维蛋白和泥鳅肌原纤维蛋白的性质影响受到关注[5-6],然而有关热处理对鳗鱼肌原纤维蛋白性质的影响却未见报道。
添加氯化钠(NaCl)可以促进肌球蛋白等盐溶性蛋白溶解,在热诱导过程中发生聚集[7]。溶解的肌原纤维蛋白经过加热后,包埋在蛋白内部的疏水基团会逐渐暴露,促进蛋白发生相互作用并形成三维网络结构[8-10]。有研究报道,添加盐会促使阿拉斯加鳕鱼鱼糜肌球蛋白重链在加热中发生聚合,形成良好凝胶强度的鱼糜制品[11]。Gao 等[12]在研究超声功率、时间和盐添加量对鲢鱼鱼糜凝胶性质影响时,发现盐含量是影响鱼糜凝胶品质的主要因素。孔保华等[13]研究发现,不同盐对鲤鱼肌原纤维蛋白凝胶特性影响程度不同。这些研究结果表明盐对鳗鱼热加工食品品质存在一定的影响,但关于盐浓度对鳗鱼肌原纤维蛋白热诱导凝胶性质的影响却未见报道。
本研究从欧洲鳗肌肉中提取肌原纤维蛋白,考察了加热温度对肌原纤维蛋白的浊度、表面疏水性、活性巯基的影响,探究了盐浓度对肌原纤维蛋白热变性温度和流变行为等理化性质的影响,最后对肌原纤维蛋白热诱导凝胶进行了表征,结果将为鳗鱼肌肉蛋白的热变性规律研究提供基础数据。
1 材料与方法
1.1 材料与仪器
鲜活淡水养殖欧洲鳗(体重约600 g/尾) 由厦门同泉水产食品有限公司提供;MgCl2、NaCl 西陇科学股份有限公司;磷酸二氢钠、磷酸氢二钠 上海阿拉丁生化科技股份有限公司;8-苯胺基-1-萘磺酸(ANS) 东京化成工业株式会社;乙二醇双(2-氨基乙基醚)四乙酸(EGTA)、2-硝基苯甲酸(DTNB) 上海麦克林生化科技有限公司;三羟甲基氨基甲烷(Tris) 国药集团化学试剂有限公司;标准蛋白(PageRulerTM Protein Ladder) 美国Thermo Fisher公司。
Aglient 1200 高效液相色谱仪、Zorbax Eclipse AAA 色谱柱(4.6 mm×150 mm,5 μm) 美国Agilent公司;UV-8000 A 紫外分光光度计 上海元析仪器有限公司;FP-8200 荧光分光光度计 日本Jasco 公司;Q2000 差示扫描量热仪、DHR-2 流变仪 美国TA 仪器有限公司;TA-XT Plus 质构仪 英国Stable Micro System 公司;Nicolet iS50 傅里叶变换红外光谱仪 美国Thermo Nicolet 公司;S-4800 电子扫描显微镜 日本东京日立制造所。
1.2 实验方法
1.2.1 肌原纤维蛋白的提取 参考Brewer 等[14]的方法,鲜活的鳗鱼经冰晕、去头、去皮、去骨、去内脏后得到白色鱼肉,整个蛋白提取步骤在4 ℃条件下进行。获得的白色鱼肉用冷水洗涤、切碎并加入20 倍体积的提取缓冲液(1 mmol/L MgCl2、1 mmol/L EGTA、40 mmol/L NaCl 和20 mmol/L 磷酸钠缓冲液,pH7.0)后进行均质。得到的匀浆液经过离心(10000×g,10 min,4 ℃)后取沉淀物,用提取缓冲液再次溶解沉淀物并进行均质,之后利用纱布过滤除去不溶物并将滤液离心(10000×g,10 min,4 ℃),取沉淀物并用10 倍体积的冰蒸馏水洗涤,通过离心获得肌原纤维蛋白。获得的肌原纤维蛋白保存在4 ℃,备用;冷冻干燥的样品供氨基酸分析使用。
1.2.2 肌原纤维蛋白性质的测定
1.2.2.1 氨基酸测定 将10 mg 冻干的鳗鱼肌肉或肌原纤维蛋白样品放在氨基酸水解管中,加入1 mL的HCl(6 mol/L)和20 μL 苯酚,利用氮气赶走空气并密封,在110 ℃下水解22 h。得到的水解液通过旋转蒸发仪除酸后用20 mmol/L HCl 溶解,并0.22 μm膜过滤,获得的样品的氨基酸组成利用高效液相色谱仪进行测定[15]。
1.2.2.2 浊度测定 浊度测定参考Sano 等[16]报道的方法。将1.2.1 得到的肌原纤维蛋白溶解在含有0.6 mol/L NaCl 的10 mmol/L 磷酸钠缓冲液(PBS,pH7.0)中,调节蛋白浓度至1 mg/mL 后,将样品利用水浴加热,以1 ℃/min 的升温速率从20 ℃升温至80 ℃,期间每5 min 取样一次,利用紫外分光光度计检测样品在波长350 nm 处的吸光度值A350。
1.2.2.3 表面疏水性(S0)测定 表面疏水性的测定参考Yongsawatdigul 等[17]报道的方法。将1.2.2.2热处理得到的肌原纤维蛋白溶液用0.6 mol/L NaCl-20 mmol/L PBS(pH7.0)将蛋白含量稀释至0.025、0.05 和0.1 mg/mL。稀释后的样品溶液(4 mL)与20 μL 10 mmol/L ANS-50 mmol/L PBS(pH7.0)混合,避光反应20 min,再利用荧光分光光度计测定激发波长为374 nm,发射波长为485 nm 的荧光强度值。通过计算荧光强度值对蛋白质浓度的初始斜率,获得样品的S0。
1.2.2.4 活性巯基(R-SH)含量测定 将1.2.2.2 热处理得到的肌原纤维蛋白溶液(1 mL)与3 mL 含有10 mmol/L EDTA 的0.2 mol/L PBS(pH6.8)混匀,再加入0.4 mL 含有0.1% DTNB 的0.2 mol/L PBS(pH6.8),放在4 ℃下反应1 h 后,测定在412 nm 处的吸光度值,R-SH 含量根据方海砚等[18]报道的公式进行计算。
1.2.3 肌原纤维蛋白凝胶性质的测定
1.2.3.1 肌原纤维蛋白溶胶和凝胶的制备 将肌原纤维蛋白加入含有0.1、0.3 和0.5 mol/L NaCl 的PBS(10 mmol/L,pH7.5)中,将蛋白浓度调整至40 mg/mL,混合并研磨制备成溶胶,研磨过程保持温度低于10 ℃。将研磨好的糊状物装入内径为20 mm,高度30 mm的玻璃烧杯中,先在40 ℃水浴条件下保温1 h,再在90 ℃下加热15 min[19],加热结束后立即用冰水冷却制备成热诱导凝胶。溶胶和凝胶保存在4 ℃备用。
1.2.3.2 变性温度测定 利用差示扫描量热仪(DSC)测定鳗鱼肌原纤维蛋白的变性温度。取1.2.3.1 制备的溶胶(10 mg)放入铝盘中并密封,以5 ℃/min 的速度从30 ℃升温至80 ℃,以密封的空盘作为参考,利用Q2000 配套软件分析肌原纤维蛋白的变性温度。
1.2.3.3 流变行为测定 利用流变仪对1.2.3.1 制备的溶胶流变行为进行测定。设置1 mm 间隙,0.1 Hz频率,1%应变,2 ℃/min 升温速率,采用温度斜坡扫描的方式测定溶解在NaCl 溶液中肌原纤维蛋白的储能模量和损耗模量。
1.2.3.4 凝胶强度测定 参考Weng 等[20]报道的方法,利用质构仪在室温条件下对1.2.3.1 制备的热诱导凝胶强度进行测定。使用的P/5S 球形探头直径为5 mm,测试速度为0.5 mm/s。
1.2.3.5 SDS-PAGE 肌原纤维蛋白和热诱导凝胶利用含有8 mol/L 尿素和2% SDS 的 20 mmol/L Tris-HCl(pH8.8)溶液进行溶解。利用SDS-PAGE 分析时使用的分离胶浓度为8%,浓缩胶浓度为4%。电泳结束后用考马斯亮蓝R-250 染色液染色,利用脱色液(甲醇:乙酸:水=3:1:6,v/v/v)脱色后再拍照。
1.2.3.6 傅里叶变换红外光谱(FTIR)分析 将冷冻干燥后的热诱导凝胶样品与干燥的KBr 以1:100 的比例混合,充分研磨后压成薄片。以KBr 为空白,利用Nicolet iS50 FT-IR 光谱仪进行测定。
1.2.3.7 扫描电镜(SEM)分析 利用SEM 对1.2.3.1制备的热诱导凝胶微观结构进行观察。凝胶样品的制备和分析按照Weng 等[21]报道的方法进行。
1.3 数据处理
使用SPSS 软件对数据进行作图和方差分析(ANOVA),通过Duncan 多重比较对数据进行显著性检验分析,显著性水平为0.05。
2 结果与分析
2.1 欧洲鳗肌原纤维蛋白性质分析
2.1.1 欧洲鳗肌肉及其肌原纤维蛋白氨基酸组成 欧洲鳗肌肉及其肌原纤维蛋白的氨基酸组成如表1 所示。在鳗鱼肌肉中,含量最高的氨基酸是Glu,其次是Asp 和Arg。作为鲜味特征氨基酸的Glu 和Asp 占总氨基酸的比例达到27.0%,类似尼罗罗非鱼(26.9%),但高于胡子鲶(19.6%)[22-23]。而且,鳗鱼肌肉中必需氨基酸占总氨基酸的比例为42.0%,高于牛肉(33.2%)、鸡肉(35.4%)和猪肉(33.4%)[19]。表1 的氨基酸结果表明欧洲鳗肌肉中含有优质的蛋白质。另一方面,肌原纤维蛋白中含量最多的氨基酸也是Glu,其次是Asp、Lys、Leu、Arg 和Ala。鳗鱼肌原纤维蛋白中Gly、Arg、Ala 和Val 的比例略低于鳗鱼肌肉,表明这些氨基酸可能主要分布在鳗鱼水溶性蛋白中。有研究报道,蛋白凝胶的形成与疏水性氨基酸占比有密切关系,疏水氨基酸含量越高形成的凝胶微观结构越均匀致密,当疏水性氨基酸含量高于31.5%时容易形成具有良好质构的凝胶[23-24]。因此,鳗鱼肌原纤维蛋白中疏水氨基酸(Ala、Val、Met、Phe、Ile、Leu、Pro)占总氨基酸的比例达到34.6%(表1),表明鳗鱼肌原纤维蛋白理论上在一定条件下可形成具有良好质构的凝胶。
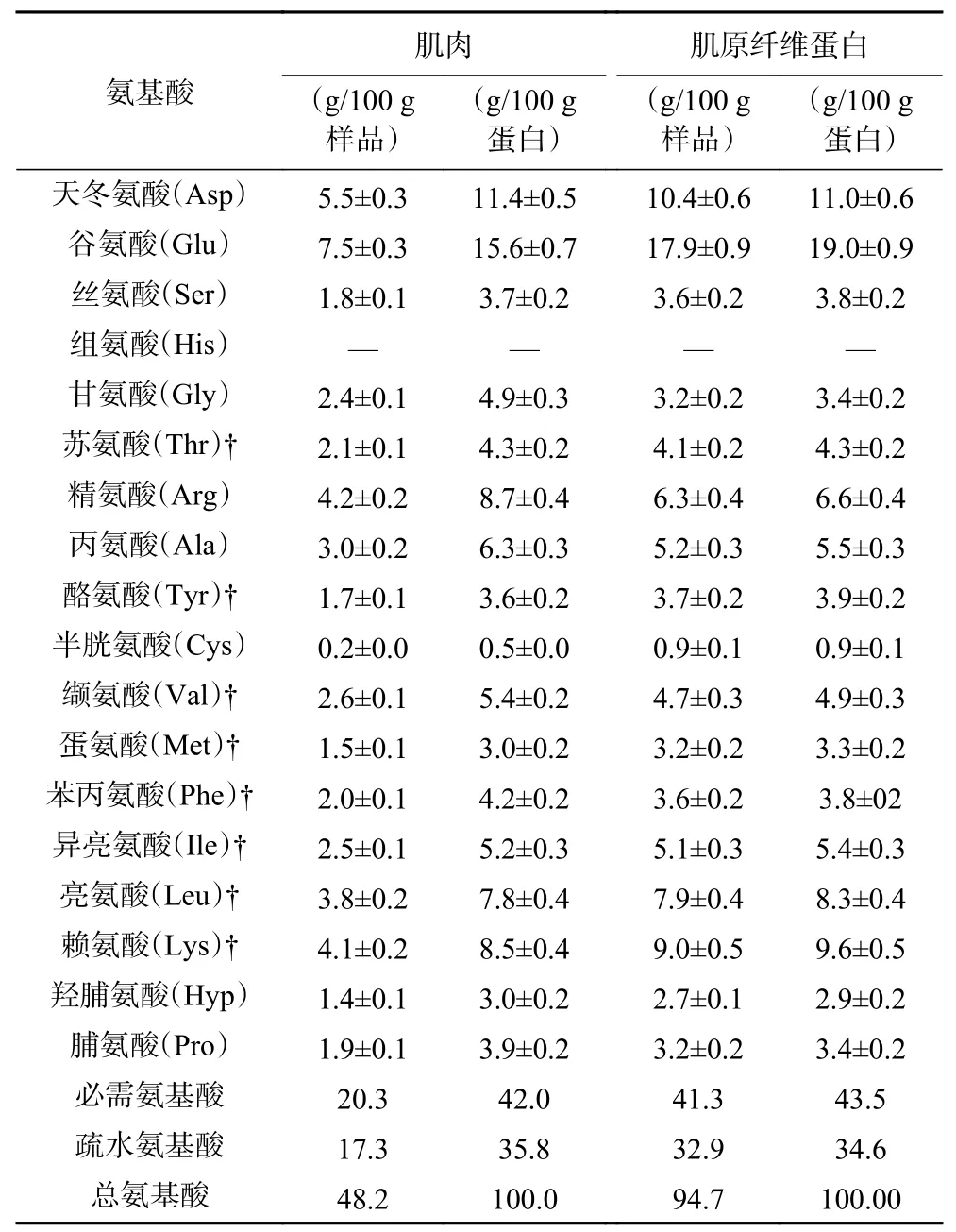
表1 鳗鱼肌肉和肌原纤维蛋白的氨基酸组成Table 1 Amino acid compositions of eel muscle and myofibrillar protein
2.1.2 加热温度对肌原纤维蛋白浊度、表面疏水性和活性巯基的影响 图1(a)显示了鳗鱼肌原纤维蛋白溶液的浊度随温度的变化。当肌原纤维蛋白溶液从35 ℃上升到55 ℃时,浊度值出现显著增加(P<0.05)。在热处理过程中,蛋白质分子的变性和聚集均会导致浊度增加[25]。类似的现象也出现在鲢鱼肌原纤维蛋白[25]和鸡胸肌动球蛋白[10]的报道中。图1(b)显示了欧洲鳗肌原纤维蛋白表面疏水性随温度的变化情况。当温度35 ℃上升至40 ℃时,S0增加了约2.5 倍,并在75 ℃处达到最高值。这个结果表明,在35~40 ℃范围内鳗鱼肌原纤维蛋白开始变性伸展,包藏在蛋白内部的疏水基团大部分暴露出来,在75 ℃左右部分疏水残基参与了蛋白分子的聚集。这与Yongsawatdigul 等[17]研究报道的鲷鱼肌动球蛋白热变性和聚集行为一致。Tornberg[26]在研究加热对蛋白质的影响时也得到类似的结论,一些暴露的疏水残基在65 ℃以上时通过蛋白-蛋白相互作用发生聚集。鳗鱼肌原纤维蛋白的R-SH 含量在30 ℃时开始增加,在40~55 ℃之间出现剧烈增加(图1c)。这表明鳗鱼肌原纤维蛋白在40~55 ℃下包埋在蛋白内部的巯基容易暴露出来,类似于猪肉的天然肌动球蛋白[27]。图1 的结果表明,鳗鱼肌原纤维蛋白的性质更接近高脂肪动物肌肉中的肌原纤维蛋白。这是因为肌肉纤维的大小不仅与物种相关,还会受到肌内脂肪含量的影响[28]。
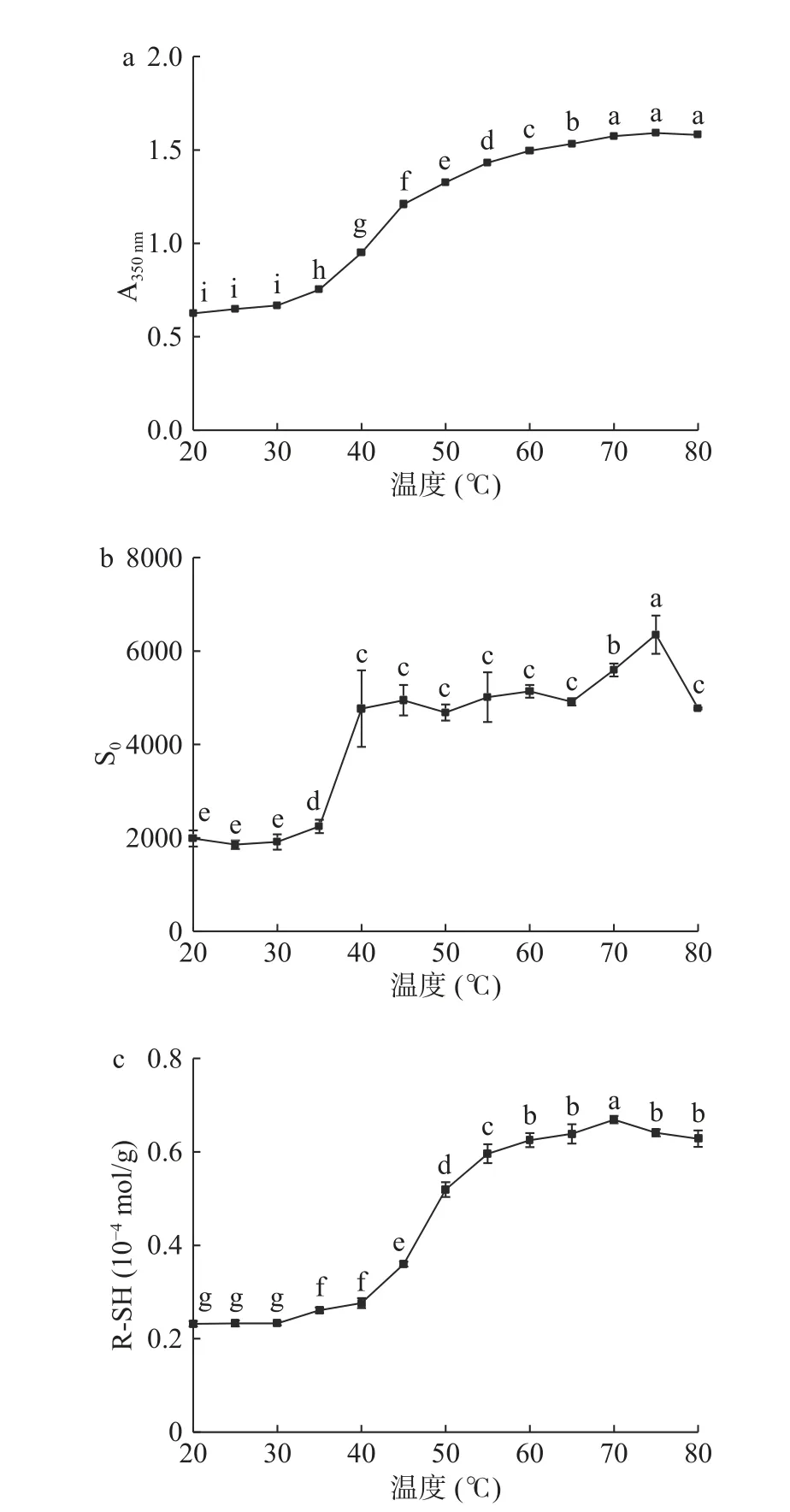
图1 温度对欧洲鳗肌原纤维蛋白浊度(a)、表面疏水性(b)和活性巯基(c)的影响Fig.1 Effect of temperature on turbidity (a), surface hydrophobicity (b) and reactive sulfhydryl groups (c) of European eel myofibrillar protein
2.1.3 NaCl 浓度对肌原纤维蛋白热稳定性的影响NaCl 浓度对欧洲鳗肌原纤维蛋白热稳定性的影响如图2 所示。在任一NaCl 浓度溶解的肌原纤维蛋白DSC 曲线上,均出现2 个明显的吸热峰。第一个吸热峰反映的是肌球蛋白的热变性温度,而第二个吸热峰反映的是肌动蛋白的热变性温度[29]。当NaCl 浓度从0.1 mol/L 提高至0.3 mol/L 时,肌球蛋白的热变性温度随之降低,但进一步提高NaCl 浓度却没有产生明显变化(图2)。相对于肌球蛋白,肌动蛋白的变性温度伴随NaCl 浓度的增加持续下降,这与NaCl浓度对鸡胸肉中肌原纤维蛋白热稳定性的影响一致[30],表明肌动蛋白的展开比肌球蛋白更容易受到NaCl浓度的影响。因此,添加NaCl 有利于肌动蛋白展开,促进与肌球蛋白交联形成高强度的蛋白凝胶。

图2 NaCl 浓度对欧洲鳗肌原纤维蛋白热变性温度的影响Fig.2 Effect of NaCl concentration on thermal denaturation temperature of European eel myofibrillar protein
2.1.4 NaCl 浓度对肌原纤维蛋白流变特性的影响通过测定流变性质中的储能模量(G')和损耗模量(G"),可以深入了解蛋白凝胶形成性能的特征,因此测定了NaCl 浓度对鳗鱼肌原纤维蛋白流变性质的影响(图3)。由0.1 mol/L NaCl 溶解的肌原纤维蛋白的G'在45 ℃时开始上升,在64 ℃时达到峰值,但进一步升温会导致G'下降。由0.3 mol/L NaCl 溶解肌原纤维蛋白的G'峰值出现在48 ℃,在48 ℃至53 ℃之间出现一定下降后,从53 ℃再次上升直至72 ℃后不再发生明显变化。0.5 mol/L NaCl 溶解的鳗鱼肌原纤维蛋白的G'变化趋势类似于0.3 mol/L NaCl 溶解的蛋白,但G'随温度的变化更明显,且达到峰值所需的温度更低(图3a)。据报道,G'下降是由于形成的凝胶网络被破坏导致蛋白构象变化引起的结果[31],而G'增加归因于展开的蛋白再次形成三维网状凝胶结构[32]。因此,G'随盐浓度变化的原因可能是肌原纤维蛋白在高浓度NaCl 条件下更容易溶解,从而在较低加热温度下就可以展开、聚集并形成三维网状凝胶结构。作为储能模量的G'其大小与凝胶特性有关[33],G'的上升代表凝胶刚性增强,表明形成了弹性凝胶结构[34]。这说明高的盐浓度有利于促进蛋白凝胶化过程,可以提高鳗鱼肌原纤维蛋白热诱导凝胶的结构强度。另一方面,鳗鱼肌原纤维蛋白的G"也随着NaCl 浓度的增加而增加,且峰值对应的温度都随着NaCl 浓度的升高而降低(图3b)。溶解在0.5 mol/L NaCl 中的鳗鱼肌原纤维蛋白的G'和G"的峰值远高于其他样品,表明0.5 mol/L NaCl溶解的鳗鱼肌原纤维蛋白可以形成热不可逆凝胶网络结构。因此,提高NaCl 浓度可以降低鳗鱼肌原纤维蛋白凝胶形成温度,有利于形成良好强度的凝胶,这可能是由于鳗鱼肌原纤维蛋白中富含疏水性氨基酸(表1)。
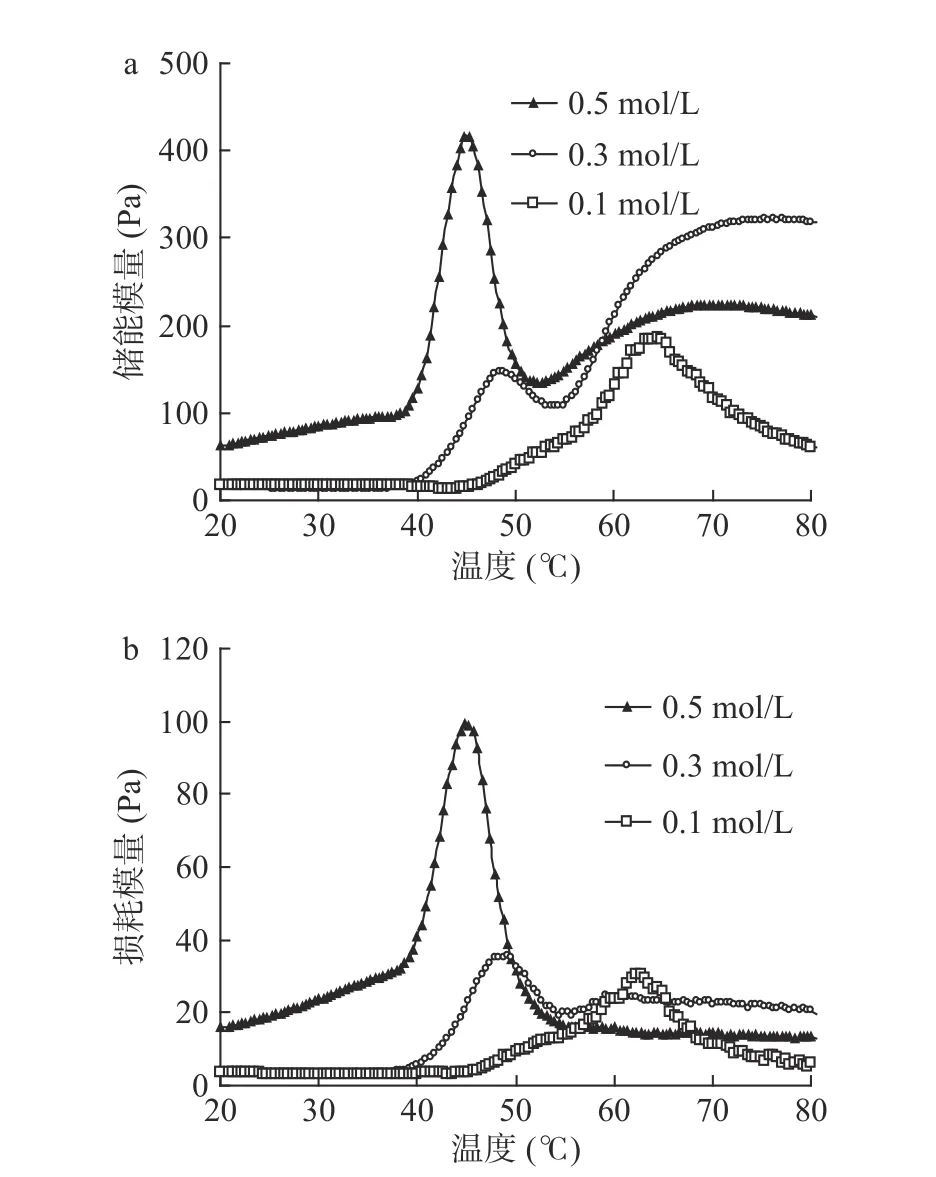
图3 NaCl 浓度对欧洲鳗肌原纤维蛋白储能模量(a)和损耗模量(b)的影响Fig.3 Effect of NaCl concentration on storage modulus (a) and loss modulus (b) of European eel myofibrillar protein
2.2 欧洲鳗肌原纤维蛋白凝胶性质分析
2.2.1 盐浓度对蛋白凝胶强度的影响 NaCl 浓度对欧洲鳗肌原纤维蛋白热诱导凝胶破断力和破断距离的影响如图4 所示。0.1 mol/L NaCl 溶解的肌原纤维蛋白热诱导凝胶其破断力最低,伴随NaCl 浓度增加出现显著上升(P<0.05)。类似的变化趋势也出现在NaCl 浓度对热诱导凝胶破断距离的影响中(图4b)。与猪肉肌原纤维蛋白相比[4],0.5 mol/L NaCl 溶解的鳗鱼肌原纤维蛋白具有更高的凝胶形成性能。这可能是提高NaCl 浓度可以降低鳗鱼肌原纤维蛋白的肌球蛋白和肌动蛋白的变性温度(图2),结果使溶解在0.5 mol/L NaCl 鳗鱼肌原纤维蛋白在较低的温度下容易变性伸展,逐渐形成高粘弹性的溶胶和高强度的凝胶(图3 和图4)。

图4 NaCl 浓度对欧洲鳗肌原纤维蛋白凝胶破断力(a)和破断距离(b)的影响Fig.4 Effect of NaCl concentration on breaking strength (a)and breaking distance (b) of European eel myofibrillar protein gels
2.2.2 盐浓度对鳗鱼肌原纤维蛋白凝胶组分的影响
欧洲鳗肌原纤维蛋白和不同NaCl 浓度制备的热诱导蛋白凝胶的电泳图谱如图5 所示。从图中可以看出,肌球蛋白重链和肌动蛋白是鳗鱼肌原纤维蛋白的主要成分。随着NaCl 浓度的增加,肌球蛋白重链和肌动蛋白的条带逐渐变浅,而不能进入SDS-PAGE分离胶的高分子量组分条带强度略有增加。有研究报道,高浓度NaCl 溶液可以改变肌原纤维蛋白的状态,导致溶解的肌球蛋白重链和肌动蛋白相互交联聚集形成肌动球蛋白[35-36]。因此,本研究获得的高强度鳗鱼肌原纤维蛋白热诱导凝胶可归因于溶解的肌球蛋白重链和肌动蛋白相互作用的结果(图4 和图5)。
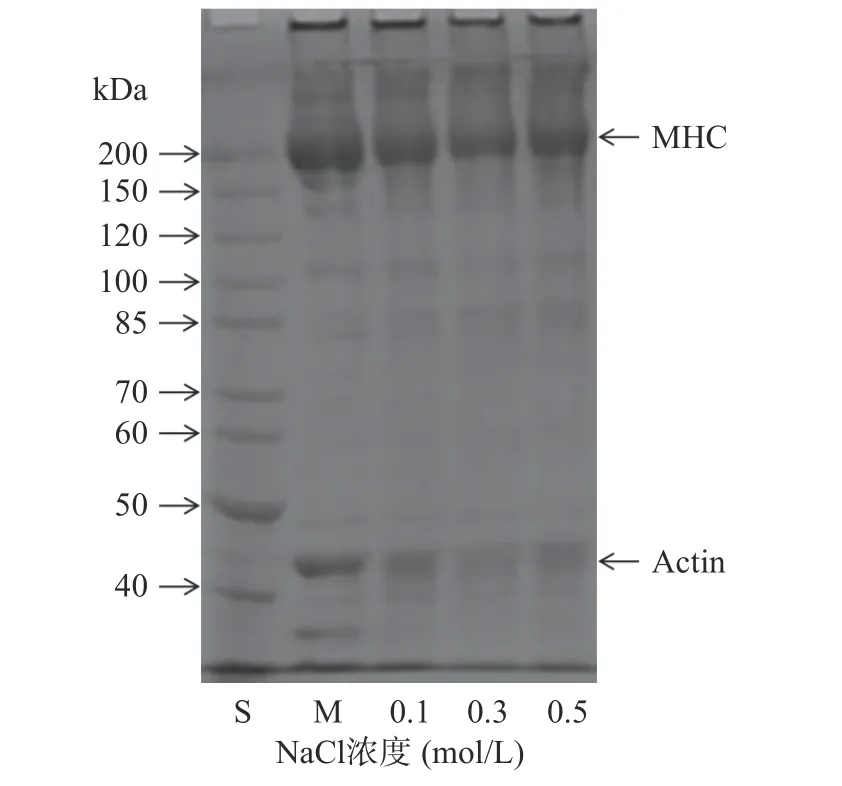
图5 肌原纤维蛋白和热诱导蛋白凝胶的SDS-PAGE 图谱Fig.5 SDS-PAGE patterns of myofibrillar protein and heatinduced protein gels
2.2.3 盐浓度对鳗鱼肌原纤维蛋白凝胶相互作用的影响 不同NaCl 浓度制备的热诱导鳗鱼肌原纤维蛋白凝胶的FTIR 光谱如图6 所示。凝胶样品在波数3293~3273 cm-1(酰胺A)处显示出强而宽的吸收带,这归因于N-H 和O-H 的伸缩振动。酰胺A 通常用于证明蛋白质和水分子之间的相互作用[37]。波数1700~1600 cm-1(酰胺I)处的条带归因于蛋白质二级结构中的C=O 伸缩振动[38]。波数在1539~1536 cm-1处和1401~1398 cm-1处的条带分别表示酰胺II 和酰胺III,与N-H 弯曲和C-N 伸缩振动有关[38]。这些区域内波数和吸光度的变化均可以解释为蛋白质水合作用所导致的凝胶中氢键的变化[39]。随着NaCl 浓度从0.1 mol/L 增加到0.5 mol/L,酰胺A 从波数3285 cm-1处移动到波数3273 cm-1处,表明增加NaCl 浓度可以促进蛋白质的水合,从而引起凝胶样品中分子内氢键的增加[37]。凝胶样品中酰胺I不受NaCl 浓度的影响,而酰胺II 的峰强度随NaCl浓度的增加而增加。据报道,酰胺II/酰胺I 的强度比增加可以解释为蛋白结构中α-螺旋含量的减少[40]。因此,NaCl 浓度的增加会引起蛋白质结构中α-螺旋的减少,同时引起蛋白质凝胶化过程中氢键数量的增加。另一方面,NaCl 还被发现对蛋白质的溶解有积极的影响[11]。因此,在热诱导鳗鱼肌原纤维蛋白凝胶化过程中,随着NaCl 浓度的增加,变性伸展的蛋白质分子之间的水合作用增强,从而提高蛋白凝胶的强度。

图6 热诱导肌原纤维蛋白凝胶的FTIR 图谱Fig.6 FTIR spectra of heat-induced myofibrillar protein gels
2.2.4 盐浓度对鳗鱼肌原纤维蛋白凝胶微观结构的影响 不同NaCl 浓度制备的热诱导鳗鱼肌原纤维蛋白凝胶的微观结构如图7 所示。在0.1 mol/L NaCl 制备的热诱导凝胶的微观结构中发现大量的团块和棒状纤维(图7a)。在0.3 mol/L NaCl 制备的肌原纤维蛋白凝胶中,尽管也存在一些棒状纤维,但出现了明显可见的细丝纤维结构(图7b)。当NaCl 浓度进一步增加至0.5 mol/L 时,凝胶中的网络结构变得均匀、致密、有序(图7c)。这与Iwasaki 等[41]报道的热诱导鸡胸肌肌动球蛋白凝胶化的结果一致,在0.4 mol/L NaCl 或更高浓度下可以形成致密的网络结构。图7 的结果再次表明,鳗鱼肌原纤维蛋白需要在一定NaCl 浓度下才能变性伸展形成具有良好强度的凝胶。

图7 NaCl 浓度对热诱导肌原纤维蛋白凝胶的微观结构的影响Fig.7 Effect of NaCl concentration on the microstructure of heat-induced myofibrillar protein gels
3 结论
欧洲鳗肌原纤维蛋白富含疏水性氨基酸,在加热过程中包埋在蛋白内部的疏水基团在35 ℃时开始暴露,活性巯基在40 ℃时开始暴露。随着NaCl浓度的增加,溶解的肌原纤维蛋白尤其是肌动蛋白的变性温度逐渐下降,而肌原纤维蛋白的G'和G"均逐渐增加。本研究的结果还表明,提高NaCl 浓度能够促进蛋白的展开以及在热诱导凝胶化过程中蛋白质分子间的氢键作用,从而形成具有致密网络结构和高强度的鳗鱼肌原纤维蛋白凝胶。研究结果将为热加工中利用NaCl 浓度调控鳗鱼肌肉蛋白变性和产品质构品质提供数据支撑,为利用鳗鱼生产加热预制调理食品提供理论指导。
