立体定向体部放疗联合粒细胞-巨噬细胞集落刺激因子治疗原发性肝癌患者的效果▲
2023-08-25周菲菲赵晓昀曾晓红
周菲菲 黄 荣 蒋 军 赵晓昀 曾晓红 何 瀚 陈 默
(佛山市第一人民医院肿瘤医院泌尿生殖肿瘤科,广东省佛山市 528000)
原发性肝癌是我国常见的恶性肿瘤之一,在所有恶性肿瘤中其致死率居于第2位[1]。因起病隐匿,多数肝癌患者确诊时已错过外科手术治疗的时机,因此其中远期生存率低、生存质量差[2]。近年来,由吸烟、病毒型肝炎、酗酒、黄曲霉毒素等高危因素造成的原发性肝癌的发病人群呈年轻化趋势,给我国居民健康造成严重威胁[3]。因此,探寻原发性肝癌的有效治疗方案是临床亟须解决的重大问题。研究表明,肝癌属于放射敏感肿瘤,其α/β值>10 Gy,致死剂量约为60 Gy/6周[4]。随着现代放疗技术的不断发展,立体定向体部放疗(stereotactic body radiation therapy,SBRT)已成为肝癌的常用治疗方法,其作为三维适形放疗的特殊类型,兼有局部控制率高、不良反应少等优点[5-6]。SBRT采用大分割剂量、短疗程放疗的模式[7],既保证肿瘤局部放射治疗剂量充足,又降低周围正常组织的照射剂量[8]。粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor,GM-CSF)是一种造血生长因子,可促进树突状细胞、巨噬细胞等抗原呈递细胞的增殖与分化,增强肿瘤相关抗原的提呈及表达,提高细胞毒性T淋巴细胞的活力,从而增强机体的抗肿瘤免疫作用[9-10]。国外已有研究表明,SBRT联合GM-CSF治疗可能通过增强免疫应答发挥抗肿瘤作用,其治疗肝癌的效果显著[1]。目前,我国关于SBRT联合GM-CSF治疗原发性肝癌的研究还处于初级阶段。本研究探讨SBRT联合GM-CSF治疗原发性肝癌患者的效果及对患者免疫指标的影响,以期为临床上放疗联合免疫治疗在肝癌患者中的应用提供更多临床证据。
1 资料与方法
1.1 临床资料 选取2018年3月至2020年3月在我院确诊为原发性肝癌的患者作为研究对象。纳入标准:(1)符合原发性肝癌的诊断标准[12],且经病理学确诊;(2)Karnofsky功能状态(Karnofsky Performance Status,KPS)评分[13]>70分;(3)Child-Pugh肝功能分级为A级或B级[14];(4)拒绝手术治疗,须行姑息性或根治性放疗的患者;(5)既往未接受过系统性抗肿瘤治疗;(6)预计生存期≥3 个月。排除标准:(1)肿瘤大小占全肝70%以上; (2)门静脉压明显升高或存在门静脉主干癌栓;(3)入组前30 d内有手术史;(4)合并肝肾心功能衰竭、免疫系统异常及凝血功能异常等疾病;(5)入组前30 d内出现消化道出血、肝性脑病等情况;(6)治疗期间因非肿瘤原因死亡;(7)对受试药物过敏;(8)伴重度肝硬化所致肝功能异常,或伴有明显腹水、黄疸;(9)随访资料不完整或失访。最终纳入31例患者作为研究对象,其中男性23例、女性8例,年龄34~68(45.21±9.28)岁;肿瘤直径为1~4 cm,中位直径为2.7 cm;Child-Pugh肝功能分级 A级18例、 B级13例;国际抗癌联盟肝癌临床分期[15]Ⅰ期21例,Ⅱ期10例。本研究由我院医学伦理委员会审核,患者本人及其亲属均同意参与本研究并签署知情同意书。
1.2 治疗方法 所有患者均接受SBRT联合GM-CSF治疗。(1)SBRT:嘱患者取仰卧位,使用真空体模进行固定,使用Philips公司BrillianceTMBig Core大孔径4D-CT模拟定位机(呼吸门控技术)进行靶区定位,对病灶10 cm范围进行增强扫描,层距为3 mm,层间距为1 mm,层厚为2.5~5.0 mm。扫描后在患者体表标记X、Y、Z坐标参数(放疗定位点),之后将获得的图像资料和相关数据传输至治疗计划系统进行四维重建,勾画出4D临床靶体积,在临床靶体积基础上,再根据放疗照射区域生理变化范围及摆位误差,各方向均外扩0.7 cm,从而获得计划靶体积。以计划靶体积几何中心作为射野等中心,采用SBRT技术,90%等剂量曲线覆盖计划靶体积,计划靶体积内部剂量差异为6%。放疗仪器为Varian Trilogy型直线加速器(Varian公司),SBRT的频率为1次/d(每周一至周五),总生物等效剂量为60 Gy,依据个体肿瘤计划靶体积大小制订疗程,其中计划靶体积<125 cm3者的靶区单次剂量为4.0~5.0 Gy,计划靶体积≥125 cm3者的靶区单次剂量为3.0~3.5 Gy[16]。(2)放疗开始后第2周给予患者腹部皮下注射注射用重组人GM-CSF(深圳市蓝安琪生物工程股份有限公司,批号:20140108;规格:100 μg/支),每次125 μg/m2,1次/d,连续治疗2周。
1.3 观察指标
1.3.1 近期疗效:于治疗后1个月、3个月、6个月、12个月,行上腹部增强CT或MRI检查评估临床疗效。参考实体瘤疗效评估标准1.1版(RECIST 1.1)[17]将疗效分为完全缓解、部分缓解、疾病稳定和疾病进展。疾病控制率=(完全缓解+部分缓解+疾病稳定)例数/总例数×100%,客观缓解率=(完全缓解+部分缓解)例数/总例数×100%。
1.3.2 远期疗效:记录无病生存期和总生存期。通过电话及回院复查的方式进行随访,以患者治疗结束出院作为随访起点,以患者死亡作为终点,随访截止日期为2021年3月。无病生存期即患者治疗结束后至疾病复发的时间;总生存期即治疗结束后至因疾病导致死亡的时间。
1.3.3 免疫指标:分别于治疗前1周及治疗后1周、1个月、3个月抽取患者外周静脉血5 mL,3 000 r/min离心10 min,获取上清液,置于-80 ℃冰箱备用待检。采用EPICS XL型流式细胞仪(Beckman Coulter公司)检测CD4+T淋巴细胞水平、CD8+T淋巴细胞水平及CD4+/CD8+值,相关试剂盒购自上海碧云天生物技术有限公司。
1.3.4 肝功能指标和肝癌相关指标:于治疗前1周及治疗后1周、1个月、3个月,抽取患者晨起空腹肘静脉血5 mL,3 000 r/min离心10 min后取上清液,应用7600型全自动生化分析仪(HITACHI公司)检测ALT、AST、总胆红素、白蛋白水平,采用ELISA检测患者血清甲胎蛋白、癌胚抗原水平,ELISA试剂盒购自武汉伊莱瑞特生物科技股份有限公司。
1.3.5 生活质量:于治疗前1周及治疗后1周、1个月、3个月,采用KPS评分[13,18]评估患者的生活质量,量表总分为100分,分值越高表示生活质量越好。
1.4 统计学分析 采用SPSS 22.0软件进行统计学分析。计数资料以例数(百分比)表示,组间比较采用χ2检验;计量资料以(x±s)表示,组间比较采用方差分析;采用Kaplan-Meier法进行生存分析,组间生存期的比较采用log-rank检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 患者的近期疗效 31例患者治疗后1个月的随访率为100.0%,治疗后3个月有1 例患者失访,治疗后6个月有2例患者失访,治疗后12个月有4例患者失访。治疗后1个月、3个月、6 个月和12个月的客观缓解率分别为77.42%(24/31)、90.00%(27/30)、58.62%(17/29)和40.74%(11/27),疾病控制率分别96.77%(30/31)、93.33%(28/30)、75.86%(22/29)和70.37%(19/27)。见表1。

表1 患者的近期疗效(n)
2.2 患者的远期疗效 31例患者的随访时间为(16.91±4.81)个月,中位无病生存期为9.1个月,中位总生存期为21.0个月。不同临床特征患者的中位无病生存期和中位总生存期比较,差异均无统计学意义(均P>0.05),见表2。
表2 不同临床特征患者的中位无病生存期和中位总生存期比较(个月)
2.3 治疗前后患者免疫指标的比较 与治疗前1周比较,治疗后1周患者的CD4+T淋巴细胞、CD8+T淋巴细胞水平和CD4+/CD8+值下降(均P<0.05);治疗后1 周、治疗后1个月、3个月患者的 CD4+T淋巴细胞、CD8+T淋巴细胞水平和CD4+/CD8+值逐渐升高(均P<0.05)。见表3。

表3 治疗前后患者免疫指标的比较(x±s)
2.4 治疗前后患者肝功能指标的比较 与治疗前1周比较,治疗后1 周患者的ALT、AST水平均升高,白蛋白水平下降(均P<0.05);治疗后1个月、3 个月,患者的ALT、AST、白蛋白水平与治疗前1周比较,差异均无统计学意义(均P>0.05),而AST、ALT水平低于治疗后1周,白蛋白水平高于治疗后1周(均P<0.05)。见表4。

表4 治疗前后患者肝功能指标的比较(x±s)
2.5 治疗前后患者血清癌胚抗原、甲胎蛋白水平及KPS评分的比较 治疗后1周、1个月及3个月,患者的血清癌胚抗原、甲胎蛋白水平较治疗前1周有所下降,且治疗后1个月、3个月患者的血清癌胚抗原、甲胎蛋白水平低于治疗后1周,治疗后3个月患者的血清甲胎蛋白水平低于治疗后1个月(均P<0.05)。患者的KPS评分有先下降后升高的趋势,但仅治疗后1周与治疗后3个月的评分差异有统计学意义(P<0.05)。见表5。
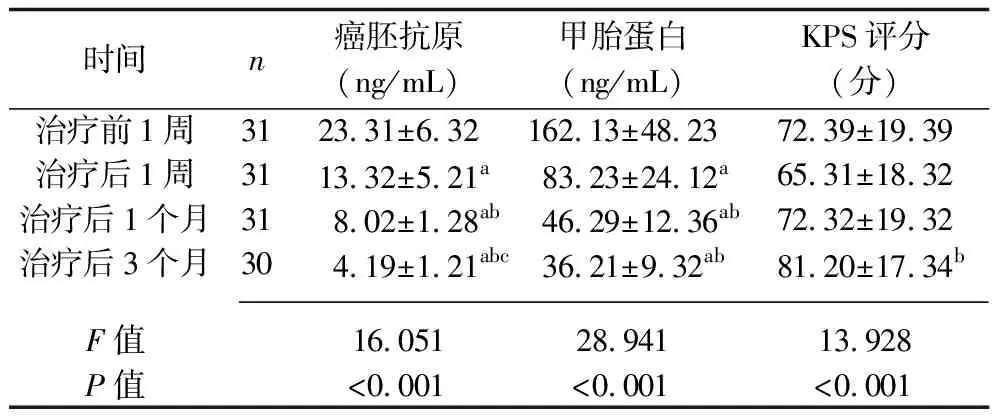
表5 治疗前后患者血清癌胚抗原、甲胎蛋白水平及KPS评分的比较(x±s)
3 讨 论
2020年全球癌症统计报告显示,原发性肝癌的新发病例数及病死例数分别位居第7、第3[21]。考虑到大范围的肝切除可导致肝癌患者的并发症发生率及病死率升高,因此,放疗是针对失去手术治疗机会的原发性肝癌患者的主要治疗手段之一[22-23]。有研究显示,当常规放疗剂量>40 Gy时肝功能不全的发生率较高,因此为了避免患者出现肝功能不全,临床上在进行常规放疗时常给予患者相对较小的照射剂量,导致肿瘤靶区照射剂量相对不足,而肿瘤照射剂量不足被认为是原发性肝癌局部控制率低的主要原因[24]。SBRT是一种低分次、短疗程、大分割剂量放疗模式,可弥补传统放疗多数情况下无法彻底杀灭或精准杀灭肿瘤细胞的不足[25]。研究表明,SBRT既可保证足够的肿瘤靶区照射剂量,又可减少射线对正常组织细胞的损伤,具有疗效显著、患者耐受性好等优势[5]。
近年来,有研究表明放疗和免疫治疗可产生远隔效应,加强抗原释放,提高机体对肿瘤的免疫反应,具有良好的应用前景[26]。GM-CSF是一种造血生长因子,可通过刺激树突状细胞增殖来增加表面组织相容性复合体的表达,进一步提高免疫细胞的肿瘤抗原呈递能力,从而起到抗肿瘤的作用。临床研究显示,SBRT与GM-CSF联合应用可协同提高机体免疫力[27]。本研究中,经SBRT联合GM-CSF治疗后,原发性肝癌患者治疗后1个月、3个月的客观缓解率分别为77.42%、90.00%,疾病控制率分别96.77%、93.33%,中位总生存期为21.0个月,长于王卉等[28]报告的单纯SBRT治疗后肝癌患者的中位总生存期(19.5个月),由此可见SBRT联合GM-CSF治疗原发性肝癌的临床远期疗效较好。但治疗后6 个月、12个月,原发性肝癌患者的客观缓解率和疾病控制率开始逐渐降低,原因可能与部分患者的肝内肿瘤负荷较大、临床分期较晚有关。因此,临床医师可在SBRT联合GM-CSF治疗的基础上,采取必要的治疗措施以进一步提高患者的疗效。
作为辅助性T淋巴细胞的一种类型,当机体受到感染或发生炎症反应时,CD4+T淋巴细胞起到辅助性调节机体免疫的作用。而CD8+T淋巴细胞属于抑制性T淋巴细胞,在抑制肿瘤细胞增殖分化、浸润及转移方面具有调节作用,CD4+/CD8+值降低提示机体免疫力下降[29]。本研究结果显示,经SBRT联合GM-CSF治疗后1 周,患者的CD4+T淋巴细胞、CD8+T淋巴细胞水平及CD4+/CD8+值降低,但在治疗后1个月以上指标呈升高趋势且逐渐恢复至治疗前水平,提示经SBRT联合GM-CSF治疗后,肿瘤细胞被破坏,机体免疫功能逐渐恢复正常。研究表明,SBRT与免疫疗法联合应用可以直接诱导肿瘤细胞出现致死性DNA损伤,提高肿瘤细胞的免疫原性,诱导机体产生抗肿瘤免疫反应[30]。研究表明,活化的CD4+T淋巴细胞及CD8+T淋巴细胞可以同时释放干扰素,增强免疫细胞识别和杀伤肿瘤细胞的能力,促进抗肿瘤免疫细胞向肿瘤微环境迁移、聚集,诱发免疫应答[31]。因此,SBRT联合GM-CSF治疗可通过增强机体免疫功能,诱导机体产生抗肿瘤免疫反应,发挥显著的抗肿瘤作用。
本研究中,多数患者肝功能损伤发生在SBRT联合GM-CSF治疗1 周内,表现为ALT、AST水平升高,白蛋白水平下降,但在治疗后1 个月肝功能基本恢复到治疗前水平。提示采用SBRT联合GM-CSF治疗的患者肝功能恢复较快,安全性较好。同时,本研究结果显示,治疗后3个月,患者的KPS评分高于治疗后1周,提示治疗后3个月患者生活质量明显提高;而治疗后1周,患者的血清癌胚抗原和甲胎蛋白水平开始降低,提示SBRT联合GM-CSF抗肿瘤效果确切。
综上所述,SBRT联合GM-CSF可作为治疗原发性肝癌的新方案,该联合治疗方案能改善患者的生活质量,增强患者的免疫功能,提高患者远期临床疗效。
