血清MIC-1、LMTK-3和IGFBP-7水平检测在消融联合化疗治疗晚期肺癌患者预后中的评估价值
2023-08-25曾颖鸥邬云龙
戴 斌,曾颖鸥,乔 弟,邬云龙,王 勐,王 强
上海健康医学院附属周浦医院胸外科,上海 201318
肺癌是临床上最为常见的恶性肿瘤,具有发病率和病死率均较高等特点,其病死人数在恶性肿瘤死亡人数中占比最多,严重威胁患者的生命安全。肺癌中绝大部分为非小细胞肺癌,由于缺乏早期的典型症状和敏感的诊断指标,在确诊时往往已经发展至中晚期,对患者的预后极为不利[1]。化疗和放疗是治疗晚期肺癌的重要手段,经济实用,但疗效并不理想。经皮微波热消融疗法是近些年来发展起来的新型治疗方法,具有效果显著,微创和并发症低等优势,被广大患者所接受[2]。血清学指标在肺癌诊断、治疗效果和预后评估方面仍具有不可替代的作用。巨噬细胞抑制因子1(MIC-1)是肺癌的特异性指标,参与了肺癌的增殖、侵袭和转移等过程,同时也是评估预后的指标之一[3];Lemur酪氨酸激酶3(LMTK-3)是酪氨酸激酶的一种亚型,参与了细胞信号通路的转导,在肺癌的发生、发展过程中具有重要作用[4];胰岛素样生长因子结合蛋白7(IGFBP-7)是一种抑制肿瘤细胞增殖的细胞因子,对肿瘤发生、发展具有重要的抑制作用[5]。本研究通过检测晚期肺癌患者血清MIC-1、LMTK-3和IGFBP-7水平,观察其在消融联合化疗方案治疗后的变化及其在预后评估中的临床价值。
1 资料与方法
1.1一般资料 选择2019年1月至2021年6月在本院就诊的晚期肺癌患者95例为肺癌组,其中男50例,女45例;年龄45~75岁,平均(61.20±8.97)岁;病灶部位:周围型54例,中央型41例;肿瘤类型:腺癌43例,非腺癌52例;肿瘤最大径:>4 cm 48例,≤4 cm 47例。纳入标准:预计生存期超过3个月;经支气管镜下活检确诊为非小细胞肺癌;Karnofsky功能状态评分在60分以上。排除标准:合并其他部位恶性肿瘤;临床资料不完整;存在凝血功能障碍;既往有放疗、化疗史;存在心、肝、肾等重要脏器功能不全;伴有严重基础疾病;存在智力低下或者精神性疾病。选择同期在本院就诊的健康体检者45例为健康对照组,其中男23例,女22例;年龄47~77岁,平均(60.89±7.11)岁。两组年龄和性别等基线资料比较,差异无统计学意义(P>0.05),具有可比性。所有患者均签署知情同意书,本研究经本院医学伦理委员会审核通过(2018-周医-0153)。
1.2方法
1.2.1治疗方法 所有晚期肺癌患者采用经皮微波热消融疗法治疗,完成后1周内进行化疗。经皮微波热消融疗法:术前常规检查,明确穿刺点、穿刺角度和进针的深度,在局部麻醉满意后,插入微波穿刺针,并进行CT检查,确定针尖位置准确后,在进针的皮肤部位固定穿刺针,连接微波管和生理盐水进出管进行消融,一般持续时间为12~20 min,功率为30~45 W,治疗结束后再次进行CT复查,观察病灶残存情况。化疗方案:根据肿瘤类型不同采取不同的化疗方案,对于腺癌患者采用培美曲塞联合顺铂方案治疗,第1~3天顺铂按照75 mg/m2静脉滴注,第1天采用培美曲塞500 mg/m2静脉滴注。对于鳞癌患者采用吉西他滨联合顺铂(GP)方案治疗,第1~3天顺铂按照75 mg/m2静脉滴注;第1、8天吉西他滨按照1 000 mg/m2静脉滴注。21 d为一个治疗周期,连续4个周期为一个疗程。
1.2.2疗效评估 患者疗程结束后进行疗效评估,可见的肿瘤全部消失,临床症状消失至少4周以上为完全缓解(CR);肿瘤病灶体积缩小50%以上,临床症状消失4周以上,无新病灶出现为部分缓解(PR);肿瘤病灶缩小25%~50%,无新病灶出现为稳定(SD);肿瘤体积缩小<25%,或者肿瘤出现增大,为进展(PD)。
1.2.3随访 患者治疗后通过门诊复查、微信、QQ和电话等方式均得到随访,随访截止日期为2022年7月30日,所有患者随访1年以上,死亡是其终点事件。患者治疗后第1年3个月随访一次,第2年6个月随访一次。
1.2.4血液标本收集 患者入院后和化疗一个疗程结束后抽取肘静脉血约5 mL,在室温下静置约20 min,以3 000 r/min离心10 min,离心半径为15 cm,去上清液约3 mL,放置在-80 ℃的冰箱中待测,采用酶联免疫吸附试检测血清MIC-1、LMTK-3和IGFBP-7水平,严格按照试剂盒说明书操作,试剂盒购自迈克生物股份有限公司。
1.3观察指标 观察肺癌组和健康对照组血清MIC-1、LMTK-3和IGFBP-7水平的变化;比较晚期肺癌患者治疗前后和不同疗效患者血清MIC-1、LMTK-3和IGFBP-7水平的变化,并对影响预后的因素进行单因素和多因素分析;分析治疗前血清MIC-1、LMTK-3和IGFBP-7水平在预测晚期肺癌治疗后发生死亡中的效能。
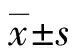
2 结 果
2.1两组血清MIC-1、LMTK-3和IGFBP-7水平变化 肺癌组治疗前后血清MIC-1和LMTK-3水平均明显高于健康对照组,差异有统计学意义(P<0.05);肺癌组血清MIC-1和LMTK-3水平较治疗前明显降低,差异有统计学意义(P<0.05)。肺癌组治疗前后血清IGFBP-7水平明显低于健康对照组,差异有统计学意义(P<0.05);治疗后肺癌组血清IGFBP-7水平较治疗前明显升高,差异有统计学意义(P<0.05)。见表1。
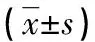
表1 两组血清MIC-1、LMTK-3和IGFBP-7水平的变化
2.2不同疗效晚期肺癌患者治疗前血清MIC-1、LMTK-3、IGFBP-7水平比较 疗程结束后晚期肺癌患者出现CR+PR 66例,SD+PD 29例,SD+PD晚期肺癌患者治疗前血清MIC-1和LMTK-3水平明显高于CR+PR晚期肺癌患者,血清IGFBP-7水平明显低于CR+PR晚期肺癌患者,差异有统计学意义(P<0.05)。见表2。
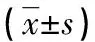
表2 不同疗效晚期肺癌患者治疗前血清MIC-1、LMTK-3和IGFBP-7水平比较
2.3晚期肺癌患者预后的单因素分析 所有患者均成功随访1年以上,死亡23例,存活72例。死亡患者中腺癌和肿瘤最大径>4 cm患者比例,治疗前血清MIC-1和LMTK-3水平明显高于存活患者,差异有统计学意义(P<0.05),而死亡患者治疗前血清IGFBP-7水平明显低于存活患者,差异有统计学意义(P<0.05)。见表3。
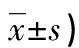
表3 晚期肺癌患者预后的单因素分析(n或
2.4晚期肺癌患者预后的多因素分析 将单因分析中差异有统计学意义的指标作为自变量,进行赋值:肿瘤类型(腺癌=1,非腺癌=0)、肿瘤最大径(>4 cm=1,≤4 cm=0)、血清MIC-1(>1 909.59 pg/mL=1,≤1 909.59 pg/mL=0)、LMTK-3(>16.41 ng/mL=1,≤16.41 ng/mL=0)和IGFBP-7(>24.54 ng/L=1,≤24.54 ng/L=0),进行多因素Logistic回归分析,发现治疗前血清MIC-1和LMTK-3水平升高,IGFBP-7水平降低是晚期肺癌患者治疗后1年内发生死亡的独立危险因素(P<0.05)。见表4。
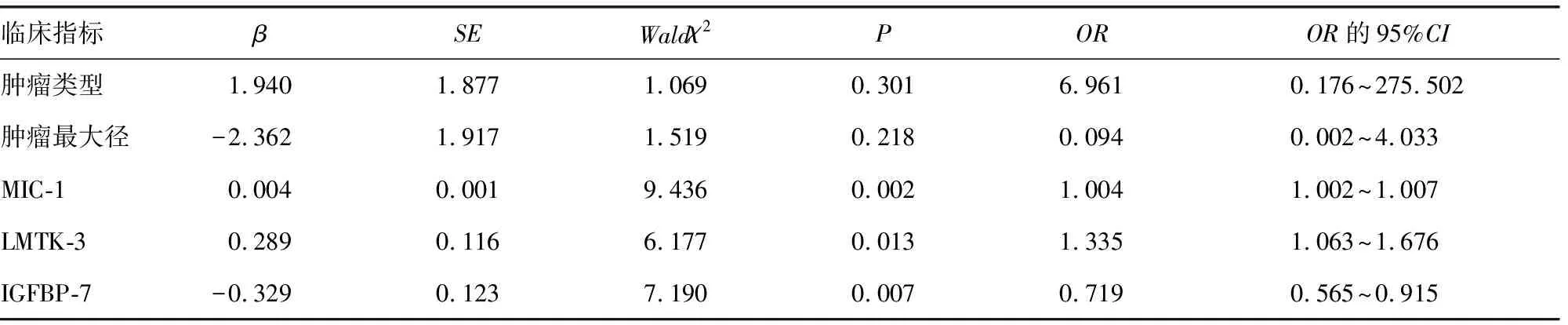
表4 晚期肺癌患者预后的多因素分析
2.5治疗前血清MIC-1、LMTK-3和IGFBP-7水平预测晚期肺癌患者治疗后发生死亡的效能 根据是否发生死亡将指标进行二元Logistic回归分析,得到方程Y=0.004×XMIC-1+0.29×XLMTK-3-0.35×XIGFBP-7-7.77,将其作为联合检测指标,联合检测预测晚期肺癌患者治疗后发生死亡的灵敏度为91.3%,特异度为95.8%,AUC为0.974,AUC明显大于MIC-1(Z=2.378,P=0.017)、LMTK-3(Z=2.897,P=0.004)和IGFBP-7(Z=3.213,P=0.001)单独检测,而3项指标单独检测间的AUC比较,差异无统计学意义(P>0.05)。见表5和图1。
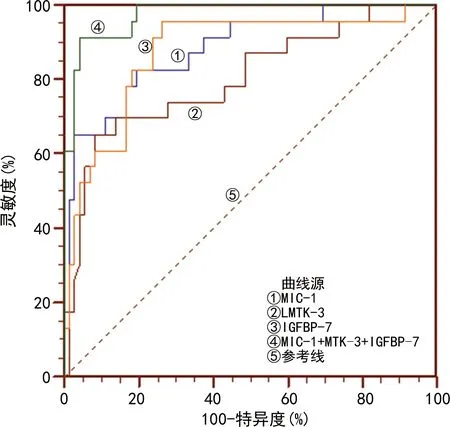
图1 各项指标预测晚期肺癌治疗后发生死亡的ROC曲线

表5 血清MIC-1、LMTK-3和IGFBP-7水平预测晚期肺癌治疗后发生死亡的效能
3 讨 论
肺癌是病死率居第一位的恶性肿瘤,中晚期肺癌5年生存率不足15%,严重影响患者预后。晚期肺癌的患者临床上主要采取化疗、放疗和靶向治疗等方案治疗,但长期使用会导致患者耐药和并发症发生,影响患者的预后[6]。近年来,微波热消融疗法被应用于多种肿瘤的治疗中,已经取得较好的效果,创伤小,能够缓解患者的症状,延长生存期,从而改善患者的预后[7]。临床上对晚期肺癌患者预后的评估主要依靠影像学检查,但由于价格昂贵和存在辐射等局限性,短期内重复检查并不适用。而血清学指标对恶性肿瘤疗效的评估具有较高的价值,并且具有重复性好,检测速度快和采样方便等优势,逐渐被应用到临床对恶性肿瘤预后的评估中,已经成为评价恶性肿瘤的热点。
本研究结果显示,肺癌组治疗前血清MIC-1水平明显高于健康对照组,并且消融联合化疗后能够明显降低血清MIC-1水平,说明MIC-1的来源可能与肺癌具有密切关系。MIC-1是人转化生长因子β族的重要成员之一,对恶性肿瘤细胞具有明显调控作用,在癌症的早期主要诱导肿瘤的凋亡,抑制肿瘤的增殖,而在肿瘤的晚期具有促进肿瘤细胞转移的作用,参与肿瘤的进展[8]。本研究结果发现,SD+PD晚期肺癌患者血清MIC-1水平明显高于CR+PR晚期肺癌患者,并且发现晚期肺癌死亡患者肿瘤最大径>4 cm患者比例和MIC-1水平明显高于存活患者(P<0.05)。多因素分析发现血清MIC-1水平升高是晚期肺癌患者治疗后1年内发生死亡的独立危险因素,提示血清MIC-1水平可能是影响晚期肺癌患者预后的重要指标。MIC-1在结肠癌、肝癌和肺癌患者血清中呈高表达[9],在卵巢癌中的研究发现MIC-1的高表达与淋巴结转移具有密切关系[10]。在健康人内血清MIC-1呈低表达,而在急性炎症患者中其血清水平呈一过性升高,在癌症中期患者体内其水平呈持续性升高,目前的研究结果显示血清MIC-1水平有望成为判断恶性肿瘤患者预后的血清标志物。本研究结果显示,治疗前血清MIC-1水平为2 096.75 pg/mL时,预测晚期肺癌患者治疗后1年内发生死亡的灵敏度为82.6%,特异度为80.6%,AUC为0.883,与文献[11]报道的结果一致,说明治疗前血清MIC-1水平对晚期肺癌患者的预后具有较高的预测价值。
本研究结果显示,肺癌组治疗前血清LMTK-3水平明显高于健康对照组,治疗后血清LMTK-3水平较治疗前明显降低,说明血清LMTK-3与肺癌具有一定的联系。LMTK-3是络氨酸激酶的一种亚型,通过对蛋白质磷酸化的催化,参与了肿瘤细胞的增殖、凋亡和分化过程,通过信号通路的转导,影响细胞的生物学特征,并认为LMTK-3在癌症发生、发展过程中可能起促进作用[12]。本研究结果显示疗效为SD+PD的晚期肺癌患者治疗前血清LMTK-3水平明显高于疗效为CR+PR晚期肺癌患者,并且发现治疗后1年内发生死亡的患者治疗前血清LMTK-3水平明显高于存活患者,并发现血清LMTK-3水平升高是晚期肺癌治疗后1年内发生死亡的独立危险因素,与文献[13]报道一致。雌激素一般通过雌激素受体(ER)的通路提高基因的转录水平,促进细胞的增殖和凋亡,而LMTK-3通过促进ER基因的激活,从而调节ER通路[14]。现有研究结果显示ER通路广泛存在于肺和胃等靶器官中,尤其肺癌患者的生物学特征与ER水平具有密切关系,故ER通路被激活是肺癌患者的癌组织和血清中LMTK-3出现高表达的原因之一[15]。本研究结果显示,治疗前血清LMTK-3水平为19.79 ng/mL时,预测晚期肺癌患者治疗后1年内发生死亡的灵敏度为65.2%,特异度为91.7%,AUC为0.801,说明治疗前血清LMTK-3有可能成为预测晚期肺癌患者1年内发生死亡的指标。
本研究结果显示,肺癌组治疗前血清IGFBP-7水平明显低于健康对照组,治疗后肺癌患者血清IGFBP-7水平出现明显升高,说明IGFBP-7是肺癌的重要保护因子[16]。IGFBP-7是胰岛素样生长因子(IGF)的重要受体,属分泌蛋白,广泛存在于组织和器官中。IGFBP-7与肿瘤的关系较为复杂,主要通过调节细胞增殖、侵袭和血管形成,从而抑制肿瘤的生长[17]。在恶性肿瘤中IGFBP-7的基因表达受到明显抑制,从而促进血管内皮生长因子(VEGF)引起的肿瘤血管形成被激活,促进肿瘤的生长和转移[18]。IGFBP-7主要通过竞争性抑制IGF-1与其受体结合,从而保持IGF-1免受相关水解酶的降解[19]。本研究结果显示,疗效为SD+PD的晚期肺癌患者血清IGFBP-7水平明显低于疗效为CR+PR的晚期肺癌患者,并且发现死亡患者血清IGFBP-7水平明显低于存活患者,多因素分析发现血清IGFBP-7水平降低是晚期肺癌治疗后1年内发生死亡的独立危险因素。本研究结果显示,治疗前血清IGFBP-7水平为23.6 ng/L时,预测晚期肺癌患者治疗后1年内死亡的灵敏度为95.7%,特异度为73.6%,AUC为0.875,说明治疗前血清IGFBP水平在预测晚期肺癌的预后中具有重要的价值。同时,本研究将MIC-1、LMTK-3和IGFBP-7进行Logistic回归分析,得到的方程作为联合检测模型,发现联合检测预测晚期肺癌患者治疗后1年内发生死亡的灵敏度为91.3%,特异度为95.8%,AUC为0.974,其AUC明显高于MIC-1、LMTK-3和IGFBP-7单独检测的AUC。这说明3项指标之间具有某种互补性,其具体内在联系仍不清楚,现已知ER通路和IGF-1信号通路具有相互干扰和协同促进肺癌发展的作用[15,17],故其具体机制仍需进一步研究。
综上所述,血清MIC-1、LMTK-3和IGFBP-7水平是消融联合化疗治疗晚期肺癌后的重要疗效评估指标,联合检测有助于预测晚期肺癌治疗后的预后。
