血浆游离mtDNA在急性肺栓塞中的诊断价值及其与病情严重程度及临床常用指标的相关性
2023-08-25谭娇娜杨泽华
谭娇娜,杨泽华
1.山西医科大学第一临床医学院,山西太原 030001;2.山西医科大学第一医院检验科,山西太原 030001;
急性肺栓塞(APE)是以各种栓子阻塞肺动脉或其分支为发病原因的一组疾病或临床综合征的总称,发病率和病死率较高,是继急性心肌梗死和脑卒中之后心血管死亡的第三大常见原因,给家庭和国家带来了沉重的疾病负担[1]。目前,确诊APE的金标准为多层螺旋CT肺动脉造影(CTPA),但存在费用昂贵和一定程度的不便捷性[2]。线粒体DNA(mtDNA)是来自线粒体双链分子的小DNA片段,正常生理情况下,mtDNA被包裹在线粒体的双层膜结构中,故这些分子在健康人的外周血中以非常低的水平循环,当组织出现氧化应激或者缺氧等损伤时,组织内线粒体双层膜结构遭到破坏,mtDNA便从凋亡、坏死的细胞中释放入血,导致外周血游离mtDNA水平增加[3]。本研究旨在探讨血浆游离mtDNA的变化,分析其与APE患者病情严重程度、临床常用指标间的相关性,并探讨其对APE的诊断价值,从而为APE的临床诊治提供帮助。
1 资料与方法
1.1一般资料 收集2021年3月至2022年12月就诊于山西医科大学第一医院(以下简称本院)呼吸与危重症医学科90例首次经CTPA确诊的APE患者作为研究对象。(1)纳入标准:①APE的诊断符合APE指南[4];②发病到入院时间小于24 h;③入组前未经抗凝或溶栓治疗;④临床资料完整。(2)排除标准:①年龄<18岁;②患者住院时间不满48 h;③临床资料不完整;④处于终末期心脏或肾衰竭;⑤合并可能与血浆mtDNA水平升高相关的疾病(肿瘤、多发性创伤、脑卒中、严重脓毒症或感染性休克、急性心肌梗死、心脏骤停)等;⑥存在免疫功能低下或免疫缺陷、免疫抑制。按照欧洲心脏病学会(ESC)和欧洲呼吸学会(ERS)共同制定的《急性肺栓塞诊断和治疗指南》[4],根据APE患者的血流动力学指标、临床症状、肺栓塞风险评分(PESI)、肺栓塞严重指数简化版(sPESI)评分、是否存在右心功能不全和心脏生物标志物异常,将90例患者分为低危组、中危组、高危组[4],每组30例。选取同期年龄匹配的健康体检者30例作为健康组。所有研究对象或其家属签署知情同意书,本研究符合医学伦理学标准,并通过了本院伦理委员会的批准(批件号KYLL-2023-027)。
1.2仪器与试剂 使用仪器主要包括美国QuantStudioTM5实时荧光定量聚合酶链反应(PCR)仪、全自动血常规分析仪(日本Sysmex XN-20)、全自动凝血分析仪(日本Sysmex CS5100)、全自动化学发光仪(中国万泰生物Caris200)、不同型号离心机、各种规格移液器等。使用试剂盒主要包括实时荧光定量PCR试剂盒(大连TaKaRa公司)、寡核苷酸引物(大连宝生物工程有限公司)、DNA提取试剂盒(中国OmegaBio-Tek公司,SE Blood DNA Kit 50)。使用Oligo 6.0设计特异性引物,根据所设计引物的碱基序列合成引物(由大连宝生物工程有限公司完成)。寡核苷酸引物序列为16SrRNA F:5′-ACTTTGCAAGGAGAGCCAAA-3′;16SrRNA R:5′-TGGACAACCAGCTATCACCA-3′。
1.3方法
1.3.1临床资料收集 收集患者性别、年龄、出入院时间、入院诊断、既往基础疾病,严格记录患者心率、呼吸、血压、脉搏、体温、动脉血氧饱和度(SaO2)等一般资料,记录患者的超声心动图、CTPA检查结果,同时观察患者治疗过程中有无心脏骤停、梗阻性休克、持续性低血压等血流动力学不稳定状况。
1.3.2血浆游离mtDNA提取 采集所有研究对象入院第1天未经治疗的肘静脉血5 mL,经乙二胺四乙酸二钾(EDTA-K2)抗凝(紫管),将所有标本于30 min内经3 000×g离心10 min,吸取上清液200 μL于高压灭菌的EP管中;再将上清液于高速离心机室温18 000×g离心10 min,轻轻吸取上清液150 μL于新的EP管中,—80 ℃冰箱冻存,用于血浆游离mtDNA检测。严格按照DNA提取试剂盒说明书提取mtDNA。
1.3.3其他临床常用指标检测 采集所有受试者5 mL未经抗凝或溶栓治疗的肘静脉血于紫管(含EDTA-K2抗凝剂)中,使用日本Sysmex XN-20全自动血常规分析仪进行血常规检测;同时采集5 mL肘静脉血于淡蓝管(含枸橼酸钠抗凝剂)中,使用日本Sysmex CS5100全自动凝血分析仪并采用免疫比浊法进行D-二聚体(D-D)、纤维蛋白(原)降解产物(FDP)检测;另外采集5 mL肘静脉血于金黄色管(含促凝剂)中,采用中国万泰生物Caris200全自动发光仪(磁微粒法)进行心肌肌钙蛋白T(cTnT)和N末端脑钠肽前体(NT-proBNP)检测。所有试剂均使用原装配套试剂,操作严格按照试剂说明书及相关标准操作规程进行。
1.4标准曲线的制备 通过分光光度计测定并计算得到质粒的浓度为2.05×1012copies/mL,用灭菌去离子水依次倍比稀释,得到浓度分别为2.05×1012、2.05×1011、2.05×1010、2.05×109、2.05×108、2.05×107copies/mL的6个标准品,使用美国QuantStudioTM5 PCR 仪制备标准曲线。PCR反应体系为10 μL,95 ℃预变性10 s,95 ℃变性5 s,58 ℃退火8 s,72 ℃延伸10 s,共40个循环。标准曲线回归方程为Y=—3.772X+55.079(R2=0.995),其中X为模板拷贝数以10为底的对数值,Y为Ct值。
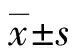
2 结 果
2.1各组基线资料比较 各组年龄、性别比较,差异无统计学意义(P>0.05);高危组住院天数明显多于低危组,差异有统计学意义(P<0.001),高危组心率明显快于低危组与健康组,差异有统计学意义(P<0.05);高危组、中危组和低危组SaO2均低于健康组,差异有统计学意义(P<0.05);高危组的收缩压(SBP)明显低于中危组、低危组和健康组,高危组的舒张压(DBP)明显低于低危组和健康组,差异有统计学意义(P<0.05)。见表1。
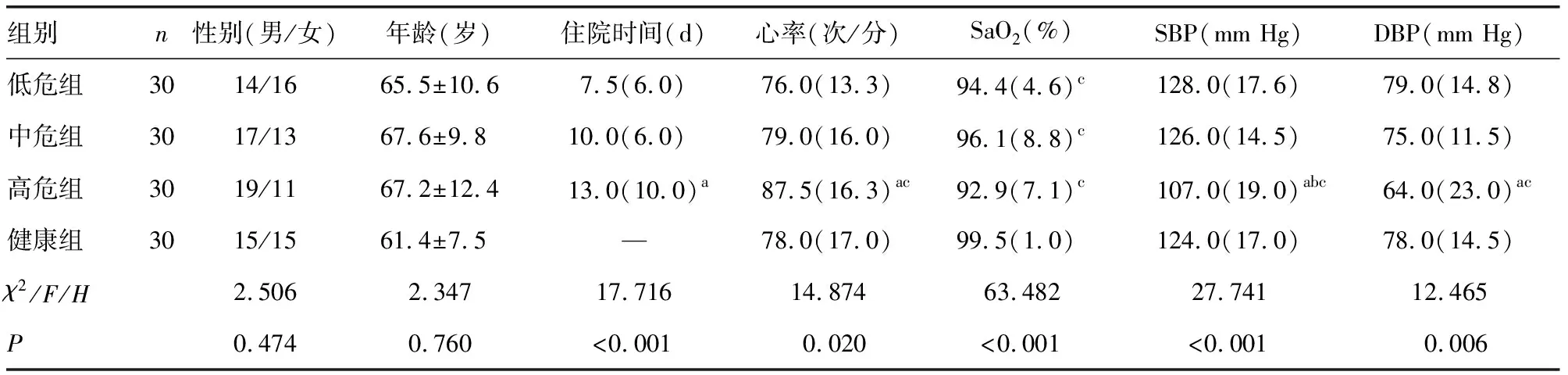
表1 各组基线资料比较[n/n或M(QR)]
2.2各组血常规及其他临床常用指标比较 各组红细胞体积分布宽度(RDW)、血小板计数(PLT)水平比较,差异无统计学意义(P>0.05);高危组白细胞计数(WBC)、D-D、FDP、cTnT水平明显高于中危组、低危组和健康组,差异有统计学意义(P<0.05);高危组红细胞计数(RBC)、血红蛋白(Hb)水平明显低于健康组,差异有统计学意义(P<0.05);高危组NT-proBNP水平明显高于低危组和健康组,差异有统计学意义(P<0.05)。见表2、3。
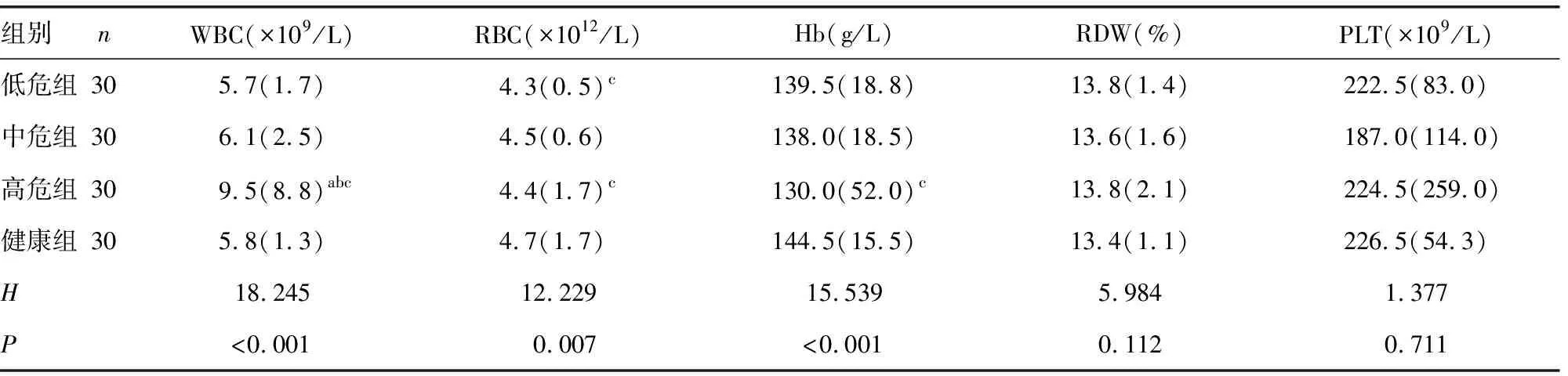
表2 各组血常规及其他临床常用指标比较[M(QR)]
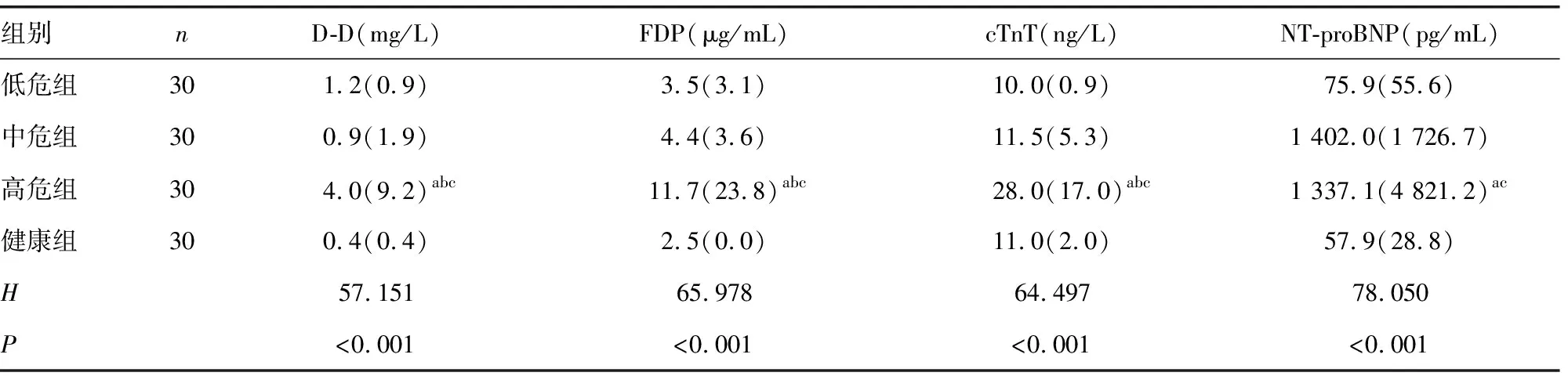
表3 各组D-D、FDP、cTnT、NT-proBNP水平比较[M(QR)]
2.3各组血浆游离mtDNA水平比较 实时荧光定量PCR结果显示,高危组、中危组、低危组、健康组的血浆游离mtDNA水平分别为10 097 (6 889)、2 983(3 327)、813(529)、272(199) copies/mL。血浆游离mtDNA水平在高危组、中危组、低危组和健康组依次降低,两两比较,差异有统计学意义(P<0.001)。
2.4APE患者血浆游离mtDNA水平与其他临床常用指标之间的相关性 双变量Spearman秩相关分析结果显示,APE患者入院第1天血浆游离mtDNA水平与WBC、D-D、FDP、cTnT、NT-proBNP呈正相关(r=0.304、P=0.004;r=0.446、P<0.001;r=0.532、P<0.001;r=0.673、P<0.001;r=0.666、P<0.001),与RBC、Hb、RDW、PLT无相关性(r=—0.037、P=0.733;r=—0.181、P=0.087;r=0.087、P=0.412;r=—0.084、P=0.429)。
2.5血浆游离mtDNA水平及其他临床常用指标对APE的诊断效能 血浆游离mtDNA诊断APE的曲线下面积(AUC)为0.955,cut-off值为557 copies/mL,其灵敏度为91%,特异度为90%。见表4。
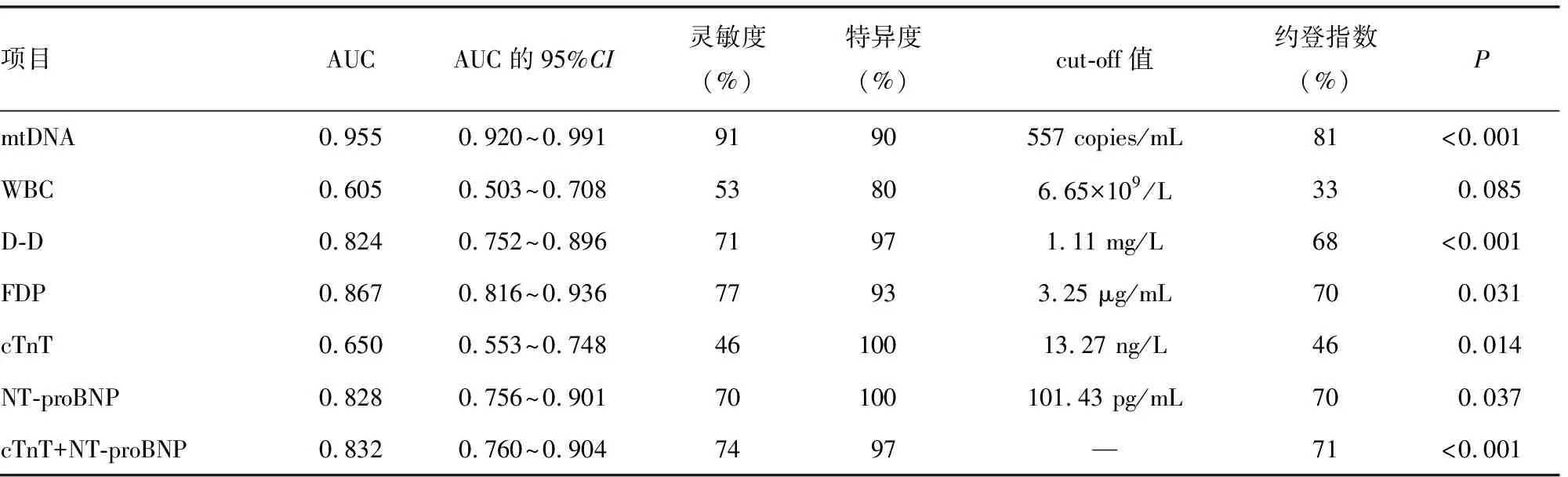
表4 不同生物学指标对APE的诊断效能
3 讨 论
纵向研究显示,APE的发病率逐年升高,可能成为威胁人类健康的重要疾病之一[5-6]。APE患者的病情严重程度各不相同,表现为从轻微症状到右心功能障碍甚至心源性休克。已有研究表明,不同危险分层的患者预后截然不同,高危组患者病死率较高,预后差,因此早期识别死亡风险较高的亚组有助于根据疾病的严重程度尽早给予抗凝和溶栓等精准的治疗和重症护理支持,从而降低病死率[7-8]。肺栓塞的发病机制涉及多个环节,大多数学者认为内皮损伤和炎症在肺栓塞的发生、发展过程中起着重要作用。目前研究发现,APE患者的肺组织内易出现氧化应激、氧自由基的增加和缺血再灌注损伤[9]。mtDNA是位于线粒体基质中的一个小基因组,对氧化磷酸化(OXPHOS)极为重要。mtDNA在线粒体基因中的个数被称为mtDNA的拷贝数。人体大多数细胞包含103~104copies mtDNA并保持相对稳定,这对于维持体内平衡非常重要[10]。研究认为循环mtDNA水平是严重创伤后全身炎症反应和肺损伤的潜在生物标志物[11-12]。迄今为止,mtDNA已用于肿瘤[13]、心脑血管疾病[14]、炎症[15]、烧伤[16]等多种危重疾病的研究[17],但mtDNA在APE发病过程中的作用在我国目前研究较少,深入研究mtDNA在APE发生和发展过程中的水平变化及具体作用,不仅可以为寻求新的治疗靶点奠定基础,而且有望成为一种新的生物学标志物用于APE的诊断。
本研究对所有受试者肘静脉血采用实时荧光定量PCR进行检测,结果显示,APE患者血浆游离mtDNA水平与疾病危险分层关系密切,随着疾病危险分层进展血浆游离mtDNA水平逐渐升高。血浆游离mtDNA水平在高危组、中危组、低危组和健康组依次降低,两两比较差异有统计学意义(P<0.001)。ARNALICH等[18]在一项前瞻性队列研究中发现,高危组APE患者mtDNA和核DNA(nDNA)水平明显高于非高危组APE患者,并且mtDNA是APE患者死亡的独立预测因子。线粒体作为OXPHOS反应中心,可产生大量的氧自由基,并通过细胞凋亡的内在途径导致细胞死亡。由于mtDNA缺乏组蛋白的保护,修复能力有限,因此mtDNA判断氧化损伤的敏感性约为nDNA的50倍[19]。已有研究表明,APE发生时,由于肺动脉发生栓塞,其支配的肺组织由于血流中断或血流受阻而发生坏死及肺梗死,从而引起大面积的组织缺氧,进而降低线粒体氧的可用性,不仅导致患者SaO2下降,且导致ATP快速耗尽[20]。此时全身再灌注损伤可能引发类似严重败血症的全身炎症反应,导致线粒体的双层膜受损,mtDNA从受损的细胞中释放,从而检测到APE患者血浆游离mtDNA水平增加。
FDP是纤维蛋白(原)降解碎片的总称,其中D-D是最常见、最简单的纤维蛋白降解产物,其水平升高表明机体处于血液高凝状态和继发性纤溶系统亢进,在评价血栓性疾病方面具有重要价值[21]。国外研究发现,高危组APE患者血栓负荷程度与D-D水平呈正相关,血栓负荷越重,D-D水平越高[22]。GEISSENBERGER等[23]研究发现,APE患者血浆D-D水平越高,越容易发生低血压、休克、心肌肌钙蛋白升高、心功能受损等表现,故认为D-D水平可能与APE的严重程度有关。血浆cTnT和NT-proBNP水平升高与右心室功能障碍相关,已有研究证明上述两项指标对APE患者的危险分层及预后具有重要的价值[24]。在一项大型回顾性队列研究中发现,APE患者入院时WBC水平与30 d内病死率有关,当APE患者入院WBC>9.8×109/L时,APE患者30 d内病死率最高,因此WBC升高,APE患者预后较差[25];LIU等[26]研究发现WBC水平是中危APE患者住院期间不良结局的独立危险因素。本研究发现,高危组血浆中cTnT、NT-proBNP、D-D、FDP、WBC水平明显高于低危组和健康组,但在诊断APE时,mtDNA的灵敏度高于cTnT、NT-proBNP、D-D、FDP、WBC、cTnT+NT-proBNP。同时本研究还发现APE患者血浆游离mtDNA水平与WBC、D-D、FDP、cTnT、NT-proBNP呈正相关(r=0.304、0.446、0.532、0.673、0.666,P<0.05),这一结果表明血浆游离mtDNA水平同WBC、D-D、FDP、cTnT、NT-proBNP一样与APE疾病密切相关。采用ROC曲线评估mtDNA和临床常用指标对APE的诊断价值,结果显示血浆游离mtDNA诊断APE的AUC为0.955,cut-off值为557 copies/mL,其灵敏度为91%,特异度为90%;在APE诊断方面,血浆mtDNA显示出比其他临床常用指标更好的辨别力。因此,mtDNA在诊断APE时,具有较高的灵敏度与特异度,可以成为APE诊断的一种新型生物标志物。
当然,本研究仍存在不足之处。本研究为单中心研究,样本量较少,可能存在偏倚等误差,需要在今后的实验中进行多中心、大样本量研究;血浆mtDNA的过度积累部分原因可能归因于清除能力降低,但目前其清除机制尚不清楚,还需要进一步的研究来了解肾功能和肝功能受损患者血浆游离mtDNA降低的机制。随着分子生物学的不断发展,新型冠状病毒感染疫情加速了基层PCR实验室的建成,经过对PCR技术人员的大量培训,PCR技术更加成熟。因此,有望将mtDNA作为一项常规生物学指标,对疾病做出精准的评估。
综上所述,APE患者血浆游离mtDNA水平升高,并与疾病危险分层严重程度有关;血浆游离mtDNA水平检测有助于诊断APE,mtDNA也可作为预测APE病情严重程度的一种标志物。
