HR-HPV阳性宫颈癌患者免疫细胞与炎症因子特征分析
2023-08-25张潇潇马苗苗石义祥
张潇潇,王 俊,马苗苗,石义祥,武 地,李 宁△
1.陕西省西安高新医院检验科,陕西西安 710075;2.陕西省西安市第五医院检验科,陕西西安 710082;3.陕西省商洛市山阳县人民医院检验科,陕西商洛 726400
宫颈癌发生率在我国女性恶性肿瘤中居第6位,每年约有3.4万例患者因宫颈癌死亡,且近年来宫颈癌发病年龄有年轻化趋势[1]。宫颈癌是极少数病因可以明确的恶性肿瘤,其中高危型人乳头瘤病毒(HR-HPV)持续感染能够促使宫颈上皮微环境的重塑,影响癌基因表达,使阴道菌群失衡,导致宫颈上皮细胞的恶性转化,是宫颈上皮内瘤变(CIN)发展为宫颈癌的重要风险因素[2]。T细胞亚群与恶性肿瘤的发生明显相关,根据T细胞功能,可将其分为辅助性T细胞(Th)、调节性T细胞(Treg)等类型。目前认为,宫颈癌患者往往存在T细胞组成方面的变化及功能失调,包括Th1/Th2、Th17/Treg的变化,且与患者病情进展具有一定的关系[3]。本研究拟通过分析HR-HPV阳性宫颈癌患者的免疫细胞和炎症因子特征,了解HR-HPV在宫颈癌中的作用机制,以期为宫颈癌患者的细胞免疫治疗提供依据。
1 资料与方法
1.1一般资料 选取2018年10月至2021年10月陕西省西安市高新医院(以下简称本院)收治的宫颈癌患者196例作为宫颈癌组,年龄37~65岁,平均(49.36±7.12)岁;鳞癌154例(鳞癌组),腺癌42例(腺癌组);国际妇产科联盟(FIGO)分期中,Ⅰ期25例,Ⅱ期67例,Ⅲ期92例,Ⅳ期12例。选择同期收治的CIN患者40例作为CIN组,年龄35~64岁,平均(48.95±6.98)岁;CINⅡ级24例,CINⅢ级16例。另选取同期慢性宫颈炎患者40例作为对照组,年龄34~62岁,平均(48.85±8.10)岁。3组年龄比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:均经病理检查首次确诊[4];病历资料完整;无放化疗史。排除标准:近期有激素或免疫治疗史;合并高血压、感染性疾病、糖尿病、心血管疾病等疾病;合并免疫功能异常;合并其他良恶性肿瘤;处于妊娠期或哺乳期。所有研究对象均自愿参与本研究,并签署知情同意书,本研究通过本院医学伦理委员会批准。
1.2方法 (1)采集所有研究对象入院后空腹静脉血5 mL,使用美国贝克曼CytoFLEX流式细胞仪检测免疫细胞Treg、Th17、Th17/Treg、Th1、Th2及Th1/Th2水平。使用酶联免疫吸附试验(ELISA)检测白细胞介素(IL)-17、转化生长因子-β(TGF-β)、干扰素-γ(IFN-γ)、IL-4水平。试剂盒均由深圳市达科为生物工程有限公司提供。(2)宫颈癌组患者入院后均进行HR-HPV检测,患者取膀胱截石位,暴露宫颈口后,采用HPV专用毛刷置于患者宫颈管,顺时针旋转5~10圈取宫颈脱落细胞标本,立即送检。HR-HPV检测试剂盒由上海博湖生物科技有限公司提供,所有操作严格按照试剂盒说明书进行。记录宫颈癌患者HR-HPV阳性率。
1.3观察指标 (1)比较3组研究对象的免疫细胞、炎症因子水平。(2)根据组织学类型的不同,将宫颈癌组患者进一步分为鳞癌组和腺癌组,比较鳞癌组和腺癌组的免疫细胞、炎症因子水平。(3)根据宫颈癌组患者是否合并HR-HPV感染,分为阳性组(167例)和阴性组(29例),比较阳性组和阴性组患者的免疫细胞、炎症因子水平。
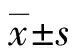
2 结 果
2.13组免疫细胞水平比较 宫颈癌组Treg、Th17、Th17/Treg、Th1、Th2水平明显高于CIN组和对照组,Th1/Th2水平明显低于CIN组和对照组,差异均有统计学意义(P<0.05)。CIN组Treg、Th17、Th17/Treg、Th1、Th2水平明显高于对照组,Th1/Th2水平明显低于对照组,差异均有统计学意义(P<0.05)。见表1。
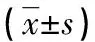
表1 3组免疫细胞水平比较
2.23组炎症因子水平比较 宫颈癌组IL-17、TGF-β、IFN-γ、IL-4水平明显高于CIN组和对照组,差异均有统计学意义(P<0.05)。CIN组IL-17、TGF-β、IFN-γ、IL-4水平明显高于对照组,差异有统计学意义(P<0.05)。见表2。
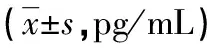
表2 3组炎症因子水平比较
2.3鳞癌组与腺癌组免疫细胞水平比较 鳞癌组与腺癌组Treg、Th17、Th17/Treg、Th1、Th2及Th1/Th2水平比较,差异均无统计学意义(P>0.05)。见表3。
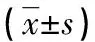
表3 鳞癌组与腺癌组免疫细胞水平比较
2.4鳞癌组与腺癌组炎症因子水平比较 鳞癌组与腺癌组IL-17、TGF-β、IFN-γ及IL-4水平比较,差异均无统计学意义(P>0.05)。见表4。
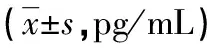
表4 鳞癌组与腺癌组炎症因子水平比较
2.5阳性组与阴性组免疫细胞水平比较 阳性组Treg、Th17、Th17/Treg、Th2水平明显高于阴性组,Th1/Th2水平明显低于阴性组,差异均有统计学意义(P<0.05)。两组Th1水平比较,差异无统计学意义(P>0.05)。见表5。
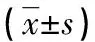
表5 阳性组与阴性组免疫细胞水平比较
2.6阳性组与阴性组炎症因子水平比较 阳性组IL-17、TGF-β、IL-4水平明显高于阴性组,差异有统计学意义(P<0.05)。两组IFN-γ水平比较,差异无统计学意义(P>0.05)。见表6。
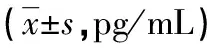
表6 阳性组与阴性组炎症因子水平比较
2.7HR-HPV感染与免疫细胞、炎症因子水平的相关性 宫颈癌患者HR-HPV感染与Treg、Th17、Th17/Treg、Th2、IL-17、TGF-β、IL-4水平呈正相关(r=0.400、0.322、0.312、0.361、0.337、0.351、0.322,P<0.05),与Th1/Th2水平呈负相关(r=-0.365,P<0.05),与Th1、IFN-γ水平无相关性(r=-0.045、-0.038,P=0.176)。
3 讨 论
全球宫颈癌发生率约为13.1/100 000,是导致女性死亡的主要恶性肿瘤,目前研究认为,CIN可阶段性进展为宫颈癌,这一过程持续可达20年[5]。其中HR-HPV属于双链环形DNA病毒,以游离型等多种方式存在于机体细胞中,主要包括HPV16、18型等类型,HR-HPV阳性是CIN进展为宫颈癌的主要风险因素[6]。研究发现,宫颈组织感染HR-HPV后,HR-HPV能够通过将E6等致癌基因整合至宿主DNA,增加E6等癌蛋白的表达,并通过与抑癌基因p53、p16等相互作用,促使抑癌基因活性减低,癌细胞的侵袭能力增强,最终导致癌性病变的发生[2];HR-HPV可造成宫颈组织的持续性感染,使炎症因子表达受到影响,促使免疫逃逸等发生,进而导致患者病情的进展[7]。但是目前关于HR-HPV对宫颈癌患者免疫功能的影响机制尚存在一定争议,通过分析HR-HPV阳性宫颈癌患者免疫细胞和炎症因子特征,可为宫颈癌患者的早期治疗提供参考。
Th17可介导IL-17等炎症因子的分泌,加强机体炎症反应,促使肿瘤新生血管的生成,加快患者病情的进展[8]。有研究发现,Th17与宫颈癌患者临床分期、淋巴结转移均有一定的相关性[9]。Treg可介导TGF-β等的表达,在机体免疫耐受调控中起到重要作用,有助于免疫逃逸[10]。目前认为,下调宫颈癌患者Treg的表达,有助于患者病情的改善[11]。Th17和Treg相互制约、相互调节,阻碍机体过度免疫反应的发生,其中Th17/Treg上升提示机体处于免疫失衡状态[12]。本研究发现,Th17、Treg、Th17/Treg、IL-17、TGF-β水平在宫颈癌组、CIN组及对照组中逐渐下降,不同组织学类型宫颈癌患者的免疫细胞和炎症因子水平比较,差异无统计学意义(P>0.05),而HR-HPV阳性宫颈癌患者Treg、Th17、Th17/Treg、IL-17、TGF-β水平均明显高于HR-HPV阴性患者,且宫颈癌患者HR-HPV感染与Treg、Th17、Th17/Treg、IL-17、TGF-β水平呈正相关(P<0.05)。提示随着宫颈病变患者病情的进展,机体炎症反应增强,Th17/Treg失衡逐渐加重,而HR-HPV阳性可加剧Th17/Treg失衡,进而可增强肿瘤细胞的侵袭能力,促使免疫逃逸的发生。这可能是由于HR-HPV可通过促使Rb等宿主基因活性的丧失,阻碍p16与细胞周期蛋白依赖性激酶4/6的相互作用,进而使p16过表达,机体免疫应答下调,促使Th17/Treg等的变化[13-14]。
Th1主要介导IFN-γ等炎症因子的表达,能够增强巨噬细胞活性,提高一氧化氮水平,增强机体免疫应答,促进细胞毒性T细胞的增殖,进而提高对肿瘤细胞的杀伤作用[15]。Th2可通过介导IL-4等炎症因子的表达,抑制Th1生成,降低自然杀伤细胞活性,阻碍机体免疫活性[16]。有研究发现,机体处于CIN时,即可发生明显的Th1/Th2失衡[17]。本研究发现,Th2、IFN-γ、IL-4水平在宫颈癌组、CIN组和对照组逐渐下降,Th1/Th2逐渐上升,提示随着宫颈病变的进展,机体Th1/Th2免疫功能紊乱加重。本研究发现,阳性组和阴性组Th1、IFN-γ水平比较,差异无统计学意义(P>0.05),但是阳性组Th2、IL-4水平明显高于阴性组,Th1/Th2明显低于阴性组,且宫颈癌患者HR-HPV感染与Th2、IL-4水平呈正相关(P<0.05),与Th1/Th2呈负相关(P<0.05)。这可能是由于在肿瘤微环境中,HR-HPV感染可经由52L1等短肽通路促使T淋巴细胞功能受损,创造支持性感染后微环境,影响宫颈免疫状态,干扰机体的免疫应答,促使细胞免疫缺陷的发生,导致机体免疫抑制加重,使宫颈癌患者的免疫功能向Th2偏移,Th2水平上升[18-19]。
综上所述,宫颈癌患者存在一定的Th17/Treg、Th1/Th2紊乱,其中HR-HPV阳性可进一步促使患者Th17/Treg、Th1/Th2失衡。提示通过改善HR-HPV阳性宫颈癌患者的免疫微环境,有助于患者的治疗。但是本研究仍存在一定局限,包括未对宫颈癌患者HR-HPV感染类型进行检测,未能明确HR-HPV感染类型对宫颈癌患者免疫功能的影响;本研究为单中心研究,未来仍需大样本、多中心分析以明确结论。
