初级纤毛在口腔黏膜创伤愈合中的作用研究
2023-08-23王欣宇
王欣宇,孙 瑶
口腔黏膜是口腔的主要保护屏障,具有较好的创伤愈合能力。然而由于口腔的菌群和环境的多样性,口腔黏膜创伤存在难以愈合或需要很长时间才能愈合的风险。外伤、不良修复体、感染等多种因素刺激会导致口腔黏膜创伤经久不愈[1],进而引发多种严重的口腔黏膜病变。加快黏膜创伤愈合正在成为口腔医学领域关注的重要问题[2]。口腔黏膜创伤愈合包括以下几个阶段:止血期、炎症期、增殖期和组织重塑期[3]。这些阶段涉及炎症、再上皮化、血管生成、细胞外基质沉积和重塑[4]。当口腔黏膜创伤后,会触发创伤愈合反应以快速修复上皮并恢复表皮屏障,这一过程主要取决于角质形成细胞的迁移[5-6]。而再上皮化过程的延迟会导致更高的感染发生率和慢性创伤形成[7]。因此,角质形成细胞的迁移、增殖和分化对于口腔黏膜创伤愈合至关重要。在许多类型的组织器官中,愈合能力会随着年龄的增长而下降[8-9]。例如,在皮肤创伤愈合的过程中,衰老会导致炎症期的延长,导致邻近细胞的进一步破坏,影响创伤愈合[10]。同样在口腔黏膜中,衰老也会导致创伤愈合修复能力下降,当老年人出现不良修复体或外伤导致的口腔黏膜创伤后,通常需要更长的时间愈合[11]。虽然创伤愈合减慢通常被认为是慢性病的结果,但并不能将年龄视为创伤愈合障碍的独立危险因素,衰老会影响创伤愈合过程的所有阶段。因此探究口腔黏膜的增龄性变化及调控其创伤愈合的关键机制具有重要意义。初级纤毛是一种广泛分布于真核细胞表面的重要感受器,调控细胞感知并传递多种外界信号[12]。初级纤毛结构和功能决定多种重要的细胞行为,包括增殖、分化和迁移[13],从而调控器官发育、组织稳态和修复[14-15]。并且初级纤毛还作为信号枢纽介导多个重要信号通路的传递,例如TGF-β信号通路、Wnt信号通路、Notch信号通路等,这些信号通路在创伤愈合过程中发挥重要作用[16-17]。已有研究证实,角质形成细胞的初级纤毛与其增殖和分化有关,它们之间的平衡调控着上皮稳态[18]。这表明初级纤毛会极大地影响角质形成细胞的命运,从而影响上皮结构的维持[19]。本研究将聚焦老年群体中存在的创伤愈合延迟问题,探究初级纤毛随年龄增长发生的变化及其在口腔黏膜创伤愈合过程中的作用,以期为寻找促进口腔黏膜创伤愈合的方法提供新的视角。
1 材料与方法
1.1 实验动物
本研究中使用的小鼠为C57BL/6J小鼠。Ift140f/f小鼠基于C57BL/6J小鼠的胚胎干细胞中的靶向载体构建(上海南方模式生物科技发展有限公司)。用于基因分型鉴定的引物包括,F-primer, 5′-ATCTTAATTTGTGTTGAAGGGGTT-3′;R-primer,5′-CTGCCAGGGGTACATGGTAGTAAG-3′。内源性Ift140的产物大小为319 bp,Ift140f/f的产物大小为375 bp。K14-Cre小鼠购自杰克森实验室。为了获得角质形成细胞中Ift140基因条件性敲除小鼠,将K14-Cre小鼠与Ift140f/f杂交,获得Ift140f/f;K14-Cre(Ift140-cKO)小鼠,采用同窝同性别Ift140f/f小鼠(CONTROL)作为对照。实验动物在一个特定的无病原体(SPF)设施中,在12/12 h的日/夜照明周期下饲养。所有实验程序和方案都得到了同济大学伦理委员会的批准([2022]-DW-06)。
1.2 主要仪器与试剂
石蜡切片机(Thermo Fisher Microm公司,美国);HE 染色试剂盒(上海威奥生物科技有限公司,中国);MASSON三色染色试剂盒(北京索莱宝科技有限公司,中国);细胞衰老β-半乳糖苷酶染色试剂盒、EdU试剂及细胞增殖检测试剂盒(碧云天公司,中国);以下一抗与AlexaFluor二抗(Invitrogen公司,美国)一起用于免疫荧光:角蛋白14(K14)抗体(Thermo Fisher Scientific公司,美国)、ARL13B抗体(Proteintech公司,中国);正置荧光显微镜、激光扫描共聚焦显微镜(Nikon公司,日本)。
1.3 实验方法
1.3.1 口腔黏膜创伤小鼠模型的构建 选取3组8周龄的Ift140-cKO小鼠和同窝对照小鼠及3组1周龄、8周龄及12月龄的野生型(wild-type,WT)小鼠,禁食12 h,吸入麻醉后使用0.12%氯己定和一次性棉球对口腔进行消毒。使用涡轮手机在小鼠口腔颊侧黏膜上留下直径为3 mm的创伤。手术后,将动物置于发热毯上避免体温过低。
1.3.2 组织学染色 4%多聚甲醛进行灌流固定,取建模处的口腔黏膜,梯度乙醇脱水,石蜡包埋,然后进行切片。切取4 μm厚的切片并黏附在载玻片上,切片水化后采用标准程序进行苏木精和伊红(HE)染色、MASSON三色染色。对衰老细胞染色,将固定后的组织用梯度蔗糖脱水,OCT包埋剂(SAKURA,美国)包埋,以10 μm的厚度进行冰冻切片,使用细胞衰老β-半乳糖苷酶染色试剂盒进行染色。
1.3.3 细胞增殖染色 在收样前3 h对小鼠腹腔注射EdU试剂(20 μg/g体重)标记增殖细胞。组织切片经二甲苯及梯度乙醇脱蜡水化后,使用EdU细胞增殖检测试剂盒对标记的EdU进行显色检测。
1.3.4 免疫荧光染色 切取8 μm厚的石蜡切片进行免疫荧光染色。将切片用0.1%Triton X100(Sigma,美国)透化10 min,在柠檬酸钠抗原修复液中进行热修复,恢复室温后使用PBS洗涤3次,每次5 min。在37 ℃条件下用5%山羊血清封闭样品1 h,加入一抗(ARL13B、K14)在4 ℃下孵育过夜。加入相应的荧光二抗在室温下孵育1 h。使用DAPI来对细胞核进行染色。
1.4 统计学分析
所有数据均由GraphPad Prism 8.0进行分析。两组之间的比较通过 Student′st检验进行,P<0.05被认为具有统计学意义。
2 结 果
2.1 小鼠口腔黏膜的增龄性变化
为探究口腔黏膜的增龄性变化,首先观察了1周、8周和12个月龄WT小鼠口腔黏膜的组织学结构和增殖能力。小鼠的颊侧口腔黏膜主要分为上皮层、固有层和以脂肪、血管为主的黏膜下层。在幼年(1周龄)的小鼠中,上皮厚度较薄。随着年龄的增长逐渐变厚直至发育成熟(8周龄)。尽管有文献指出,在小鼠皮肤表皮中,老年小鼠表皮厚度会减少约20%,并伴随着同等的真皮变薄,维持相同比例的皮肤结构[20],但小鼠口腔黏膜中,进入成年阶段(8周龄)后,其上皮厚度并不再会随着衰老而变薄(图1A)。不同年龄阶段的小鼠具有相似的形态学特征,并没有明显的结构差异,但在幼年小鼠中,其黏膜下层的结缔组织更为疏松(图1B)。小鼠颊侧口腔黏膜上皮层又分为表层、中间层和基底层。在正常的状态下,为了维持上皮组织的稳定与屏障功能,位于基底层的角质形成细胞不断增殖,呈周期性地离开基底层向上进入中间层并终止分化,最终从表层脱落[21]。为此,我们采用角蛋白14(K14)标记基底层角质形成细胞,划分上皮层与固有层的界限。K14免疫荧光染色结果显示,老年小鼠口腔黏膜角质形成细胞的排列与结构并没有发生明显变化(图1C)。我们对幼年(1周龄)、成年(8周龄)及老年(12月龄)的小鼠进行了衰老细胞β-半乳糖苷酶染色(图1D),其中蓝色染色标记了不再具有分裂能力的细胞(黑色箭头)。随着年龄的增长,上皮中失去分裂能力的细胞主要集中于基底层,并且在老年小鼠口腔黏膜中,衰老的细胞难以周期性地离开基底层,导致其在基底层堆积。
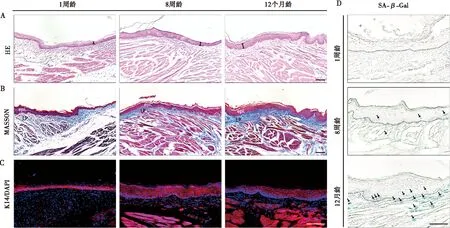
A:1周、8周和12个月龄小鼠的口腔黏膜HE染色。黑色箭头代表上皮厚度;B:1周、8周和12个月龄小鼠口腔黏膜的MASSON三色染色;Epi:上皮层;LP:固有层;C:角蛋白14(K14)抗体标记的各年龄阶段小鼠口腔黏膜上皮的免疫荧光图像;红色标记K14蛋白,蓝色标记细胞核;D:使用衰老细胞β-半乳糖苷酶(SA-β-Gal)染色标记的各年龄阶段小鼠口腔黏膜切片图像;黑色箭头表示衰老细胞,虚线表示上皮与固有层的界限;比例尺=100 μm图1 野生型小鼠的口腔黏膜增龄性变化Fig.1 Ageing changes in the oral mucosa of wild-type mice
2.2 老年小鼠口腔黏膜创伤愈合减慢
为进一步探究增龄性变化对口腔黏膜创伤愈合能力的影响,在年轻(8周龄)与老年(12月龄)小鼠颊侧口腔黏膜上构建了全层厚度的创伤。结果表明,年轻小鼠的口腔黏膜创伤通常会在3 d内闭合,完成再上皮化,并在5 d内完成组织重塑,具有较好的自我愈合能力。老年小鼠口腔黏膜在创伤后5 d仍未实现闭合(图2A)。在创伤愈合过程中,黏膜上皮层增殖并向伤口床迁移,以闭合伤口床,减少外界刺激,而固有层中以胶原组织与成肌纤维组织生成为主。通过MASSON染色,我们可以观察到老年小鼠的组织重塑能力下降(图2B)。为观察口腔黏膜再上皮化的过程,对创伤后1、3、5 d的口腔黏膜进行了K14免疫荧光染色(图2C)。在创伤后1 d,老年小鼠创伤未出现再上皮化,迁移的角质形成细胞在创伤后3 d形成向伤口床延伸的上皮舌,直到第5天,老年小鼠的创伤上皮仍未闭合。因此,我们检测了年轻与老年小鼠口腔黏膜各层细胞在创伤后增殖能力变化。通过注射EdU,可以观察到上皮层与固有层中细胞的增殖水平(图2D)。其中,上皮层的增殖细胞主要集中于邻近基底膜的基底层,年轻创口在创伤后第3天上皮层的增殖达到峰值。其后上皮的迁移完成,上皮层增殖减弱,细胞增殖主要集中于固有层。而对于老年小鼠的创伤愈合, 同一时间段内细胞增殖数量明显减少,尤其是上皮层细胞。上述结果表明,老年小鼠口腔黏膜创伤愈合速度下降,难以快速愈合。

A:年轻(young,8周龄)与老年(aged,12月龄)小鼠口腔黏膜创伤建模第1、3、5天后愈合情况的HE染色,虚线表示创伤区域的边界;B:口腔黏膜创伤愈合情况的MASSON染色,虚线表示创伤区域的边界;C:年轻与老年小鼠口腔黏膜创伤愈合过程的K14免疫荧光染色图像,红色标记K14蛋白,蓝色标记细胞核;D:用于检测创伤愈合过程中细胞增殖情况的EdU染色(绿色),右侧图片为虚线框内的放大图,i区域为上皮层的细胞,ii区域为固有层的细胞,虚线表示上皮层与固有层的界限,箭头表示未愈合的创口边缘;比例尺=100 μm图2 年轻小鼠与老年小鼠的创伤愈合情况Fig.2 Wound healing in young and aged mice
2.3 口腔黏膜上皮层初级纤毛的增龄性变化
基于上述结果,进一步观察在未构建创伤的正常条件下,相同时间内,不同年龄阶段小鼠的口腔黏膜的细胞增殖情况,用EdU标记增殖细胞(图3A)。结果表明,在正常条件下,口腔黏膜上皮的增殖主要集中于靠近基底膜的基底层角质形成细胞中,且随着年龄增长,小鼠口腔黏膜的自然增殖与更新能力下降,这意味着口腔黏膜上皮的角质形成细胞维持稳态条件下自我更新的能力降低。而初级纤毛组装和拆卸都取决于并影响细胞周期进程,是维持细胞增殖的重要组件[22],为此观察了初级纤毛在各年龄阶段小鼠口腔黏膜组织中的分布情况。我们发现,在小鼠颊黏膜中,初级纤毛主要定位于上皮基底层,在固有层中分布较稀疏,且定位在上皮基底层的初级纤毛随年龄增长而逐渐减少(图3B、C),这与口腔黏膜中的角质形成细胞的作用的增龄性变化同步。
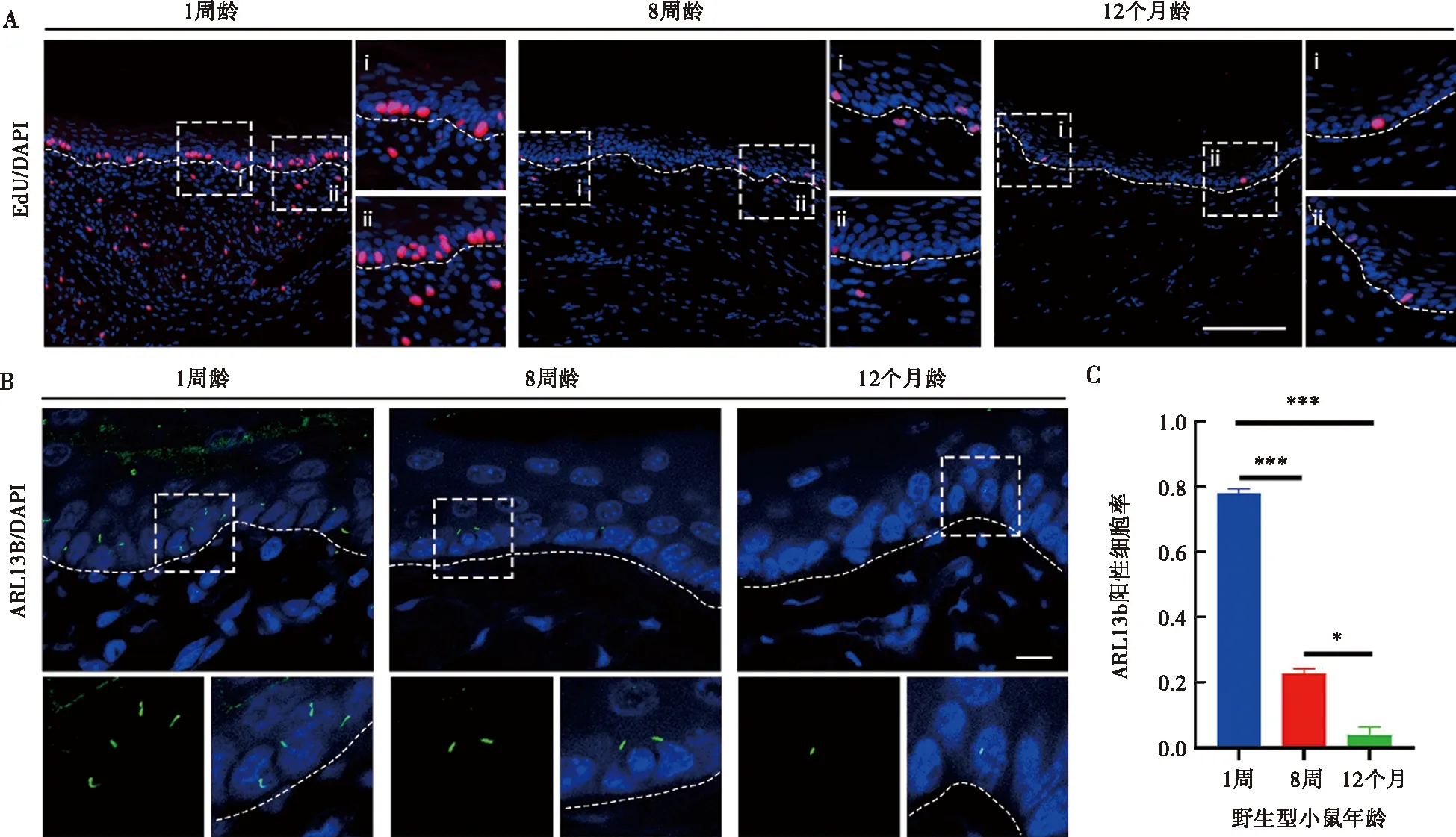
A:1周、8周和12月龄小鼠口腔黏膜EdU(红色)标记的增殖细胞免疫荧光图像,虚线表示上皮层与固有层的界限,右侧图片为虚线框内的放大图;B:1周、8周和12月龄小鼠黏膜上皮层初级纤毛出现情况,绿色标记ARL13B,蓝色标记细胞核,虚线表示上皮层与固有层的界限,下侧图片为虚线框内的放大图;C:各年龄阶段口腔黏膜上皮基底层初级纤毛出现率的变化,*:P<0.05,***:P<0.001;比例尺=100 μm图3 小鼠口腔黏膜上皮层初级纤毛的增龄性变化Fig.3 Age-related changes in primary cilia in the epithelial layer of the mouse oral mucosa
2.4 角质形成细胞条件性敲除Ift140影响基底层细胞的增殖
为了进一步探究初级纤毛的增龄性变化在口腔黏膜中的作用,我们构建了Ift140f/f;K14-Cre小鼠,在口腔黏膜上皮层K14阳性角质形成细胞中敲除纤毛内转运系统(intraflagellar transport,IFT)的核心组成分子Ift140,以干预初级纤毛的形成(图4A、B)。对照组与敲除组口腔黏膜中的纤毛标记分子ARL13B免疫荧光染色证实,Ift140缺失导致上皮基底层角质形成细胞初级纤毛结构缺失,出现率下降(图4C)。通过观察对照组与敲除组小鼠的口腔黏膜,我们发现,成年(8周龄)敲除组小鼠口腔黏膜的形态与同龄对照组小鼠相似(图4D-a,b),说明在K14阳性角质形成细胞中条件性敲除Ift140不会影响口腔黏膜本身的发育与结构。但在口腔黏膜角质形成细胞的初级纤毛结构被干预后,其细胞增殖明显减少(图4D-c),将导致口腔黏膜稳态维持的自我更新速度减慢。
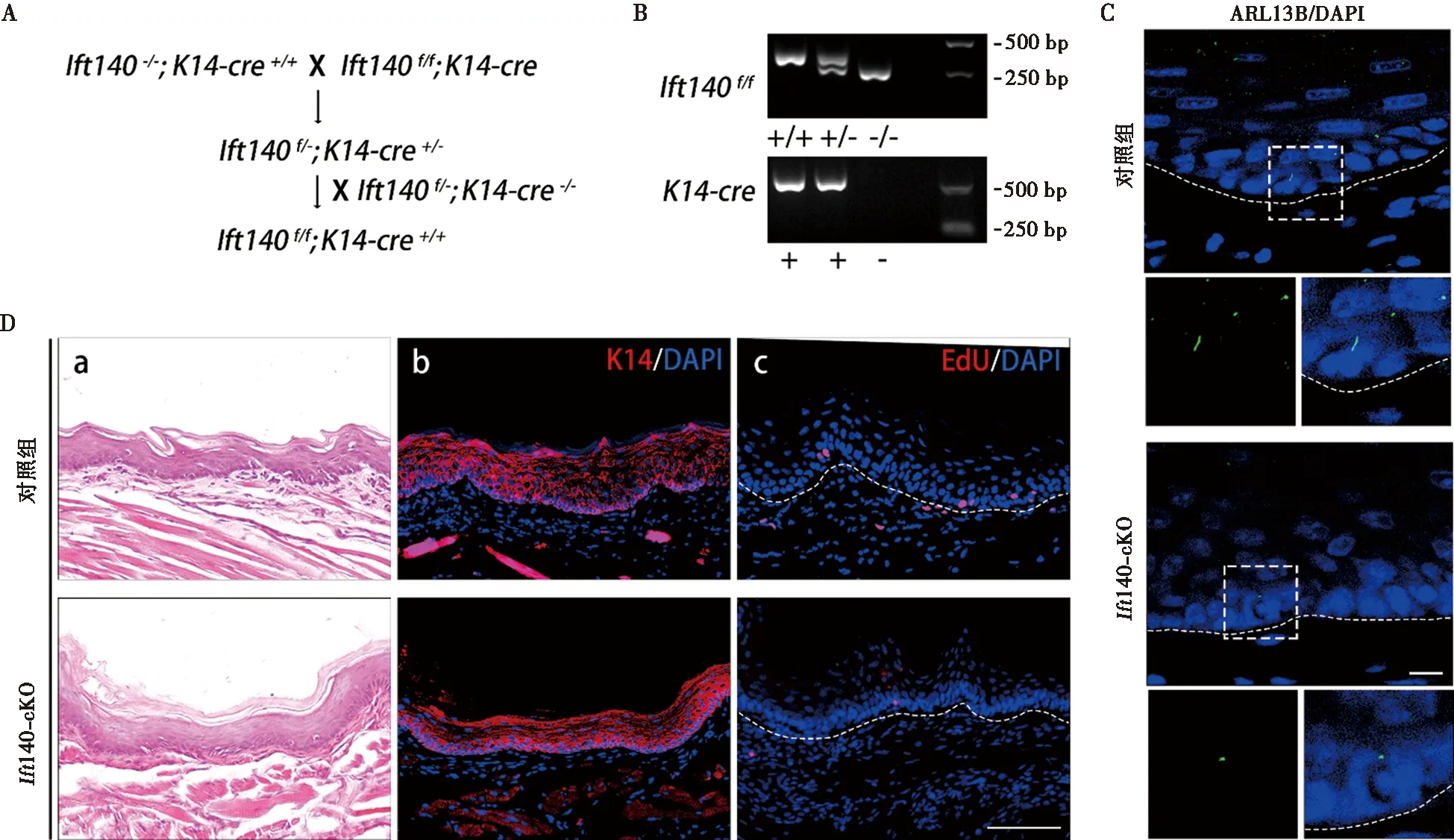
A:Ift140f/f; K14-Cre(Ift140-cKO)小鼠的构建图;B:两种引物的电泳结果。使用来自Ift140纯合突变体、Ift140杂合突变体和对照组小鼠的基因组DNA,通过PCR测定基因型,只有同时含有K14-Cre阳性条带和Ift140f/f条带的样品才被视为来自Ift140-cKO小鼠;C:敲除组与对照组的ARL13B免疫荧光染色情况(绿色),虚线表示上皮层与固有层的界限,下侧图片为虚线框内的放大图;D:敲除组与对照组小鼠口腔黏膜的组织学染色与细胞增殖情况,a:HE染色图像;b:荧光染色图像,红色标记K14,蓝色标记细胞核;c:细胞增殖情况,增殖细胞由EdU标记(红色),虚线表示上皮层与固有层的界限;比例尺=100 μm图4 角质形成细胞条件性敲除Ift140小鼠的口腔黏膜上皮变化Fig.4 Oral mucosal epithelial changes in keratinocyte-specific knockout Ift140 mice
2.5 角质形成细胞特异性敲除纤毛基因Ift140小鼠口腔黏膜创伤愈合速度减慢
为了观察角质形成细胞条件性敲除Ift140干预初级纤毛结构后对口腔黏膜创伤愈合的影响,我们在8周龄的敲除组与对照组小鼠颊侧口腔黏膜中构建了创伤模型。与对照组相比,敲除组的愈合过程明显减慢(图5A)。在MASSON染色中发现,对照组小鼠在3 d完成了再上皮化并实现较好的组织重塑,而敲除组小鼠的伤口床则在第5天时才闭合,且上皮下的固有层及黏膜下层的组织基本未能有效沉积重建(图5B)。当我们观察创伤愈合过程中的K14免疫荧光染色,可以看到在创伤第3天,与已完成上皮迁移的对照组相比, 敲除组仅有部分上皮延伸至伤口床,直至第5天才完成上皮迁移(图5C)。创伤愈合过程中的EdU染色结果告诉我们,在对照组中,细胞增殖主要从上皮层开始,而随着再上皮化的完成,从创伤第3天开始,上皮下固有层中的细胞增殖占据更大的比例,这代表着创伤修复进入组织重塑期;而条件性敲除Ift140后,上皮层角质形成细胞的增殖较少,使得再上皮化速度更慢,组织愈合受到较大的影响(图5D)。上述结果表明,在口腔黏膜上皮角质形成细胞中条件性干预初级纤毛结构,降低初级纤毛出现率,将大大影响口腔黏膜创伤愈合,导致敲除组小鼠上皮层细胞增殖减弱,愈合延迟,这与老年小鼠口腔黏膜创伤愈合减缓的结果相似。

A:敲除组与对照组口腔黏膜创伤建模第1、3、5天后愈合情况的HE染色,虚线表示创伤区域的边界;B:口腔黏膜创伤愈合情况的MASSON染色,虚线表示创伤区域的边界;C:敲除组与对照组口腔黏膜创伤愈合过程中再上皮化的情况,红色标记K14,蓝色标记细胞核;D:用于检测创伤愈合过程中细胞增殖情况的EdU染色(绿色),i区域为上皮层的细胞,ii区域为固有层的细胞,虚线表示上皮与固有层的界限,箭头表示未愈合的创口边缘,右侧图片为虚线框内的放大图;比例尺=100 μm图5 条件性敲除Ift140后,口腔黏膜的创伤愈合情况Fig.5 Wound healing of oral mucosa after knockout of Ift140
3 讨 论
随着社会进入老龄化阶段,老年人口逐渐增多,衰老相关的疾病在医学研究中成为越来越受关注的重要问题[23]。与年轻人的创伤相比,老年人的皮肤创伤显示出明显的愈合延迟。愈合延迟会导致慢性炎症、病理性瘢痕,甚至可能发展成癌症[3]。口腔黏膜创伤的愈合延迟会增大感染的风险,引发口腔功能创伤,如吞咽困难、发音障碍和咀嚼困难等。因此,了解老年人创伤愈合延迟的原因和机制并确定合适的治疗方法具有重要意义。
在正常的稳态条件下,本研究首先观察了口腔黏膜结构随年龄增长的变化。我们发现,老年小鼠口腔黏膜上皮层的厚度和固有层的比例与年轻的口腔黏膜差异无统计学意义。这意味着衰老因素并不通过结构变化对口腔黏膜的功能造成影响。在口腔黏膜中,口腔上皮祖细胞被认为主要位于口腔黏膜上皮基底层,增殖活跃促进口腔黏膜上皮快速更新[24]。最近的研究表明,在老年皮肤的表皮中,基底层细胞周转率下降,脂质合成减少,导致脂质双层紊乱,基底层角质形成细胞在大小和形状上会变得更加异质化[25]。本实验发现,老年小鼠口腔黏膜角质形成细胞的增殖能力下降。而角质形成细胞细胞周期的停滞,使得老年小鼠口腔黏膜上皮更新减慢,衰老细胞大量在基底层堆积。角质形成细胞的增殖和迁移也是创伤愈合再上皮化的重要过程,角质形成细胞增殖的减慢会导致促炎症的微环境,延缓再上皮化和创伤愈合[26]。本研究证实,在老年小鼠口腔黏膜创伤愈合的过程中,角质形成细胞增殖速度明显减慢,创伤愈合缓慢,伤口床难以闭合。在愈合过程中,角质形成细胞会转换为迁移模式,迁移到受损的上皮中,以填补其空缺,然后新的角质形成细胞增殖以取代迁移的细胞[27]。角质形成细胞增殖缓慢,会抑制细胞使组织再生向创伤中心发展,导致再上皮化受阻。
在本研究中我们发现,随着年龄的增长,小鼠口腔黏膜上皮基底层中角质形成细胞的重要细胞感受器——初级纤毛出现率显著降低。初级纤毛是感知外界生化和机械信号的细胞感受器。初级纤毛通过纤毛内转运系统介导信号转导参与多种细胞调节过程,包括增殖、分化和迁移[28]。初级纤毛可以调节创伤愈合过程中成纤维细胞迁移所必需的信号通路,并通过TGF-β通路,传递创伤处的细胞因子,促进细胞外基质沉积及组织纤维化[29-30]。IFT140是纤毛转运复合体的核心分子之一,研究表明Ift140的突变或缺失将导致纤毛结构异常或消失[31]。此前有文献报道,由年龄导致的初级纤毛损失并不是纤毛结构完全丧失,而是类似于年轻的成年小鼠缺失部分纤毛蛋白,导致信号传递迟缓。初级纤毛对纤毛蛋白表达水平的变化高度敏感,因此特别容易受到与衰老有关变化的影响[32]。本研究中,通过在基底层角质形成细胞中条件性敲除Ift140来观察纤毛蛋白缺失对小鼠口腔黏膜创伤愈合的影响。首先,在正常的稳态条件下,敲除小鼠的口腔黏膜上皮在生长发育过程中并没有受到明显的影响,结构与对照组小鼠口腔黏膜上皮相同。而在构建创伤模型后,敲除组小鼠的角质形成细胞增殖减弱,愈合明显延迟,且再上皮化速度较慢。这表明初级纤毛结构主要通过影响角质形成细胞增殖进而调控口腔黏膜创伤愈合。我们推测,衰老条件下的初级纤毛的增龄性变化可能通过影响角质形成细胞在创伤环境中的信号传递,导致其对创伤环境的刺激与诱导作用反应延迟,从而影响角质形成细胞的增殖与其后续的迁移。在未来的研究中,需要通过实验来验证这一假设。
综上所述,在老年小鼠口腔黏膜创伤愈合的过程中,年龄的增长导致小鼠口腔黏膜角质形成细胞的初级纤毛出现率降低,而初级纤毛的结构和功能对口腔黏膜创伤愈合具有正向调控作用,初级纤毛的增龄性变化导致口腔黏膜上皮基底层细胞增殖减弱,延缓创伤愈合。
