NDRG1靶向调控MAPK信号通路对直肠癌患者细胞凋亡、侵袭的影响
2023-08-22孙强宋维亮王俊伟程康
孙强 宋维亮 王俊伟 程康
(天津市第三中心医院普外科,天津 300170)
研究显示,大约有1/3结直肠癌患者具有遗传因素影响,在早期的症状较不明显,病情发展缓慢,当发现时大多已是晚期〔1~3〕。在晚期通过手术治疗,在术后5年生存率仍然较低〔4〕。相关研究显示,假如能在早期阶段对结直肠癌患者癌前病变的基因水平进行科学研究,有助于较早进行干预及治疗〔5〕。目前,关于基因分子水平探讨结肠癌发病机制及治疗的研究,已成为广大学者所关注的焦点〔6〕。本文选择探究肿瘤基因N-MYC下游调节基因(NDRG)1靶向调控丝裂原活化蛋白激酶(MAPK)信号通路对直肠癌患者细胞凋亡、侵袭的影响。
1 材料与方法
1.1细胞及主要试剂 人直肠癌细胞株(中国医学科学院)。NDRG1、B细胞淋巴瘤(Bcl)2抗体(Hyclone公司);MAPK抗体(上海博光公司);细胞外信号调节激酶(ERK)2及MAPK2单克隆抗体(MEK)2抗体(BD公司)胎牛血清、青霉素(HYCLONE)RPMI1640培养基、恒温水浴箱(上海医疗器械公司)。
1.2细胞培养及分组 将人直肠癌细胞株以RPMI1640培养基进行培养,同时培养基中含10%胎牛血清及青霉素,转染前胰酶消化细胞,在培养基内,以细胞浓度调整到1×105个/ml,接种在6孔板中进行,于每孔内置放2 ml,将其放置37 ℃恒温箱内进行过夜,当细胞汇合率达70%~80%后,进行后续实验。使用Eco31Ⅰ酶切线性化质粒pGenesil-1,100倍稀释退火产物之后与其连接,20 ℃水浴过夜,使用大肠杆菌DH5α转化,次日选择单克隆菌落,30 μg/ml Kana LB培养液中接种,2 000 r/min离心处理,37 ℃下震混,孵育过夜。少量抽提质粒后使用SacⅠ酶切进行鉴定,分为对照组、下调NDRG1组和上调NDRG1组,重悬处理后分别加入4 μg生理盐水、NDRG1-siRNA、pcDNA3.1-NDRG1,电击后常温保存2 h,各组细胞加入6孔、96孔培养板中,培养箱内培养,取出后,添加800 μg/ml G418培养基进行再次培养。
1.3NDRG1及Bcl2蛋白检测 以Western印迹法对NDRG1及Bcl2蛋白进行检测。将各组细胞接种到6孔板,加入细胞裂解液,裂解细胞,收集上清液;二喹啉甲酸(BCA)检测蛋白浓度,30 μg蛋白样品,进行电泳,室温下孵育1 h,加入兔抗NDRG1、Bcl2及磷酸甘油醛脱氢酶(GADPH)多克隆抗体,4 ℃孵育过夜,第2天室温孵育二抗,重复试验3次,分析条带灰度值。
1.4NDRG1、MAPK、ERK2及MEK2 mRNA表达检测 Trizol法提取细胞总RNA,检测RNA纯度、含量,行逆转录处理后,采用RT-聚合酶链反应(PCR)法检查NDRG1、MAPK、ERK2及MEK2 mRNA表达。反应体系:10 μl 2×All-in-One qPCR Mix、1 μl引物正义链、2 μl 50×Syner Green、2 μl cDNA、1 μl引物反义链、4 μl ddH2O;反应条件:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸10 s,共进行30个循环。
1.5细胞增殖、凋亡能力检测 以噻唑蓝(MTT)比色法对细胞增殖情况进行检测,选择0.125%胰蛋白酶消化生长期细胞,同时将其制作为胆细胞悬液,以2×103个/孔细胞接种于96孔板中,每组设3个复孔,在5% CO237 ℃培养箱中培养。在24、48、72 h分别观察培养细胞,待各组细胞培养到相同时间后,在每孔中加入20 μl MTT,避光孵育4 h,弃去培养液,每孔加入150 μg二甲基亚砜(DMSO)于摇床低速震荡10 min,采用酶标仪测定细胞组光密度(OD)值,按照肿瘤细胞增殖率=(细胞组OD值/参照值-1)×100%的计算公式,计算各组细胞增殖率。
TUNEL法检测细胞凋亡:将20 μg/ml蛋白酶K添加至细胞中,培养0.5 h后去除蛋白,清洗后加入100 μl平衡缓冲液、末端脱氧核苷酸转移酶(TdT)反应液避光培养,1 h后添加柠檬酸钠缓冲液(SSC)100 μl,静置30 min,经洗涤、4′,6-二脒基-2-苯基吲哚(DAPI)染色封片后的细胞核分别呈现为阳性和阴性,取每切片3视野计算细胞凋亡率平均值。
1.6细胞侵袭、迁移能力检测 采用Transwell小室检测各组细胞侵袭能力:实验开始前2 h湿化小室,上室加入细胞悬液(200 μl),下室加入细胞培养液(10%胎牛血清),置于37 ℃、5%CO2细胞培养箱中培养24 h。经磷酸盐缓冲液(PBS)冲洗2次,置于4%多聚甲醛中30 min,使用结晶紫溶液染,倒置显微镜对穿膜细胞进行计数。实验重复3次后取平均值。细胞划痕实验检测细胞迁移能力:将细胞接种至18孔板待其增长到80%时,使用100 μl的枪头,垂直划出3条直线,使用PBS清洗2~3次,分别加入0.5%的血清培养基,观察24 h之后,使用倒置显微镜观察各组细胞的迁移数量。
1.7统计学方法 采用SPSS21.0软件,多组对比行F检验,组间对比行独立样本t检验。
2 结 果
2.1各组NDRG1 mRNA、NDRG1及Bcl2蛋白比较 与对照组相比,下调NDRG1组NDRG1 mRNA及蛋白表达显著下降,Bcl2蛋白表达显著升高(均P<0.05);与对照组、下调NDRG1组相比,上调NDRG1组NDRG1 mRNA及蛋白表达显著升高,Bcl2蛋白表达显著下降(均P<0.05)。见表1、图1。

图1 Western印迹检测NDRG1及Bcl2蛋白表达
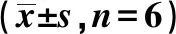
表1 各组NDRG1 mRNA、NDRG1及Bcl2蛋白比较
2.2各组MAPK、ERK2及MEK2 mRNA比较 与对照组相比,下调NDRG1组MAPK、ERK2及MEK2 mRNA表达显著升高(均P<0.05);与对照组、下调NDRG1组相比,上调NDRG1组MAPK、ERK2及MEK2 mRNA显著降低(均P<0.05)。见表2。
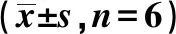
表2 各组MAPK、ERK2及MEK2 mRNA比较
2.3各组细胞增殖率、凋亡率比较 24、48、72 h时,与对照组比较,下调NDRG1组细胞增殖率较高,凋亡率较低,上调NDRG1组细胞增殖率较低,凋亡率较高,差异有统计学意义(均P<0.05)。与下调NDRG1组比较,上调NDRG1组细胞增殖率显著低,凋亡率显著高(均P<0.05)。见表3。
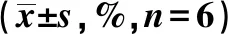
表3 各组细胞不同时间增殖率、凋亡率比较
2.4各组细胞侵袭、迁移能力比较 与对照组相比,下调NDRG1组侵袭、迁移细胞数显著高,上调NDRG1组侵袭、迁移细胞数显著低(均P<0.05)。与下调NDRG1组比较,上调NDRG1组侵袭、迁移细胞数显著低(均P<0.05)。见表4、图2。
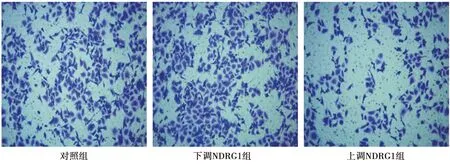
图2 Transwell检测各组细胞侵袭(台盼蓝,×100)

表4 各组细胞侵袭、迁移能力比较个,n=6)
3 讨 论
结肠癌发病率在全部恶性肿瘤中排名第3位,其中大部分患者在发现肿瘤时,已进展至中晚期,在临床上治疗效果欠佳〔7〕。经过手术治疗后,结直肠癌患者约有1/2在5年内出现局部复发或远处脏器转移情况,成为主要影响结直肠癌治疗效果及致死的原因。相关研究显示,原发肿瘤的转移为90%恶性肿瘤患者出现相关死亡的原因〔8〕。因此,对于研究调控原发肿瘤的发生迁移、浸润及形成转移灶的分子生物机制具有重要意义〔9〕。NDRG1为N-MYC下游调节的基因,在多种恶性肿瘤的发展过程中均有参与,同时在细胞的生长发育及维持外周轴突功能完整中均有NDRG1参与,在多个肿瘤组织中呈不同表达〔10〕。相关研究显示,NDRG1在结直肠癌中随无淋巴结转移的结直肠癌向有淋巴结转移的结直肠癌的发展过程中,表达会逐渐升高,差异具有显著性〔11〕。
癌基因、抑癌基因及错配修复基因等在直肠癌肿瘤的发生过程中具有密切联系〔12〕。其发生发展被认为是多因素、多步骤、多阶段及多基因所改变的一个复杂过程〔13〕。Bcl2表达升高能够促进细胞的迁移与增殖,NDRG1能够对其进行抑制,进而在细胞的迁移与增殖中发挥作用〔14〕。在各种肿瘤组织中NDRG1基因的表达水平各不相同,在较多组织中NDRG1基因表达的不一致性,说明可能在转录与翻译水平上能够同时进行调控。相关研究显示,NDRG1表达水平与淋巴结转移情况有关,在有淋巴结转移大肠癌组织中其阳性表达率要低于无淋巴结转移组织〔15〕。本文研究结果表明,NDRG1参与直肠癌发展,同时上调NDRG1能够抑制细胞的迁移与增殖,与上述讨论一致。
MAPK信号通路在细胞迁移及凋亡过程中明显参与,其能够将细胞外信号转移到细胞内,导致下游激酶出现级联反应,激活细胞质中靶蛋白,进而对靶基因表达进行调节〔16〕。相关研究显示,随着恶性肿瘤的程度上升,MAPK信号通路得到激活,能够导致细胞增殖及迁移能力增加,进而使病情程度加重〔17〕。本文研究结果说明,上调NDRG1表达对MAPK信号通路进行靶向调控,能够对直肠癌细胞增殖能力进行抑制,同时增加细胞凋亡。
肿瘤浸润及转移作为恶性肿瘤由局灶性病变进展成全身性、且对生命产生威胁的疾病过程中的标志性事件〔18〕。大多肿瘤的发展过程中,其原发肿瘤均会出现游离出的活跃细胞,对邻近组织浸润,并通过脉管系统转移到远隔器官中,同时形成新的肿瘤灶〔19〕。相关研究显示,进展期的结直肠癌患者预后较差,其主要原因为癌灶中存在具有放化疗抗性的癌细胞,同时能够使肿瘤出现复发及转移的情况〔20〕。本文研究结果说明,上调NDRG1表达能够抑制直肠癌细胞的侵袭及迁移能力,减轻病情严重程度。
综上所述,在直肠癌患者细胞中通过上调NDRG1表达,对MAPK信号通路进行靶向调控,能够抑制癌细胞的迁移与增殖,增加细胞的凋亡,减轻病情严重程度。
