miR-92a通过调控TGF-β1/Smads通路对心房颤动心肌纤维化的影响
2023-08-22梁浩张娜赵乐霍明艳王青松王虹
梁浩 张娜 赵乐 霍明艳 王青松 王虹
(承德医学院附属医院心脏内科,河北 承德 067000)
心房颤动(AF)是高血压、心力衰竭、冠心病等心血管疾病常见的并发症,能够使患者的心功能受到损伤,并且可导致心房收缩功能下降、心房血栓及重要器官栓塞等,具有很高的发病率和致死率,严重影响患者的生存质量〔1〕。心肌纤维化(MF)是心房重构的主要特征,是AF发生的病理基础,其主要特征是心肌成纤维细胞(CF)增殖、分化为肌成纤维细胞及细胞外基质(ECM)的大量沉积〔2〕。转化生长因子(TGF)-β1是CF的增殖、分化和ECM的生成中重要的调节因子,是公认的MF治疗靶标。当心肌细胞受损时,肌成纤维细胞分泌TGF-β1增加,激活Smad家族成员(Smad)2和Smad3的磷酸化,进而激活与肌成纤维细胞转化相关的转录程序。而Smad7可以阻止肌成纤维细胞的形成〔3〕。微小RNA(miRNA)是一类高度保守的20~25 nt的非编码小RNA,其5′末端长为2~8个核苷酸序列能够与靶基因3′-UTR碱基配对结合,在转录后水平抑制基因表达。新近研究表明,心肌细胞的生长发育、心律失常、动脉粥样硬化斑块形成、心肌重构等过程均与miRNA有关〔4〕。Gou等〔5〕发现,下调miR-92a的表达,可抑制缺血/再灌注损伤导致的心肌细胞凋亡,进而促进心功能恢复。段卡丹等〔6〕发现下调miR-92a表达,可降低活性氧(ROS)、Bcl-2相关X蛋白(Bax)、半胱氨酸蛋白酶(Caspase)-3表达,增加B细胞淋巴瘤(Bcl)-2表达,抑制过氧化氢诱导的H9C2心肌细胞凋亡。朱参战等〔7〕发现,微小RNA-21-5p的上调,能够靶向抑制Smad7表达,促进TGF-β1和纤连蛋白(Fibronecin)表达,进而诱导MF,促进房颤发生。薛贻敏等〔8〕发现微小RNA-21通过调节TGF-β1/Smad7信号通路促进慢性病毒性心肌炎小鼠MF。但是miR-92a是否通过调控TGF-β1/Smads信号通路调控AF MF鲜有报道。本研究探讨miR-92a是否通过调控TGF-β1/Smads信号通路对AF大鼠MF产生影响。
1 材料与方法
1.1实验动物 SPF级SD雄性大鼠50只,购自赛业(固安)生物科技有限公司,体质量200~220 g,生产许可证号:SYXK(冀)2021-005。适应性饲养1 w后用于实验,饲养环境设置为:室温23~25 ℃、相对湿度55%~60%、12 h光照/12 h黑暗、正常饮水饮食。本研究目的及实验操作经承德医学院附属医院伦理委员会批准(201905014)。
1.2主要试剂和仪器 Western印迹试剂盒、苏木素-伊红(HE)、Masson染色试剂盒(上海碧云天生物有限公司);二喹啉甲酸(BCA)蛋白测定试剂盒(北京蓝博斯特生物技术有限公司);实时荧光定量聚合酶链反应(qRT-PCR)试剂盒(上海连桥生物科技有限公司);TGF-β1、Smad2、Smad3、Smad7、Ⅰ型胶原蛋白(Collagen-Ⅰ)、Ⅲ型胶原蛋白(Collagen-Ⅲ)抗体(美国CST公司);α-平滑肌肌动蛋白(SMA)、成纤维细胞特异蛋白(FSP)-1、辣根过氧化物酶标记二抗(美国Santa Cruz公司);miR-92a、Smad7引物(上海生物工程技术有限公司);腺病毒载体(天津赛尔生物有限公司)。CKX41显微镜(日本Olympus公司);GeneAmp 9700q型RT-PCR仪(美国thermo公司);3K15低温高速离心机(德国Sigma公司);165-8001蛋白电泳仪(美国Bio-Rad公司);SW-CJ-2FD超净工作台(苏州安泰空气技术有限公司)。
1.3动物分组、模型制作及干预 50只大鼠随机分为5组:对照组、AF组、转染rAAV9-miR-92a-mimic-NC组(AAV-NC组)、转染rAAV9-miR-92a-mimic组(AAV-miR-92a组)、转染rAAV9-miR-92a-mimic-inhibitor组(AAV-inhibitor组)。模型制作:采用乙酞胆碱-氯化钙(ACh-CaCl2)混合液尾静脉注射法构建大鼠AF模型。对照组:大鼠每天尾静脉注射生理盐水(1 ml/kg),共14 d;AF组、AAV-NC组、AAV-miR-92a组、AAV-inhibitor组:每天尾静脉注射ACh-CaCl2(60 μg/ml ACh和10 mg/ml CaCl2〔9〕,1 ml/kg),共14 d。干预:AAV-NC组、AAV-miR-92a组、AAV-inhibitor组:分别在第1天尾静脉注射rAAV9-miR-92a-mimic-NC、rAAV9-miR-92a-mimic、rAAV9-miR-92a-mimic-inhibitor(2×1011vg)1次。14 d后采用MedLab-U/4C501H系统记录大鼠心电图。AF组P波消失,代替为小F波(350~600次/min),表示大鼠AF造模成功(图1)。超声心动图评估大鼠左心室重构及功能。所有大鼠采用尾静脉空气栓塞方式处死,取其心脏组织,部分浸于4%多聚甲醛溶液中固定;部分分离和培养原代心房肌细胞;部分置于-80 ℃冰箱保存待测。

图1 对照组、AF组心电
1.4生物信息学预测及双荧光素酶实验 根据数据库TargetScanHuman(http://www.targetscan.org/vert_72/)预测miR-92a的与Smad7靶向相关。取AF组心肌组织,剪成小块,加入胰蛋白酶和Ⅱ型胶原酶消化,离心后获得原代心肌细胞。构建Smad7的pGL3-Smad7-3′-UTR-野生型(WT)和pGL3-Smad7-3′UTR-突变型(MUT)质粒。取对数生长期的心肌细胞接种于6孔板,将上述质粒分别与mimic-nc和miR-92a-mimic混合后共转染至细胞48 h。按试剂盒要求检测荧光素酶活性。
1.5HE、Masson染色观察大鼠心肌组织病理学改变 ①HE:取心房组织用4%多聚甲醛固定,将固定样本用石蜡包埋,切成厚度为3 μm的切片,按照HE染色试剂盒说明书的操作步骤对石蜡切片进行染色、脱水、透明及固定后,于400倍显微镜下观察心肌细胞结构并拍照,每组随机挑选5个视野。②Masson:取上述石蜡切片,按照Masson染色试剂盒说明书的操作步骤对石蜡切片进行经Weigert铁苏木素染色、Masson返蓝、丽春红品红染色,再经苯胺蓝染色、脱水、透明及固定后,于400倍显微镜下观察心肌胶原纤维沉积情况并拍照,每组随机挑选5个视野。
1.6免疫组化染色观察大鼠心肌组织Collagen-Ⅰ、Collagen-Ⅲ的表达 取石蜡切片经加热熔蜡、脱水、抗原修复,封闭后加入兔抗大鼠一抗Collagen-Ⅰ、Collagen-Ⅲ(1∶100)4 ℃孵育过夜。次日加入生物素标记的二抗,室温孵育20 min,加入链霉亲和素酶,室温孵育30 min,二氨基联苯胺显色,苏木素复染,常规脱水、透明后用中性树胶封片,于显微镜(×400)下观察,每张切片随机选择5个不同视野,使用Image-Pro6.0软件分析阳性染色面积。
1.7免疫荧光检测大鼠心肌组织α-SMA、FSP-1的表达 石蜡切片处理同1.6,加入一抗α-SMA、FSP-1(1∶200)4 ℃孵育过夜,加入二抗室温孵育1 h。冲洗后,将载玻片与DAPI孵育8 min。荧光显微镜(×400)下观察,用Photoshop软件进行处理。
1.8qRT-PCR检测心肌组织miR-92a、Smad7 mRNA表达 组织、细胞:使用TRIzol试剂、mirVana miRNA分离试剂盒分别提取各组癌组织、细胞总RNA、miRNAs。总RNA用反转录试剂盒转录成cDNA。使用1 μg cDNA模板、上下游引物各0.5 μg和SYBR Premix Ex Taq Ⅱ试剂盒配制20 μl PCR体系。miRNAs用All-in-One miRNA qRT-PCR试剂盒进行检测。反应条件:,95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,循环40次。使用ABI 7500实时荧光定量PCR仪完成qRT-PCR操作,应用2-ΔΔCt法计算LncRNA UCA1、miR-28-5p、CENPF的相对表达水平。
取冻存的心肌组织,采用Trizol法提取总RNA。总RNA用反转录试剂盒转录成cDNA,使用1 μg cDNA模板、上下游引物各0.5 μg和SBRY super Mix制备反应体系并进行扩增,β-actin作为内参。反应条件:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 60 s,循环40次。使用2-ΔΔCt公式计算miR-92a、Smad7 mRNA的相对表达水平。PCR引物序列:miR-92a上游引物:5′-CTCCCTATTGTAAACTTGT-3′,下游:5′-ATAGGGTTCATTCCCATACG-3′。Smad7上游引物:5′-AGGTCTTACATGAAACGCAGAGA-3′,下游:5′-AA-CGCGTGTCTCCGTCAACCAACC-3′。β-actin上游引物:5′-GCTCACGGAGCAATAGAAGAGCCTA-3′,下游:5′-TGGTTCTGCTTCGTGCCCATGGCTCC-3′。
1.9Western印迹检测心肌组织TGF-β1、Smad2、Smad3、Smad7蛋白表达 取冻存的心肌组织制成匀浆,加入适量预冷RIPA,充分混匀后冰上孵育30 min,离心提取总蛋白,二喹啉甲酸(BCA)法测定蛋白浓度,取等质量蛋白上样,凝胶电泳分离样品蛋白,转膜,取目的条带用5%脱脂奶粉制成的封闭液室温封闭2 h,封闭液稀释一抗(TGF-β1、Smad2、Smad3、Smad7)制成孵育液,稀释比例为1:200,4 ℃过夜,TBST漂洗3次,加入稀释比例为1∶10 000的对应二抗孵育液,室温孵育2 h,TBST漂洗3次,用ECL发光剂显影,Quantity One软件进行各组蛋白灰度分析,以β-actin作为内参。
1.10统计学分析 采用SPSS16.0软件进行t检验,作图软件采用GraphPad Prism5。
2 结 果
2.1生物信息学预测及双荧光素酶实验 数据库(Target Scan Human)预测结果显示,Smad7基因的第1 329~1 335个核苷酸位置与miR-92a存在靶向结合位点。见图2。双荧光素酶报告基因结果显示,转染miR-92a后,与miR-NC组相比,WT Smad7的荧光素酶活性显著降低(P<0.05),而MUT Smad7荧光素酶活性差异无统计学意义(P>0.05)。见表1。

表1 各组细胞双荧光素酶结果比较

图2 miR-92a与Smad7存在结合位点
2.2各组超声心动图比较 与对照组相比,AF组、AAV-NC组、AAV-miR-92a组左室射血分数(LVEF)、左室短轴缩短率(LVFS)水平显著降低(P<0.05);与AF组相比,AAV-miR-92a组LVEF和LVFS水平显著降低,AAV-inhibitor组LVEF和LVFS水平显著升高(P<0.05)。见图3、表2。
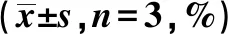
表2 各组LVEF、LVFS水平
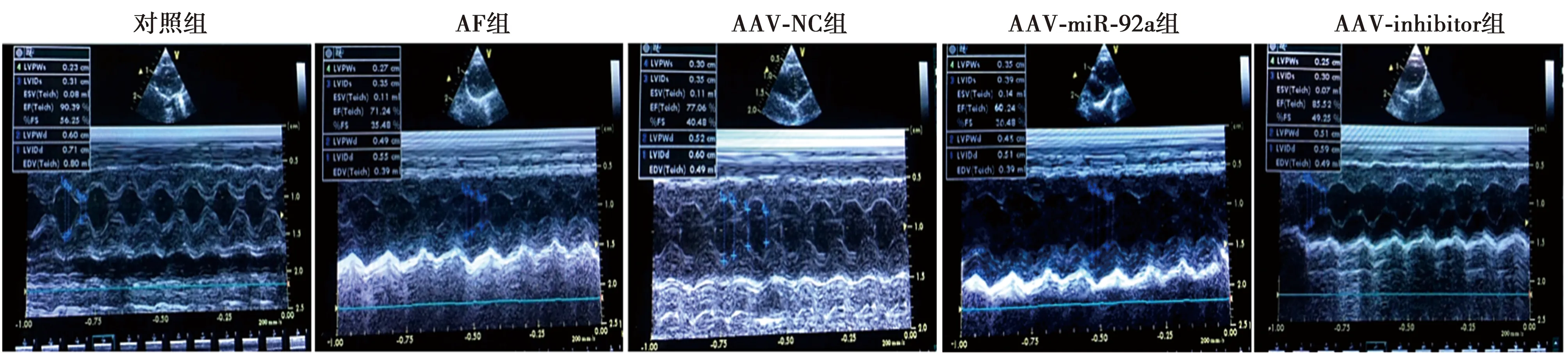
图3 各组超声心动图
2.3各组心肌组织病理学改变 HE染色结果显示,心肌细胞染成紫红色,细胞核染成蓝色。对照组心肌细胞纹路清晰、排列整齐;AF组、AAV-NC组、AAV-miR-92a组心肌细胞排列紊乱,间质增多,成纤维细胞大量增生;AAV-inhibitor组心肌细胞排列稍紊乱,成纤维细胞及间质细胞出现少量增生。Masson染色结果显示,对照组心肌细胞排列整齐、有少量胶原纤维出现,无明显心肌纤维化现象出现;AF组、AAV-NC组、AAV-miR-92a组心肌细胞排列紊乱,胶原纤维大量沉积,心肌组织纤维化明显;AAV-inhibitor组心肌细胞排列稍紊乱,胶原纤维少量沉积。见图4。
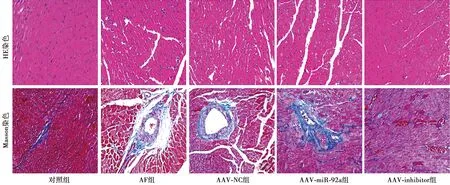
图4 各组心肌组织(×400)
2.4免疫荧光检测各组心肌组织α-SMA、FSP-1 OD值 与对照组相比,AF组、AAV-NC组、AAV-miR-92a组α-SMA、FSP-1水平明显升高(P<0.05);与AF组相比,AAV-miR-92a组α-SMA、FSP-1水平明显升高(P<0.05),AAV-inhibitor组α-SMA、FSP-1水平明显降低(P<0.05)。见图5、表3。

表3 各组心肌组织α-SMA、FSP-1 OD值、miR-92a、Smad7 mRNA、Smad7、TGF-β1、Smad2、Smad3蛋白表达水平比较
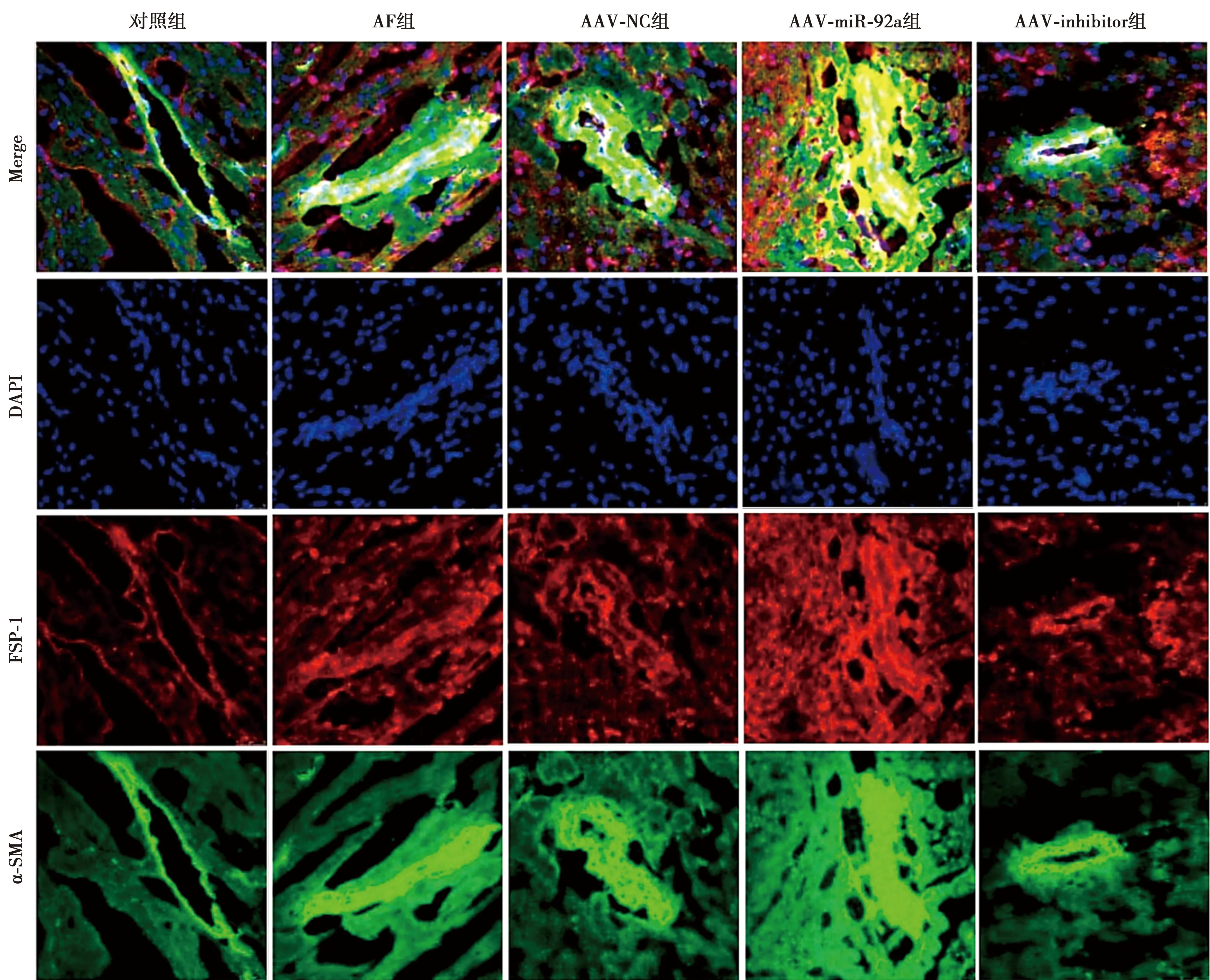
图5 各组心肌组织α-SMA、FSP-1表达(免疫荧光,×400)
2.5各组心肌组织miR-92a、Smad7 mRNA表达 与对照组相比,AF组、AAV-NC组、AAV-miR-92a组miR-92a水平显著升高,Smad7 mRNA水平显著降低(P<0.05);与AF组相比,AAV-miR-92a组miR-92a水平显著升高,Smad7 mRNA水平显著降低,AAV-inhibitor组miR-92a水平显著降低,Smad7 mRNA水平显著升高(P<0.05)。见表3。
2.6大鼠心肌组织Smad7、TGF-β1、Smad2、Smad3蛋白表达 与对照组相比,AF组、AAV-NC组、AAV-miR-92a组TGF-β1、Smad2、Smad3水平显著升高,Smad7水平显著降低(P<0.05);与AF组相比,AAV-miR-92a组TGF-β1、Smad2、Smad3水平显著升高,Smad7水平显著降低,AAV-inhibitor组TGF-β1、Smad2、Smad3水平显著降低,Smad7水平显著升高(均P<0.05)。见表3、图6。
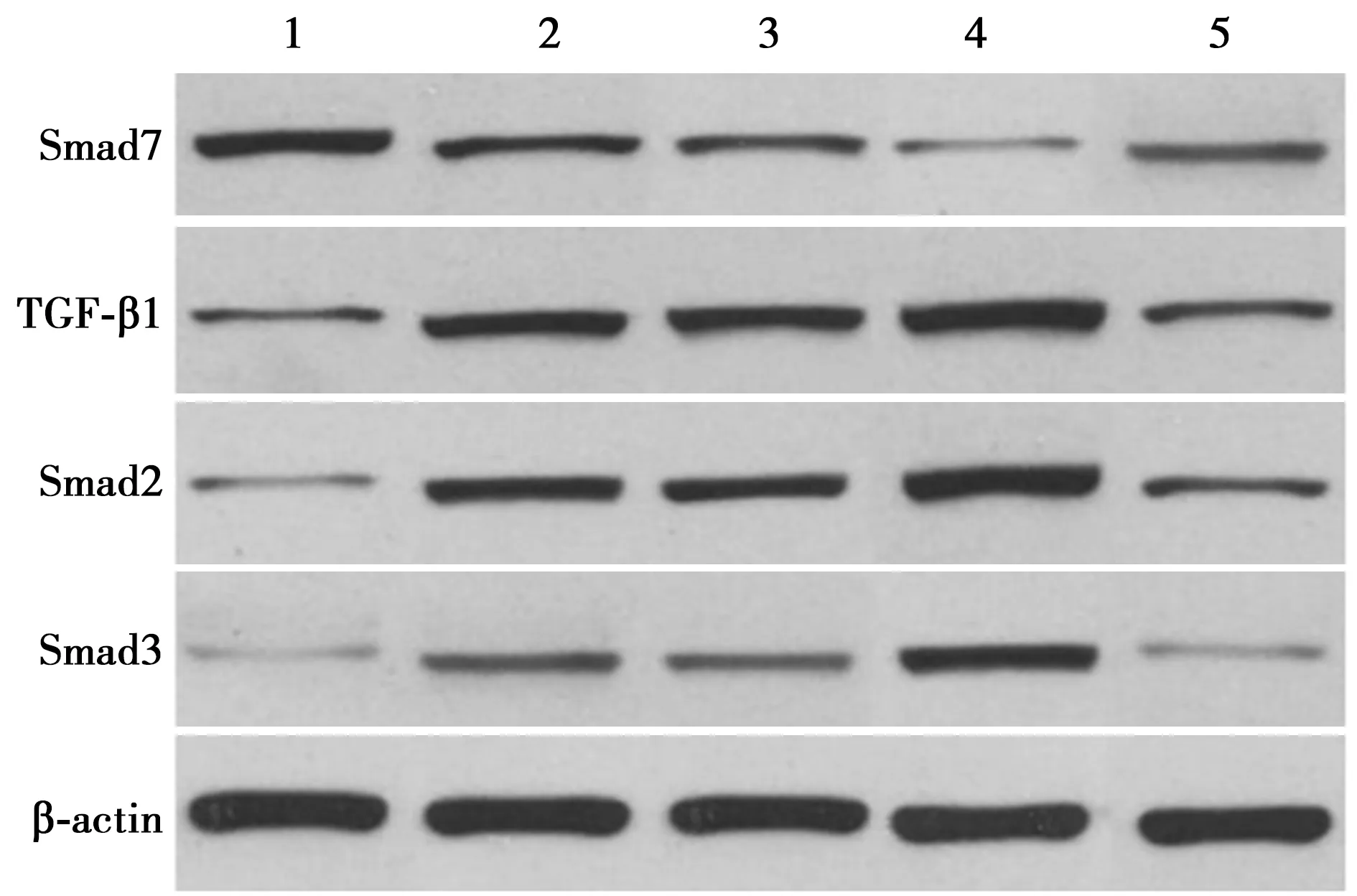
1~5:对照组、AF组、AAV-NC组、AAV-miR-92a组、AAV-inhibitor组
2.7各组心肌组织Collagen-Ⅰ、Collagen-Ⅲ表达免疫组化结果显示,Collagen-Ⅰ、Collagen-Ⅲ阳性表达为棕黄色,与对照组相比,AF组、AAV-NC组、AAV-miR-92a组Collagen-Ⅰ、Collagen-Ⅲ水平显著升高(P<0.05);与AF组相比,AAV-miR-92a组Collagen-Ⅰ、Collagen-Ⅲ水平显著升高,AAV-inhibitor组Collagen-Ⅰ、Collagen-Ⅲ水平显著降低(P<0.05)。见表4、图7。
表4 各组心肌组织Collagen-Ⅰ、Collagen-Ⅲ表达比较
3 讨 论
AF是临床常见的心率失常,其发病机制十分复杂。心房重构是指心脏在损伤情况下发生的结构性变化,目前认为心房重构是导致AF的重要原因。心房结构重构以心房纤维化为特征,纤维化程度与AF明显相关,因此探究其发病机制对预防和治疗AF具有重要意义。miRNA在心肌细胞的生理过程发挥重要作用,如与心肌细胞的衰老、凋亡密切相关。研究发现miR-92a在人内皮细胞中高度表达,损害血管生成。Wang等〔10〕发现,高表达miR-92a,可加重心肌缺血再灌注损伤。Boon等〔11〕发现,miR-92a参与了心肌梗死后的心脏重塑。Zhang等〔12〕发现,抑制miR-92a的表达可减小心肌梗死面积,使梗死后心肌重塑,并可促进心肌组织的血管再生,从而使心脏功能得到恢复。厉菁等〔13〕发现,抑制miR-92a的表达,可以促进H9C2细胞增殖,抑制其凋亡,提示miR-92a对心肌组织及细胞具有不良影响。本研究结果说明,抑制miR-92a表达能够改善心功能,有明显的心肌保护功能。
TGF-β1是对于MF具有重要的促进作用,其可通过激活通路下游相关蛋白促进CF胶原增生及纤维连接蛋白沉积。Smad7基因对该信号通路具有特异性抑制作用,其能够与TGF-β受体竞争性结合,即Smad2、Smad3的磷酸化受到抑制,阻断TGF-β蛋白对下游蛋白的激活作用,从而干预信号通路的传导,并使心肌纤维化得到明显改善。张步升〔14〕发现,Smad7是miR-92a的靶基因,miR-92a的低表达能够提高Smad7水平,通过Smad7/NF-κB信号通路减轻心肌缺血再灌注损伤。朱珂〔15〕发现,扶正化瘀方通过miR-29b-5p靶向TGF-β/Smads通路,增加Smad7水平,降低Smad2、Smad3水平,调控CF增殖、凋亡,抑制心肌纤维化。郭东等〔16〕发现,miR-21通过抑制Smad7基因的表达,激活CF,促进其增殖、分化。本研究结果说明,miR-92a可能通过靶向调控Smad7的表达发挥对TGF-β1/Smads信号通路的干预作用。
胶原纤维包裹正常心肌细胞,引起传导速度减慢,CF被激活,其增殖分化形成肌成纤维细胞,导致Collagen-Ⅰ、Collagen-Ⅲ等细胞外基质过度沉积,α-SMA水平升高,加快纤维化进程。冯巍等〔17〕发现,miR-544通过靶向调控Smad3的表达,阻断TGF-β1/Smad3信号通路,降低Collagen-Ⅰ、Collagen-Ⅲ水平,发挥抗纤维化效应。Kang等〔18〕发现,在ROS诱导的心肌损伤模型中,紫檀芪通过抑制AF相关基因Pitx2c/miR-15b途径,抑制α-SMA、FSP-1水平,减轻大鼠MF。杨泽福等〔19〕发现,miR-125a通过下调Notch1的表达,上调Smad2、Smad3、Collagen-Ⅰ、α-SMA水平,参与调控心肌梗死后MF。本研究结果说明,抑制miR-92a的表达,能降低心肌组织纤维化程度。
