甜瓜SWEET基因家族的全基因组鉴定及生物信息学分析
2023-08-22寿伟松何艳军许昕阳
寿伟松, 何艳军, 沈 佳, 许昕阳
(浙江省农业科学院 蔬菜研究所,浙江 杭州 310021)
糖作为光合作物的产物,为植物的营养生长和生殖生长提供主要能量来源。作为糖代谢的最初底物,蔗糖在光合器官中被合成,然后通过韧皮部的装载和卸载系统被转运到储藏细胞,进而参与核酸、蛋白质、脂质和次级代谢物的合成与代谢[1]。糖不仅参与代谢过程,还是植物抗逆、渗透压调节、信号识别和大分子转运等过程的关键调节因子[2]。但是,由于不能独立运输,糖必须由合适的糖转运蛋白协助转运。目前,在植物中已有3个糖转运蛋白家族被鉴定,包括蔗糖转运蛋白(SUTs)、单糖转运蛋白(MSTs)和糖外排转运子(SWEET)。在这3个家族中,SWEET是最后一个被发现的基因家族,其可介导韧皮部薄壁组织中的糖流入或流出韧皮部质外体[3-4]。与SUTs和MSTs需要能量才能通过质膜运输糖不同,SWEET蛋白可以不依赖质子梯度和pH协助糖在细胞膜和液泡膜上扩散[5-7]。
SWEET蛋白通常含有一个保守的由3个跨膜结构域组成的MtN3_saliva或PQ-LOOP结构[8]。真核生物中的SWEET蛋白通常含有7个跨膜结构域,原核生物中含有3个跨膜结构域。但在植物基因组中也检测到具有3或4个跨膜结构域的SWEET[9]。另外,在葡萄和水稻中也发现了分别由14和15个跨膜结构域组成的新型 SWEET,表明SWEET蛋白跨膜结构域的多样性[9-10]。SWEET基因已在多种植物中被鉴定,包括拟南芥[3]、水稻[11]、小麦[12]、大豆[9]、高粱[13]、黄瓜[14]、番茄[15]、西瓜[16]、卷心菜[17]、葡萄[18]和苹果[19]等。SWEET蛋白的功能不仅限于在细胞外或细胞内区室转运糖,它们还参与多种生理过程,包括花粉发育[20]、植物衰老[21]和种子灌浆[22]等。另外,SWEET在植物与病原体相互作用过程中也发挥一定的作用,OsSWEET11和OsSWEET14是水稻和白叶枯病互作中的负调节因子[23]。在甘薯中过表达IbSWEET10发现其对尖孢镰刀菌表现出更强的抗性,而RNAi植物表现出敏感表型[24]。另外,SWEET蛋白也参与植物对激素和非生物胁迫的响应。在水稻中OsSWEET3a既可以转运葡萄糖,也可以转运赤霉素(GA)。OsSWEET3a基因的敲除和过表达均显示发芽和茎发育缺陷,而这种表型可以通过外源赤霉素添加恢复[25]。BnSWEET12基因在油菜中会被油菜油菜素甾醇(BR)、GA和脱落酸(ABA)诱导[26]。除此之外,AtSWEET4、AtSWEET11、AtSWEET12、AtSWEET15基因被报道在植物耐寒中起重要作用[27-30]。而AtSWEET15基因也可被渗透压、干旱、盐和冷胁迫诱导,过表达AtSWEET15植物根中会表现出加速衰老和细胞活力降低等表型[30]。
甜瓜是一种重要的经济作物,糖在发挥甜瓜经济价值中起重要作用。SWEET基因已被证明在许多植物生长发育、植物-病原体以及植物-环境相互作用中发挥重要作用,但尚未在甜瓜中对其进行研究。在本研究中,我们对甜瓜中的SWEET基因进行了全基因组鉴定与分析,主要包括染色体分布、基因结构、基序分布、系统进化树、顺式调控元件、时空表达模式,以及响应生物和非生物胁迫的表达。本研究初步揭示了甜瓜中SWEET基因家族的特性,为未来开展SWEET基因与甜瓜生长发育、抗病和抗逆等相关等研究提供指导。
1 材料与方法
1.1 甜瓜CmSWEET基因的鉴定
从Phytozome网站(http://phytozome.jgi.doe.gov/pz/portal.htmL)下载已知的SWEET蛋白序列,然后将这些序列导入到CuGenDB数据库中,并在甜瓜数据库(http://cucurbitgenomics.org/organism/18)中进行BLASTP。然后将假定的甜瓜SWEET蛋白提交到Pfam数据库(http://pfam.xfam.org/search/sequence)。利用Pfam的SWEET保守结构域序列生成隐马尔可夫模型(HMM)。用HMMER3.0软件对甜瓜SWEET蛋白进行HMMER搜索。最后,去掉冗余序列以保留特异的甜瓜SWEET蛋白。从CuGenDB网站获取甜瓜CmSWEET基因的染色体位置信息并用CAD软件绘制定位图。利用BioXM软件计算甜瓜SWEET蛋白的分子量和等电点。利用WoLFPSSORT网站预测蛋白亚细胞定位。利用SMART数据库(http://smart.embl-heidelberg.de)对CmSWEET蛋白的跨膜结构域进行分析。
1.2 基因结构、蛋白保守基序分析、进化分析和启动子顺式作用元件分析
应用Structure Display Server 2.0在线软件(http://gsds.gao-lab.org/)对甜瓜CmSWEET的基因结构进行分析。采用MEME在线网站(https://meme-suite.org/meme/doc/meme.html)分析CmSWEET蛋白中的保守基序。从拟南芥基因组数据库(https://www.arabidopsis.org/)、黄瓜基因组数据库 (http://cucurbitgenomics.org/organism/20)和甜瓜基因组数据库下载所有的SWEET蛋白,并将其导入到MEGA 5.0在线软件中利用邻接法(置信值为1 000)进行同源性分析并构建进化树。利用PlantCARE在线网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析甜瓜SWEET基因上游2 000 bp的顺式作用元件。
1.3 CmSWEET基因的表达分析
从甜瓜数据库网站(http://cucurbitgenomics.org/rnaseq/home)下载Charentais组织表达(PRJNA383830)、果实不同发育时期(PRJNA286120)、尖孢镰刀菌侵染NAD和 Charentais-T(PRJEB15551)和 白粉病菌侵染Rochet(PRJNA434538)的RNA-Seq数据,将CmSWEET的基因表达量数据导入到TBtools,制作响应热图。
2 结果与分析
2.1 甜瓜CmSWEET基因的鉴定
采用蛋白质局部定位工具BLASTP与HMM两种方式进行甜瓜全基因组搜索,结果共鉴定出17个SWEET基因。根据这些基因在染色体上的位置,将其命名为CmSWEET01~CmSWEET17。这些CmSWEET基因分布在除了甜瓜染色体 1、6、8和10之外的8条染色体上。其中,染色体5和12各包含3个CmSWEET基因;染色体2、4 和 9包含2个CmSWEET基因;染色体3、7和11各包含 1个CmSWEET基因(图 1)。另外,这些CmSWEET蛋白的氨基酸长度范围在151~297 aa,蛋白分子量在16.59~33.35 ku,蛋白等电点在4.50~10.20。除CmSWEET01和CmSWEET02含有4个跨膜结构域外,多数CmSWEET蛋白含有5~7个跨膜结构域。亚细胞定位结果显示,大部分CmSWEET蛋白定位在细胞膜上,CmSWEET02和CmSWEET10定位在液泡膜上,而CmSWEET15定位在内质网上(表1)。
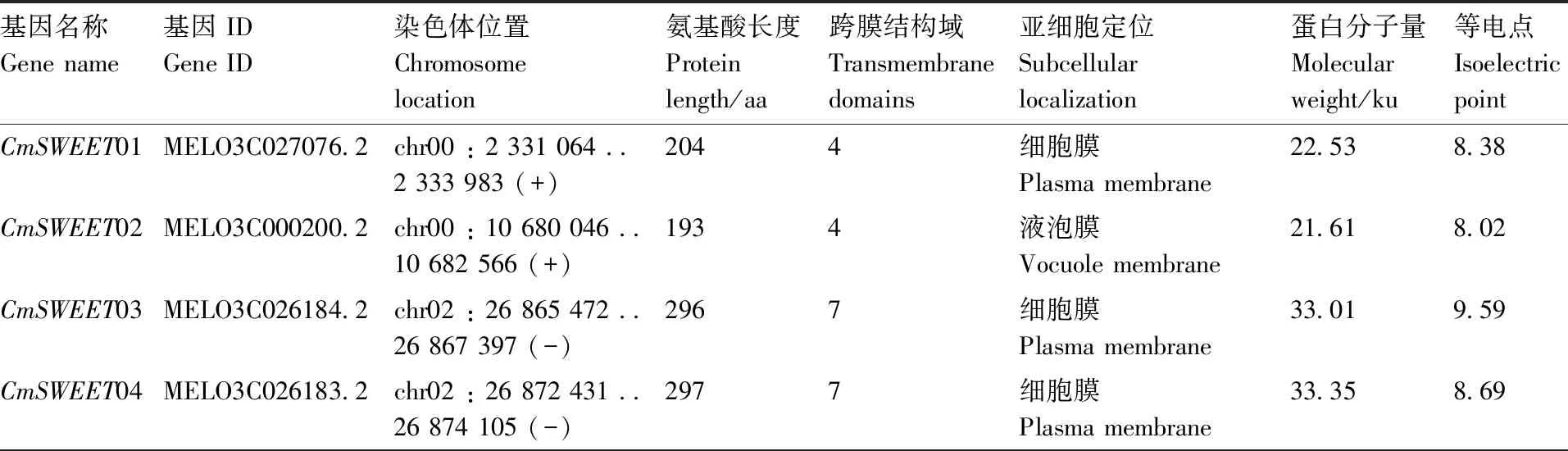
表1 甜瓜CmSWEET基因的特征
2.2 甜瓜CmSWEET基因结构、蛋白结构域和保守基序分析
基于GSDS网站分析基因结构,结果显示,甜瓜中的CmSWEET基因的内含子数目在3~6。CmSWEET01、CmSWEET02、CmSWEET10、CmSWEET13和CmSWEET17基因含有3个内含子,CmSWEET03、CmSWEET04、CmSWEET09、CmSWEET11、CmSWEET12和CmSWEET16含有4个内含子,CmSWEET05、CmSWEET06、CmSWEET08和CmSWEET15含有5个内含子,仅CmSWEET07含有6个内含子(图2)。

图1 甜瓜CmSWEET基因在染色体上的定位
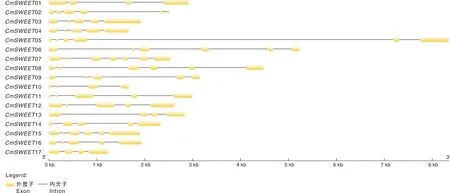
图2 甜瓜CmSWEET基因结构分析
比对CmSWEET蛋白序列并分析甜瓜其成员保守的结构域显示,甜瓜中的CmSWEET蛋白均至少含有一个MtN3/saliva结构域,17个蛋白中的13个蛋白含有2个MtN3/saliva结构域,只有CmSWEET01、CmSWEET02、CmSWEET10、CmSWEET13只含有1个MtN3/saliva结构域(图3)。
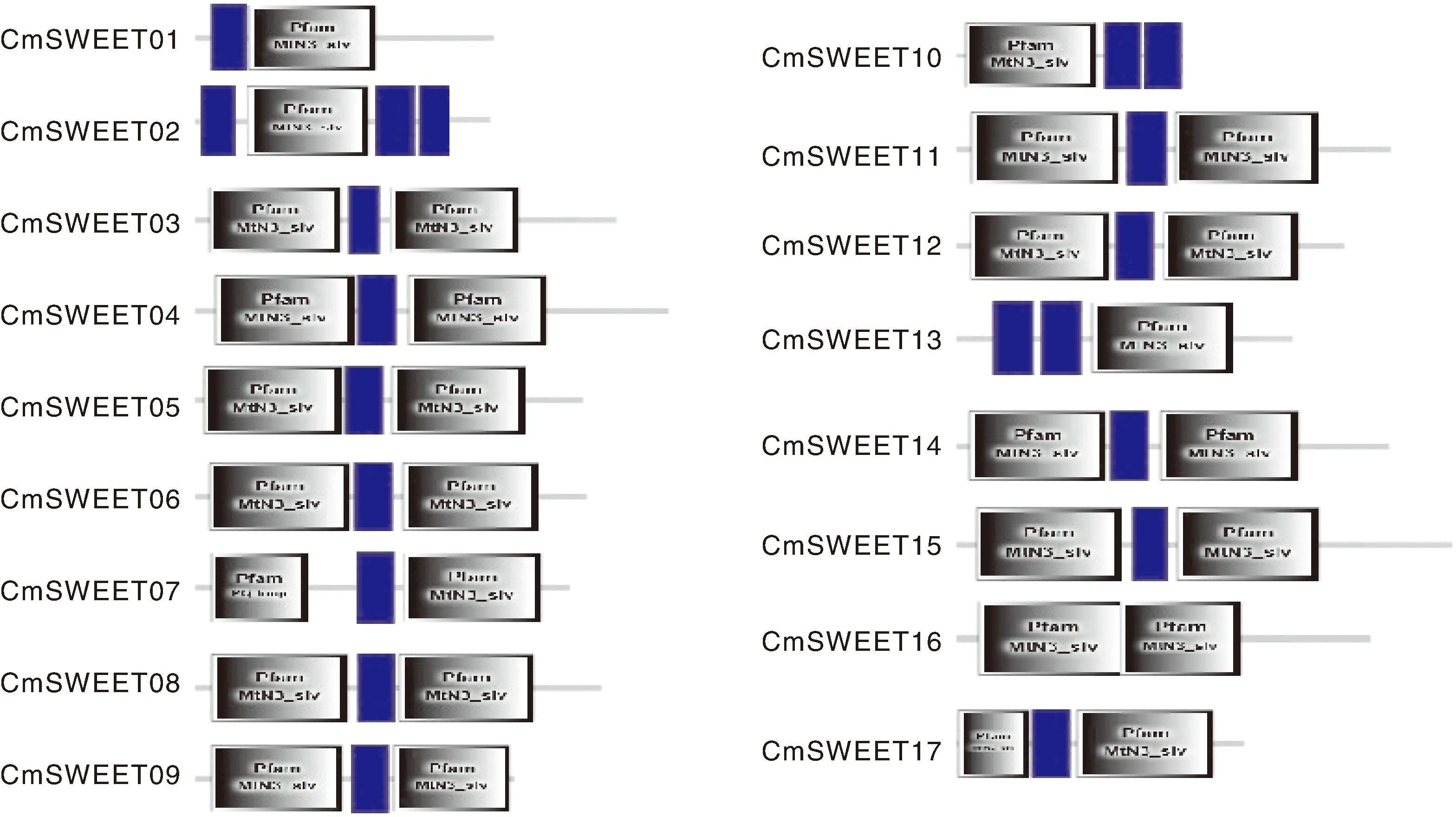
蓝色方块代表跨膜结构域.
利用MEME网址分析CmSWEET蛋白序列的保守基序(图4),结果显示,除CmSWEET16外,其他蛋白都含有4个以上的保守基序。其中,CmSWEET15和CmSWEET04含有全部的8个基序。另外,基序4被16个蛋白所含有,是含有量最多的基序;而基序8仅有3个蛋白含有,是含有量最少的基序。此外,结果还显示具有相同或者相似保守基序的蛋白,比如CmSWEET03、CmSWEET08和CmSWEET09,CmSWEET11和CmSWEET12,CmSWEET06和CmSWEET07被聚集到相同的组中的可能性更大。
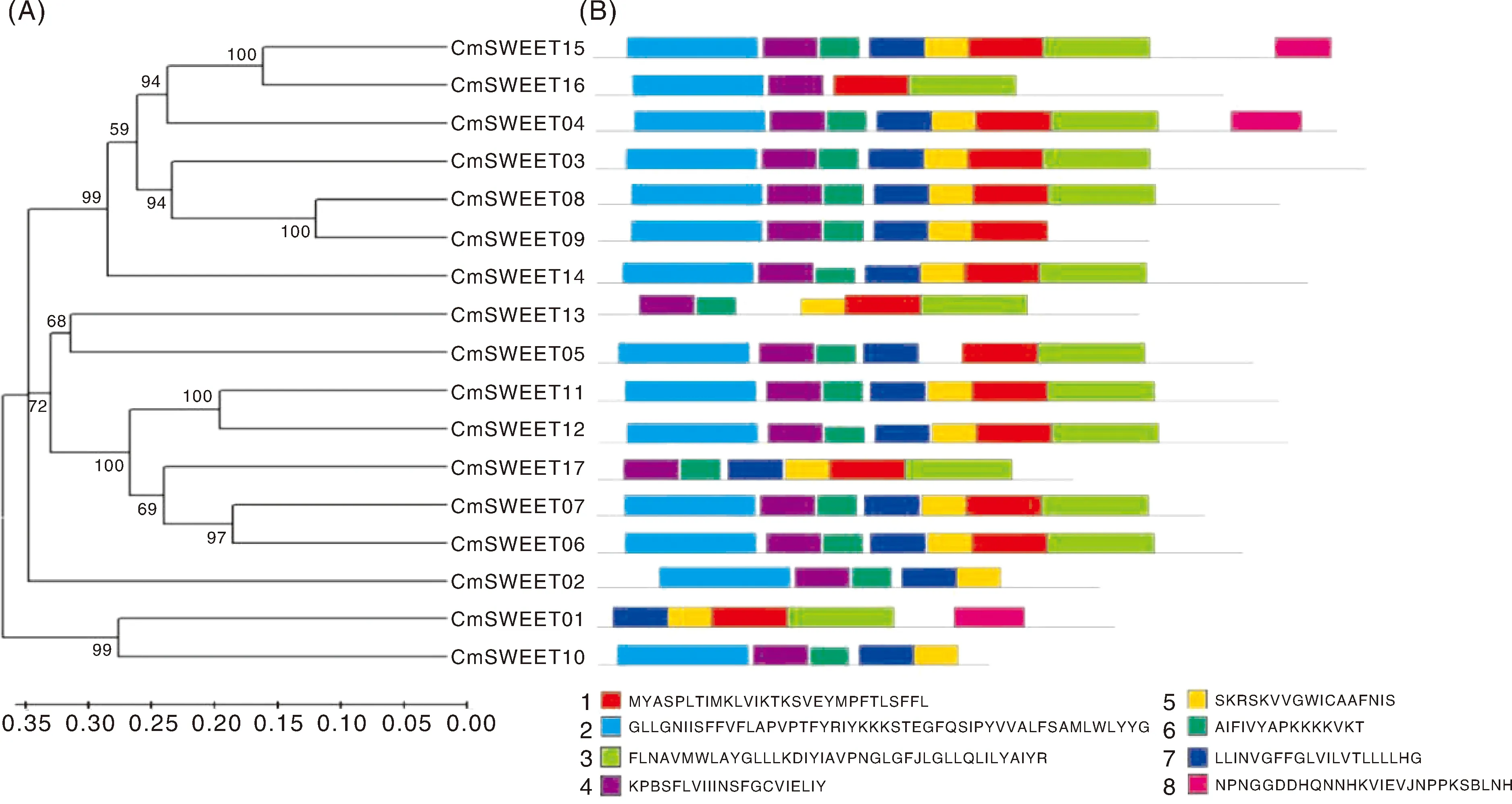
A,甜瓜CmSWEET蛋白进化分析;B,甜瓜CmSWEET蛋白保守基序分析。
2.3 植物中SWEET蛋白的系统进化分析
本研究利用拟南芥、黄瓜和甜瓜中SWEET蛋白构建了系统发育树,来阐明该家族在植物中的进化关系。进化树表明,这些SWEET蛋白被分成4个亚族(图5)。绝大多数成员被聚类在亚族Ⅰ和Ⅱ中。其中,亚族Ⅰ包含8个AtSWEET 蛋白、8个CsSWEET蛋白和7个CmSWEET蛋白。亚族Ⅱ含7个AtSWEET蛋白、6个CsSWEET蛋白和7个CmSWEET蛋白。亚族Ⅳ包含2个AtSWEET、2个CsSWEET和2个CmSWEET。而亚族Ⅲ成员最少,且只包含来自甜瓜的1个(CmSWEET01)和黄瓜的1个(CsSWEET17a)成员,这表明亚族Ⅲ很可能是一个葫芦科特有的亚族,在进化和功能上具有特异的作用。

图5 基于拟南芥,黄瓜和甜瓜中的SWEET蛋白的系统发育树
2.4 甜瓜CmSWEET基因的顺式作用元件分析
为了解CmSWEET基因对各种因素的响应,我们分析了CmSWEET基因上游启动子的顺式调节元件。 结果发现,在CmSWEET基因启动子中发现许多与激素响应、应激响应、发育相关以及光响应的元件(表2、表3、表4)。激素响应元件包含2种脱落酸响应元件(ABRE和GC-motif)、1种生长激素响应元件(TGA-element)、2种茉莉酸甲酯响应元件(CGTCA-motif和TGACG-motif)、2种赤霉素响应元件(GARE-motif和P-box)和1种水杨酸响应元件(TCA-element)(表2)。其中,脱落酸响应元件(ABRE)数目最多,在14个CmSWEET基因的启动子上均被检测到。应激响应元件包含了1种厌氧响应元件(ARE)、2种干旱响应元件(MBS 和 MYC)、1种伤害响应元件(WUN-motif)和3种防御和胁迫响应元件(MYB、W-box和TC-rich element)(表3)。其中,MYC和MYB元件在所有的CmSWEET基因的启动子上均有分布,这暗示了CmSWEET基因可能参与甜瓜干旱和防御的响应过程。光响应元件涉及种类众多,CmSWEET基因的启动子上均有分布(表4)。其中,Box4和G-box是CmSWEET基因的启动子上含有的最多的2个元件。发育相关的响应元件包含与分生组织表达相关(CAT-box)、 昼夜节律调节(circadian)、叶肉细胞分化(HD-Zip I)、黄酮类生物合成(MBSI)、玉米醇溶蛋白代谢调节(O2-site)、胚乳发育相关(GCN4_motif)和种子特异性调节(RY-element)响应元件。这些结果表明,CmSWEET基因通过各种环境适应参与多种生理过程。
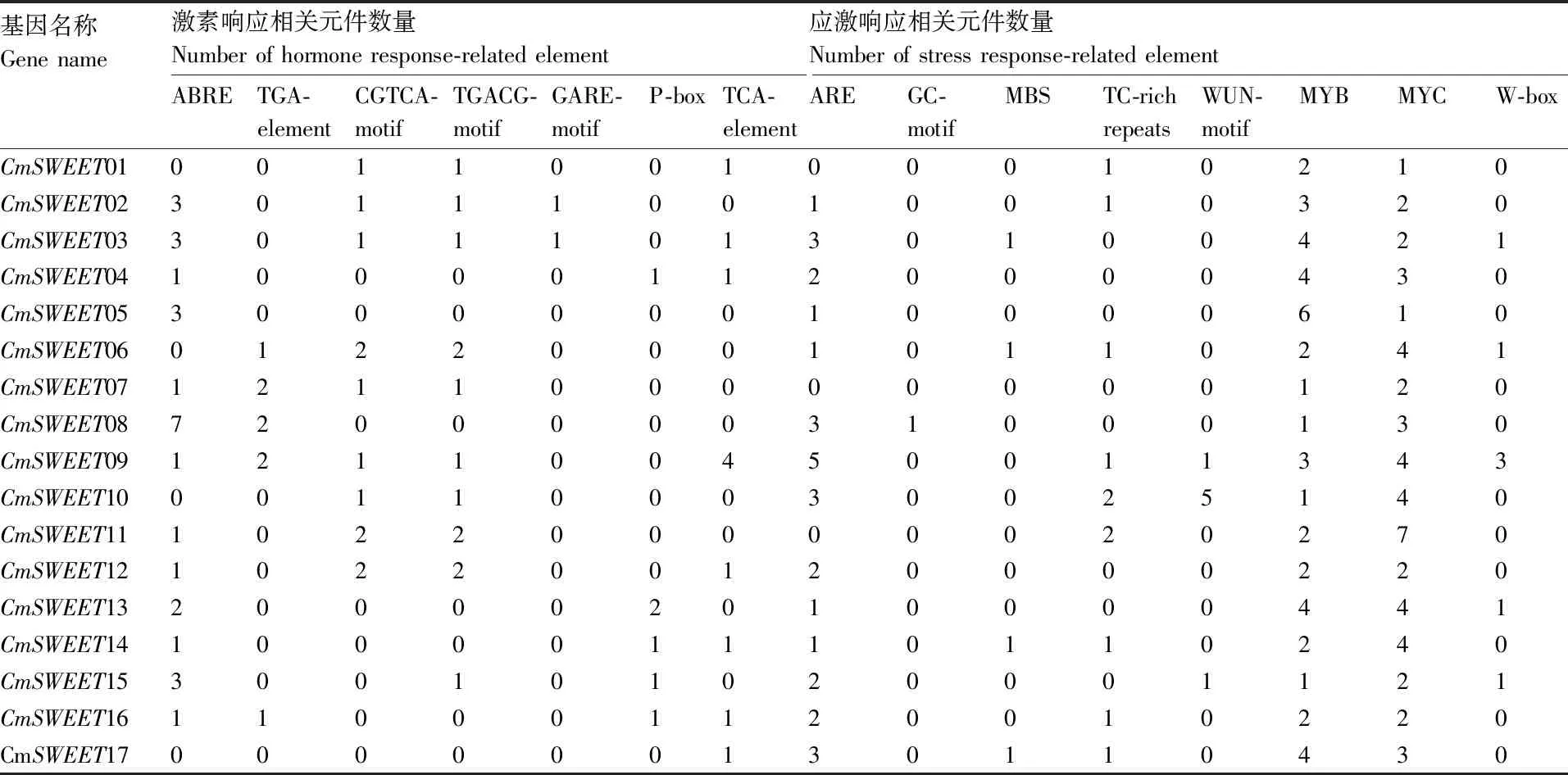
表2 甜瓜CmSWEET基因启动子上激素和应激相关顺式作用元件
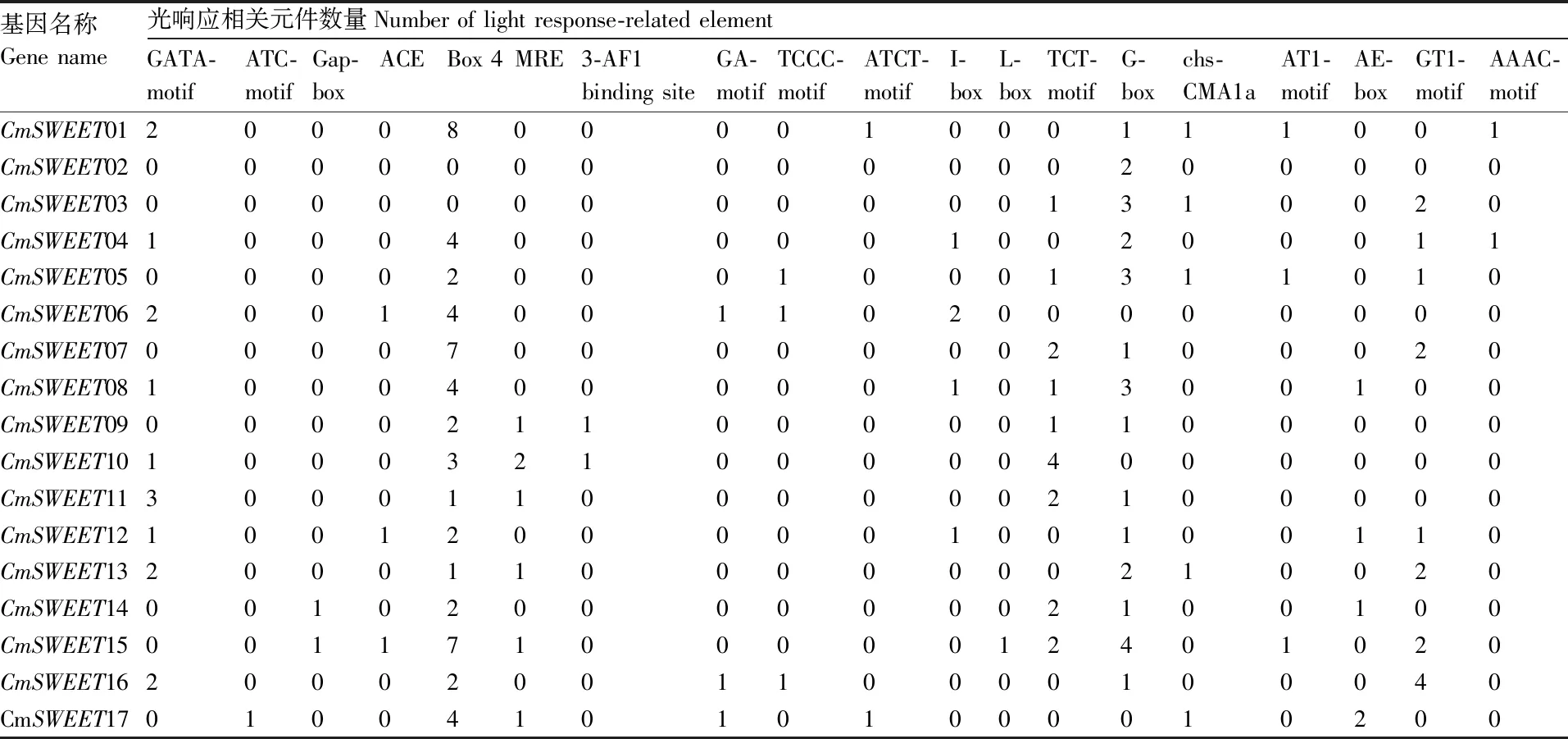
表3 甜瓜CmSWEET基因启动子上光响应相关顺式作用元件
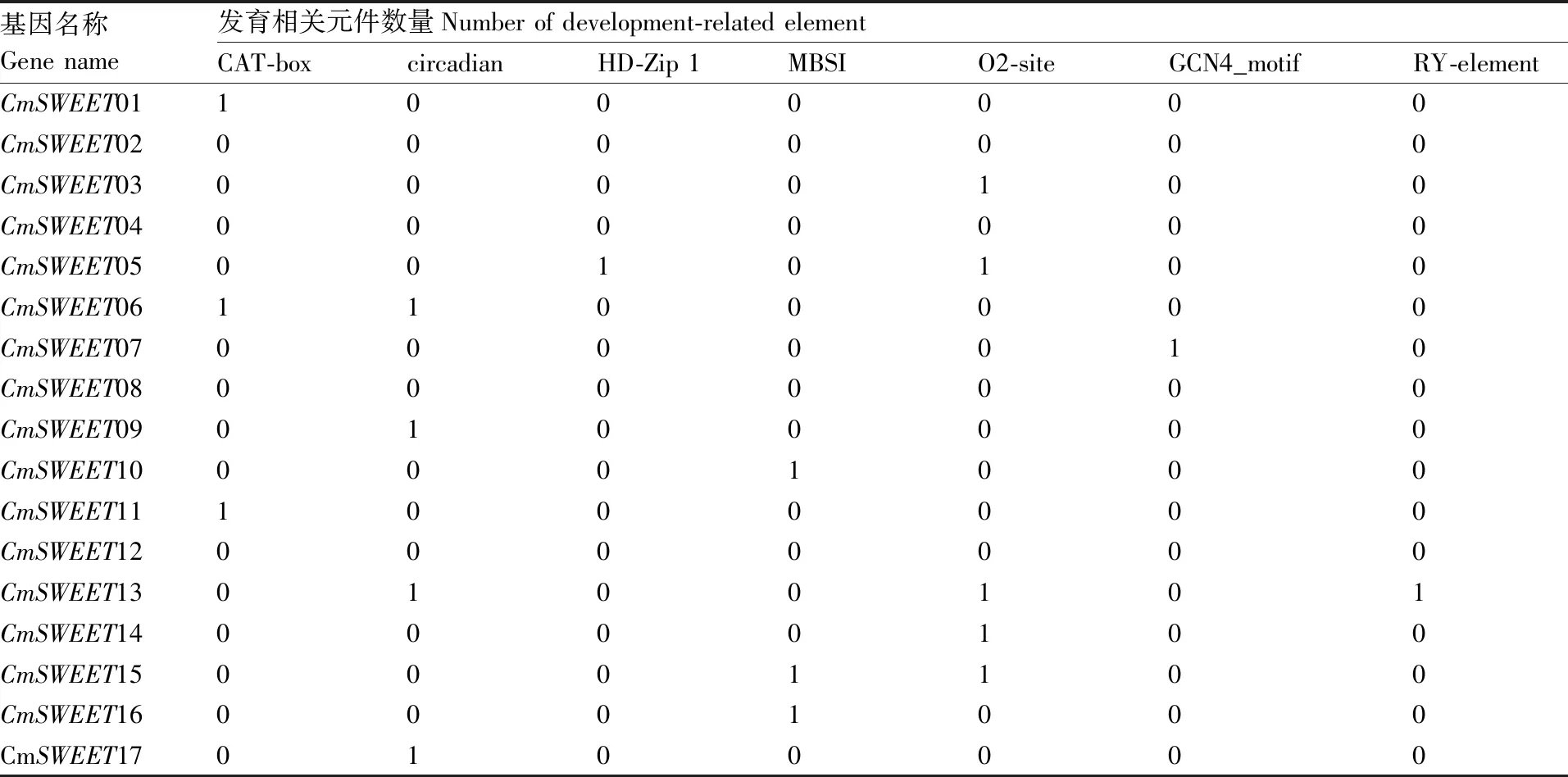
表4 甜瓜CmSWEET基因启动子上发育相关顺式作用元件
2.5 甜瓜CmSWEET基因的组织表达以及响应枯萎病和白粉病的表达分析
为研究CmSWEET基因在不同器官中的转录表达水平,本研究对其在甜瓜品种Charentais的根、叶、果实以及雌花和雄花中的RNA-Seq数据进行了分析。热图反映了CmSWEET基因的表达模式,结果显示,除了CmSWEET08和CmSWEET09,其他CmSWEET成员都可以在一个或者几个器官组织中被检测到(图6-A)。相比于叶和果实,雌花、雄花和根中检测到的基因较多。其中,CmSWEET05和CmSWEET14在雄花中有显著的mRNA积累,CmSWEET13在果实中的表达量较高。为了进一步探究CmSWEET基因在果实不同发育时期的表达情况,本研究分析了绿肉和橙肉甜瓜(来源于Dulce与Tam-Dew杂交的F3群体)的 RNA-Seq数据。结果发现,CmSWEET01、CmSWEET03、CmSWEET11和CmSWEET13在甜瓜不同果实发育时期的表达量均比较高,而CmSWEET05在果实发育早期表达量较高,CmSWEET13在果实成熟期表达量较高。除此之外,其他CmSWEET基因在果实发育时期表达量都较低(图6-B)。
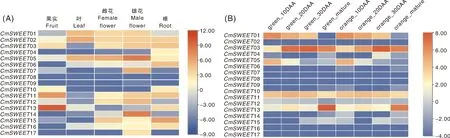
“green_”和“orange_”表示Dulce与Tam-Dew杂交的F3群体中的绿肉和橙肉甜瓜。
为了探究CmSWEET基因对生物胁迫的响应,本研究分析了抗病品种NAD和感病品种Charentais-T (CHT)的茎组织对枯萎病响应的RNA-Seq数据。结果显示,感染尖孢镰刀菌24 h后,抗病品种NAD中CmSWEET12、CmSWEET13、CmSWEET14和CmSWEET15有一个稍显著的表达下降外,其他CmSWEET基因表达变化不大;感病品种CHT中CmSWEET14的表达量出现明显下降(图7-A)。感染尖孢镰刀菌48 h后,CmSWEET06、CmSWEET07、CmSWEET10、CmSWEET13和CmSWEET15在抗病品种NAD中表现出表达下降,而CmSWEET05、CmSWEET06、CmSWEET09、CmSWEE10和CmSWEE12在感病品种CHT中则表现出上调表达。另外,本研究利用品种Rochet幼叶的RNA-Seq数据分析其对白粉病的响应。结果显示,在白粉病菌Podosphaeraxanthii侵染24 h后,CmSWEET01、CmSWEET02、CmSWEET05和CmSWEET16的表达量上升;CmSWEET04、CmSWEET10、CmSWEET14和CmSWEET15表达下调;侵染48 h后,整体情况与侵染24 h差不多,但CmSWEET10却表现出表达上调;侵染72 h后,CmSWEET01、CmSWEET05和CmSWEET14呈现出表达上调(图7-B)。
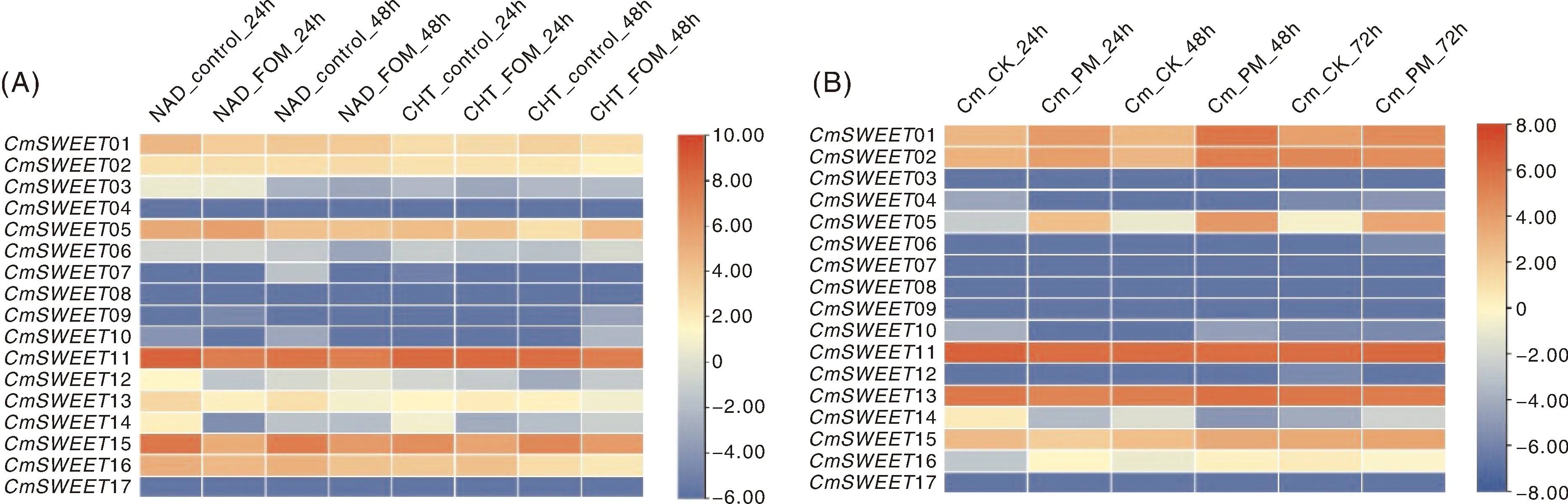
NAD和CHT为甜瓜两个品种;FOM代表尖孢镰刀菌FOM1.2侵染;control代表空对照;Cm代表Cucumis melo;CK代表空对照;PM代表白粉病菌侵染。
3 结论与讨论
糖是甜瓜果实积累的主要营养物质,也是甜瓜口感风味和商品价值的重要指标。SWEET蛋白作为一个新发现的糖转运蛋白家族,可介导韧皮部薄壁组织中的糖流入或流出质外体,进而将糖输送到植物各个器官和组织[7,20,31]。SWEET基因已在多种植物中被鉴定,且许多研究表明,SWEET基因参与园艺作物果实的发育和成熟阶段的糖转运工作。但目前尚未有SWEET家族基因在甜瓜中的研究报道。本研究鉴定甜瓜中的SWEET基因将为今后深入探究SWEET基因功能和开发利用该基因家族以辅助甜瓜品质育种奠定基础。
真核生物中SWEET蛋白是由含2个MtN3/saliva结构的7个跨膜结构域组成,不同于原核生物中的SWEET蛋白仅包含1个MtN3/saliva结构和3个跨膜结构域。Xuan等[8]认为,该现象表明真核生物中的SWEET蛋白是原核生物的MtN3/saliva结构域在进化过程中发生复制融合而形成。本研究通过全基因组搜索,共鉴定出17个分布在9条染色体上的甜瓜SWEET蛋白。蛋白结构显示,17个CmSWEET中有13个具有2个完全保守的MtN3/saliva域,其余成员只拥有1个MtN3/saliva结构域(图 3)。相似地,在水稻和高粱中也发现一些SWEET基因(OsSWEET7a、OsSWEET7e、SbSWEET3和SbSWEET4)只含有1个MtN3/saliva结构域[11]。另外,与许多植物如大豆、黄瓜和西瓜中的部分SWEET基因相似,CmSWEET03和CmSWEET04、CmSWEET06和CmSWEET07、CmSWEET08和CmSWEET09、CmSWEET15和CmSWEET16在相同的染色体上展现出串联重复排列(表1)[9,16,24]。这些结果表明,SWEET蛋白在进化过程中可能会发生复制、融合或遗传丢失。
基于拟南芥SWEET系统分类,甜瓜的SWEET蛋白也被分为4个进化支(图 5)。与此前分类不同的是,本研究中的分支Ⅰ包含了拟南芥的Ⅰ和Ⅱ两个亚族,分支Ⅱ与拟南芥的亚族Ⅲ相同,分支Ⅳ类与拟南芥的亚族Ⅳ相同,唯有分支Ⅲ不包含拟南芥任何一个SWEET,仅含有黄瓜的CsSWEET17a和甜瓜的CmSWEET01两个蛋白(图5)[24]。这种不同于十字花科的拟南芥中的系统进化现象,很可能是葫芦科植物(尤其是甜瓜和黄瓜上)特有的进化造成的。另外,拟南芥亚族Ⅳ中的AtSWEET16和AtSWEET17蛋白被报告定位在液泡膜上,主要运输果糖[31]。本研究发现,与其聚类在同亚族的CmSWEET2和CmSWEET10也被预测定位于液泡膜(表1),这表明尽管本研究中的进化分类与拟南芥中的分类不同,但具有相似功能的蛋白依然被划分到同一个亚家族中。
作为渗透压保护剂和分子开关,糖参与调节植物胁迫下的抗性和适应性[32]。研究发现,拟南芥的AtSWEET4、AtSWEET11和AtSWEET12基因等参与响应各种非生物胁迫[27-28]。在本研究中,所有的CmSWEET基因的启动子区域都含有与胁迫(包括厌氧、干旱、伤害和防御)相关的元件,这表明CmSWEET基因可能在参与调控甜瓜的非生物胁迫中起着重要作用。另外,CmSWEET基因的启动子区域还包含许多激素响应相关的元件,该发现不仅丰富了CmSWEET基因的特点,也为后期开展CmSWEET基因通过介导激素参与调节甜瓜生长发育研究提供了思路。
许多研究表明,SWEET基因多在花(尤其是雄花)和果实中高表达。在本研究中,多个CmSWEET基因在雄花中的表达量高于其他组织,这与之前报道一致。其中,CmSWEET05、CmSWEET07和CmSWEET14基因在雄花中的表达量显著高于其他组织,暗示了这3个基因可能参与花粉的发育和花蜜的分泌。值得注意的是,组织表达RNA-Seq数据显示,除了CmSWEET11和CmSWEET13,大多数的CmSWEET基因在果实中的表达量较低,但果实发育不同时期转录组数据结果显示,部分CmSWEET基因在果实膨大期或者成熟期有较高的表达。本研究猜测两个结果不一致源于组织取样的差异。而CmSWEET01、CmSWEET03、CmSWEET05、CmSWEET11和CmSWEET13基因在果实发育时期的高表达暗示它们在甜瓜果实的生长发育过程中起着重要作用。
为了生长和繁殖,许多病原体已经进化出通过影响糖外排系统而从宿主获得葡萄糖的机制。因此,病原体能够改变感染部位的糖外排系统来调节植物免疫[3]。枯萎病是由尖孢镰刀菌引起的一种主要的土壤传播疾病,它定居于根和茎组织的外维管系统,严重破坏甜瓜的生长[33]。与许多作物中SWEET表达相似,本研究中的CmSWEET基因在感染尖孢镰刀菌后在抗病品种和感病品种之间表现出不同的表达模式。在感染24 h后,抗病品种中有4个CmSWEET基因下调表达;感病品种中只有CmSWEE14基因下调表达。在感染48 h后,抗病品种中下调基因增加到5个,而感病品种中的部分CmSWEET基因却表现出上调表达。其中,CmSWEET06和CmSWEET10基因在抗病和感病品种中表现出相反的表达趋势,暗示它们可能在甜瓜抗枯萎病中发挥关键作用。白粉病是甜瓜生产中主要真菌病害之一,严重危害甜瓜产量与品质[34]。本研究发现有6个基因能够被白粉病菌侵染诱导表达(图7-B),表明他们在白粉病侵染过程中发挥正调控作用。其中,CmSWEE01和CmSWEE05基因在白粉病侵染的早、中和晚期的表达量均会上调,暗示这2个基因在响应白粉病的过程中有重要作用。
