静脉-动脉体外膜肺氧合和主动脉内球囊反搏联合辅助顺序对急性心肌梗死合并心源性休克患者的临床效果比较研究
2023-08-22崔晓娜冯瑞霞韩雨澎周瑶瑶刘小军李建朝
崔晓娜,冯瑞霞,韩雨澎,周瑶瑶,刘小军*,李建朝
心源性休克(CS)是指由于心脏功能极度减退,导致心输出量显著减少并引起严重的急性周围循环衰竭的一种综合征,其病因以急性心肌梗死(AMI)占比最高,约80%[1]。AMI 患者发生CS 的比例为4%~12%[2]。AMI 合并CS(AMI-CS)病情进展迅速,尽管早期经皮冠状动脉介入治疗(PCI)行血运重建和积极的心血管活性药物治疗起到了一定的作用,但AMI-CS 患者病死率仍高达50%[3]。因此机械性循环辅助(MCS)的支持尤为重要[4]。静脉-动脉体外膜肺氧合(VA-ECMO)和主动脉内球囊反搏(IABP)为目前常用于AMI-CS 的MCS 手段。相较于单独VA-ECMO 或IABP 应用,二者联合辅助的治疗方式对AMI-CS 患者更有利,但关于二者联合辅助顺序对AMI-CS 患者的疗效和预后却鲜有报道。本研究将VA-ECMO 和IABP 联合辅助的方式进一步细化,通过多中心回顾性分析在不同联合辅助顺序AMI-CS 患者的临床资料,评价其疗效,分析并发症和预后情况,以期为临床医生治疗该类患者时提供循证学依据。
1 对象与方法
1.1 研究对象 回顾性纳入2021—2022 年在郑州大学第二附属医院和阜外华中心血管病医院重症医学科接受VA-ECMO 联合IABP 治疗的AMI-CS 患者为研究对象。纳入标准如下,(1)18~75 岁。(2)Killip 分级≥Ⅲ级。(3)满足AMI-CS 的4 项诊断标准:①收缩压<90 mmHg(1 mmHg=0.133 kPa)持续30 min 以上,或需升压药维持>90 mmHg,或平均动脉压(MAP)<65 mmHg 持续30 min 以上;②至少合并一项组织低灌注表现:意识改变,皮肤或四肢末梢冰冷、潮湿,尿量<30 mL/h,动脉血乳酸(Lac)>2.0 mmol/L;③左心室充盈压升高:新发端坐呼吸或胸片示肺淤血,动脉导管示肺毛细血管楔压升高或超声心动图示左房室瓣E 波减速时间≤130 ms,心导管检查左心室舒张末期压>20 mmHg[5]。排除标准:(1)心肺复苏超过30 min 者;(2)入住ICU 后72 h 内死亡者;(3)有不可逆性心、肺病变或严重的外周动脉疾病,无安装心室辅助装置可能者;(4)存在AMI 机械并发症如乳头肌功能失调或断裂、室间隔穿孔及严重心律失常者;(5)终末期多器官功能衰竭者;(6)合并恶性肿瘤晚期者;(7)中途放弃治疗者。最终纳入82 例患者。本研究通过郑州大学第二附属医院伦理委员会批准(审批号:2023016),家属均签署知情同意书。
1.2 VA-ECMO 与IABP 干预方式 患者均采用VAECMO 与IABP 联合辅助模式,由郑州大学第二附属医院和阜外华中心血管病医院ECMO 核心小组在ICU 或PCI 手术间完成。VA-ECMO 采用美国Medtronic 离心泵和氧合器,于同侧股静脉、股动脉置入肝素涂层导管。同时在同侧股浅动脉远端置入5F 泰尔茂鞘管预防下肢远端缺血坏死。IABP 采用美国ARROW AutoCAT2 系统,经皮股动脉穿刺置入。
使用晶体液预充VA-ECMO 管道系统。为防止血液逆流,先打开静脉管道钳,启动VA-ECMO 泵至转数在1 500 r/min 以上后再打开动脉管道钳,运行VA-ECMO。期间调整VA-ECMO 流量,维持MAP ≥60 mmHg;加强液体管理,使中心静脉压<8 mmHg,左心房压<10 mmHg;调整氧供需平衡,维持静脉血氧饱和度>60 mmHg;全身肝素化,使活化凝血时间维持在150~180 s;及时补充新鲜血小板,维持血小板在70×109/L 以上;合理使用正性肌力药物和血管活性药物,保持循环稳定;咪达唑仑和瑞芬太尼持续静脉泵注,维持患者镇静状态,气管插管或无创机械通气。
根据相关指南[6]和两个中心的治疗共识,按照以下程序和标准撤机:当心脏功能逐步恢复,生命体征趋于稳定时,每1~2 h 减1 次流量,当降至1.0~1.5 L/min 时,辅以小剂量正性肌力药物或血管活性药物,使MAP ≥65 mmHg,脉压>20 mmHg,心指数(CI)>2.4 L·min-1·(m2)-1,混合静脉血氧饱和度(SvO2)>60%,Lac<2.0 mmol/L。血流动力学稳定3 h 以上时在保留IABP前提下撤除ECMO。当左心室射血分数(LVEF)>40%时,逐步减少IABP 辅助频率至1∶2(>24 h)或1∶3(>12 h),再次评估血流动力学状态,如仍然稳定,则撤除IABP。
1.3 观察指标 通过电子病历系统收集患者以下资料,(1)基线资料:年龄、性别、BMI、吸烟史(定义为仍在吸烟或戒烟时间<6 个月)、高血压史、糖尿病史、高脂血症史、脑卒中史、陈旧性心肌梗死史;(2)联合治疗前和治疗后24、72 h 临床指标,包括MAP、CI、肾小球滤过率(GFR)、Lac、肌钙蛋白I(cTnI)和脑利钠肽(BNP);(3)治疗情况:AMI 的类型,冠状动脉病变特点,PCI 后心肌梗死溶栓治疗(TIMI)血流3 级比例及IABP-SHOCK Ⅱ评分,正性肌力药物和血管活性药物的使用比例,ICU 住院时间,VAECMO 和IABP 联合辅助时间和间隔辅助时间,血制品(红细胞、血浆、血小板和冷沉淀)输注比例和连续性肾脏替代治疗(CRRT)比例;(4)相关并发症和预后:肺部感染、急性肾损伤(AKI)、凝血功能障碍、消化道出血、下肢血栓、神经系统并发症和多器官功能障碍综合征(MODS)的发生率、出院生存率。
1.4 分组 根据VA-ECMO 和IABP 辅助的先后顺序,将入选的患者分为两组:A 组(先IABP 后VA-ECMO辅助,n=42);B 组( 先VA-ECMO 后IABP 或VAECMO 与IABP 同期辅助,n=40)。其中先IABP 后VA-ECMO 指先期置入IABP,但由于流量不足、循环不稳定而后期增加VA-ECMO 辅助。先VA-ECMO 后IABP 指先期置入VA-ECMO,但由于外周组织灌注不良和/或左心室负荷过重而后期增加IABP 辅助;VAECMO 与IABP 同期辅助指二者同时安装。
1.5 相关定义与诊断标准 (1)IABP-SHOCK Ⅱ评分标准[7]:对AMI-CS 患者预后进行评估,总分0~9 分,评分越高预后越差,其中0~2 分为低危,3~4 分为中危,5~9 分为高危,具体标准见表1。(2)撤除ECMO 后,患者生存时间≥48 h 定义为ECMO 撤机成功[8]。(3)生存出院定义为患者撤机成功并存活出院。

表1 IABP-SHOCK Ⅱ评分标准(分)Table 1 IABP-SHOCK Ⅱ scoring criteria
1.6 统计学方法 采用SPSS 29.0 统计学软件进行数据分析,符合正态分布的计量资料以(±s)表示,两组间比较采用独立样本t 检验,重复测量资料比较采用双因素重复测量方差分析,组间两两比较采用配对t 检验;不符合正态分布的计量资料以M(P25,P75)表示,两组间比较采用Wilcoxon 秩和检验;计数资料以相对数表示,组间比较采用χ2检验,等级资料比较采用秩和检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者基线资料比较 两组患者性别、年龄、BMI、吸烟史、高血压史、糖尿病史、高脂血症史、脑卒中史、陈旧性心肌梗死史比较,差异无统计学意义(P>0.05),见表2。

表2 两组患者基线资料Table 2 Baseline information of patients in both groups
2.2 两组患者联合治疗前和治疗后24、72 h 临床指标的比较 采用双因素重复测量方差分析比较两组患者联合治疗前和治疗后24、72 h 临床指标,结果显示,时间和组间对MAP、CI、Lac、cTnI 存在交互作用(P<0.05),时间和组间对GFR、BNP 不存在交互作用(P>0.05),时间对MAP、CI、GFR、Lac、cTnI、BNP 主效应显著(P<0.05),组间对CI、GFR 主效应显著(P<0.05),组间对MAP、Lac、cTnI、BNP 主效应不显著(P>0.05)。两组患者治疗后24、72 h 的MAP、CI、GFR 高于治疗前,Lac、cTnI、BNP 低于治疗前,差异有统计学意义(P<0.05),两组患者治疗后72 h 的CI 高于治疗后24 h,治疗后72 h 的Lac、cTnI、BNP 低于治疗后24 h,差异有统计学意义(P<0.05)。B 组患者治疗后24、72 h 的MAP、CI、GFR 高于A 组,Lac、cTnI 低于A 组,差异有统计学意义(P<0.05),见表3。

表3 两组患者联合治疗前和治疗后24、72 h 临床指标Table 3 Clinical indicators of patients in the two groups before,24 and 72 h after combined treatment
2.3 两组患者治疗情况的比较 两组患者罪犯血管占比、病变血管支数、AMI 类型、PCI 后TIMI 血流3 级比例、IABP-SHOCK Ⅱ评分、正性肌力药物、多巴胺使用比例、ICU 住院时间、联合辅助时间、间隔辅助时间、血制品输注比例和CRRT 比例比较,差异均无统计学意义(P>0.05),A 组去甲肾上腺素、间羟胺使用比例高于B 组,差异有统计学意义(P<0.05),见表4。
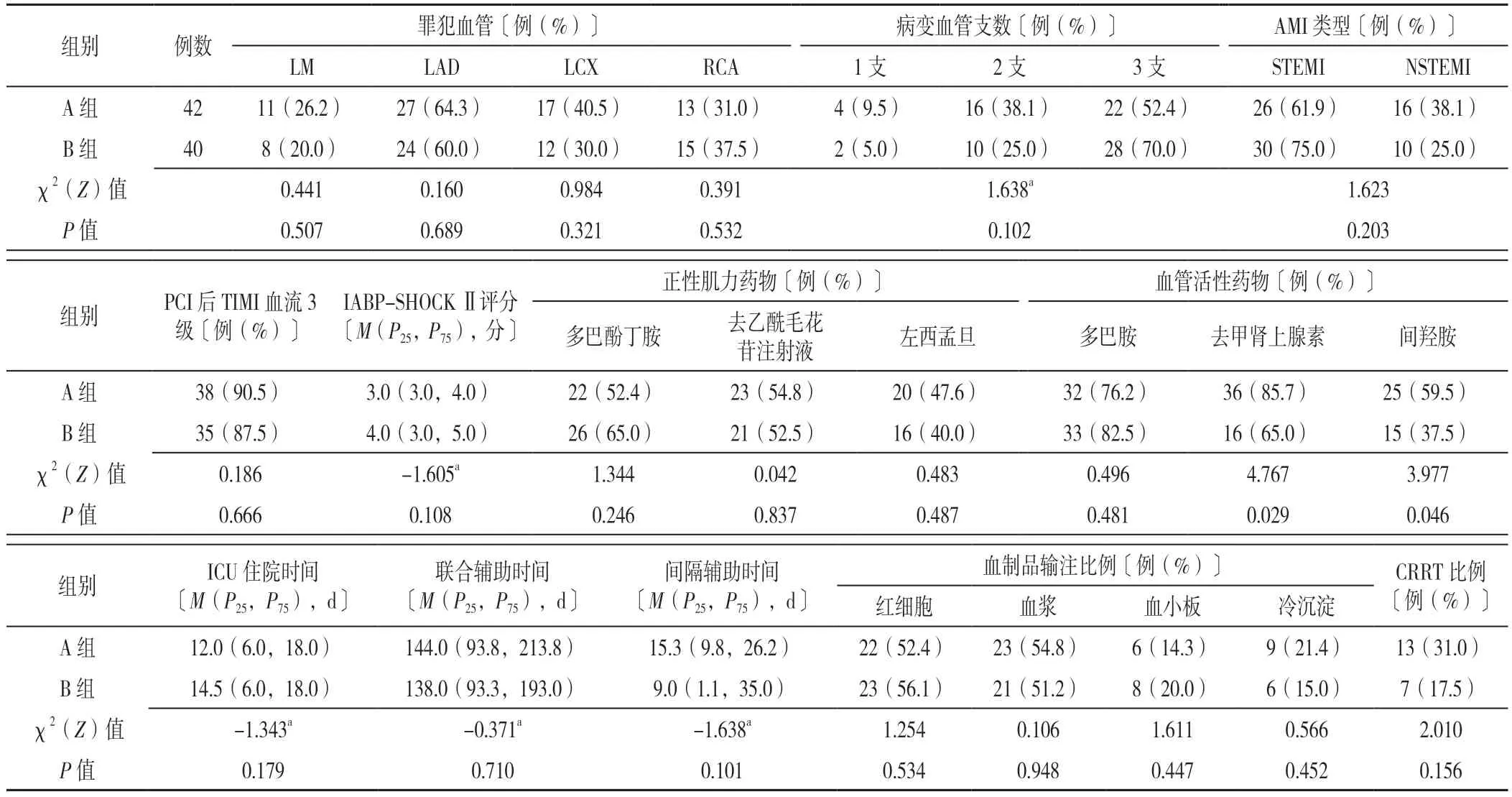
表4 两组患者治疗情况比较Table 4 Comparison of treatment between the two groups
2.4 两组患者相关并发症和预后比较 两组患者肺部感染、凝血功能障碍、消化道出血、下肢血栓、神经系统并发症、MODS 比例比较,差异无统计学意义(P>0.05)。A 组AKI 比例高于B 组,出院生存率低于B 组,差异有统计学意义(P<0.05),见表5。

表5 两组患者相关并发症和预后情况〔例(%)〕Table 5 Related complications and prognosis of patients in both groups
3 讨论
CS 是AMI 较危重的并发症之一,是心力衰竭的极期表现。相关指南将急诊PCI 作为AMI-CS 治疗的Ⅰ类推荐[9-10]。本研究患者均接受了急诊PCI 治疗,血运重建后TIMI 血流3 级比例占89.0%(73/82)。但有研究表明AMI-CS 的预后仍然令人不满意[11]。本研究AMI-CS 患者的住院病死率高达51.2%,可能是因为多支病变造成的大面积梗死、持续低灌注状态导致的MODS 以及PCI 后心肌缺血再灌注损伤、冠状动脉慢血流等[12]。因此尽早纠正组织低灌注状态、维持血流动力学稳定是治疗AMI-CS 的关键。
MCS 可以改善血流动力学状态和组织器官灌注情况,提高抢救成功率。但AMI-CS 患者心脏残存功能有限,微循环灌注差,单一的MCS 难以达到理想的效果。近年来不断有研究证实,相较于VA-ECMO 或IABP 单独辅助,二者联合辅助的治疗方式能够提供更加稳定的血流动力学,保障重要脏器的血流灌注[13-14]。IABP 以其降低左心室后负荷、提高冠状动脉灌注压和提供搏动性血流等独特优势,平衡了VA-ECMO 造成的左心室负荷过重、心肌耗氧量增加、微循环组织灌注不足等弊端[15];VA-ECMO 暂时替代部分或全部心脏泵血功能,降低IABP 对心脏收缩功能和节律的依赖程度,并通过调节流量提高重要器官的血流灌注,弥补了IABP 血流动力学支持效应不足的劣势[16]。二者相辅相成,能够明显提高循环支持,增强AMI-CS 的治疗效果。本研究结果显示,联合辅助治疗后,AMI-CS 患者血流动力学(MAP、CI)、肾功能(GFR)、组织灌注(Lac)、心功能(cTnI、BNP)均有显著改善,表明二者联合辅助后,不论顺序如何,均能发挥有效治疗作用。这与既往研究结果一致[17]。
本研究还发现,B 组在改善MAP、CI、GFR、Lac和cTnI 方面更具优势(P<0.05),原因可能与VAECMO 的及早应用有关。ECLS-SHOCK 试验[18]要求AMI-CS 患者尽早在血运重建之前应用VA-ECMO,而EURO-SHOCK 试验[19]提出应在血运重建后30 min内应用VA-ECMO,表明越早应用VA-ECMO 对AMICS 患者越有利。作为一种密闭的体外循环系统,VAECMO 血流灌注可达心输出量的50%~75%,可以主动代替心脏做功,实现部分或全部替代心脏功能[9,13]。本研究纳入的92.7%(76/82)的AMI-CS 患者合并多支病变,梗死面积大,心脏残存功能弱,因此在维持心输出量、保障重要器官氧供的前提下,减少心脏做功、降低心肌氧耗,使心肌得以充分休息,并尽早血运重建、恢复氧供是AMI-CS 患者获得生还机会的前提。在VAECMO 运用的基础上,同期或后期增加IABP 辅助,降低左心室后负荷,提高冠状动脉灌注压,使心脏在得以休养的基础上增加能量供应,从而具有更强的心泵支持力度。
二者联合辅助24、72 h后BNP较治疗前有逐步改善。心室负荷过重和室壁张力增大是BNP分泌的主要条件,因此IABP对于减轻心室负荷和室壁张力可能更有效[13]。但需要注意的是,IABP 充分发挥作用需要依赖于心脏本身残存的收缩功能和相对规整的节律,这对于急危重AMI-CS 患者来说常难以达到,因此先期IABP 对BNP的改善有限,这可能是两组BNP 在对应时间点没有显著差异的原因。
本研究结果显示,A 组AKI 的发生率高于B 组。其原因可能在于VA-ECMO 早期应用或VA-ECMO 与IABP 同期应用更有利于肾血流灌注。AKI 形成的机制是复杂的和多因素的,其中肾脏灌注不足是导致肾功能恶化的基本机制[20]。AMI-CS 常处于心输出量严重不足和组织低灌注状态,若不及时纠正,可使肾前性AKI迅速发展为肾性AKI,引起肾皮质坏死,从而导致患者肾功能的永久丧失[20]。本研究结果显示,联合辅助后,B 组血流动力学和心功能提升更显著,有利于肾血流灌注;同时B 组GFR 显著升高反映出肾缺血、缺氧情况得到改善。虽然A 组AKI 的发生率显著高于B 组,但两组CRRT 的治疗比例无统计学差异,可能与两组后期的治疗方式、电解质紊乱或液体超负荷有关[21-22]。另外,LIAO 等[23]研究显示VA-ECMO 期间使用高剂量的血管活性药物是AKI 的独立危险因素。本研究A 组高剂量血管收缩药物去甲肾上腺素和间羟胺的使用比例大于B 组。大剂量的血管活性药物可能导致肾血管损伤,从而影响肾血流灌注,这可能也是导致A 组AKI 发生率高于B 组的原因之一。
虽然临床实践和目前的研究均证实,VA-ECMO 和IABP 联合辅助对AMI-CS 患者具有良好的治疗效果,但能否改善其生存率还存在争议。TSAO 等[24]研究发现,与单独IABP 辅助相比,二者联合辅助治疗可以有效改善AMI-CS 患者1 年生存率,一项大型荟萃分析结果也支持了这一结果[25]。OVERTCHOUK 等[26]认为二者联合应用是AMI-CS 死亡率的独立保护因素。然而,PARK 等[27]研究却得出了相反的结论:二者联合对提高AMI-CS 患者生存率没有益处。另外一项系统性回顾性Meta 分析显示二者联合不能降低CS 或心搏骤停患者的住院死亡率[28]。CHENG 等[29]研究纳入了1 517 例CS 患者进行了系统综述,并没有发现联合辅助与预后之间的相关性。造成这种研究结果不一致性的原因可能是多方面的:基线疾病的差异、VA-ECMO 和IABP 联合顺序和干预措施(PCI 的有无及血管再通时间)不同等,因此可能存在潜在的异质性。本研究的创新点在于以下3 个方面。第一:选择特定的病例种类和病情轻重程度,纳入病例种类全部为AMI-CS 且Killip 分级≥Ⅲ级的患者;第二:统一干预措施,AMI-CS 患者均行急诊PCI 治疗,开通罪犯血管;第三:明确VA-ECMO和IABP 辅助的先后顺序。以上三项措施减少了异质性和混杂因素对试验结果造成的干扰,因此具有较好的可信度和可比性。本研究显示,A 组出院生存率低于B 组,这与既往研究一致[30]。在大多数研究中,IABP在VA-ECMO 之前使用,可能因为这些患者在基线时可能病情更重。应当注意的是,本研究纳入的AMI-CS 且Killip 分级≥Ⅲ级的患者本身病情危重,从早期IABP辅助升级到后期不得不置入VA-ECMO 稳定循环,可能表明心功能迅速恶化,这预示着更差的结局。相较于先IABP 后VA-ECMO 安装,先VA-ECMO 后IABP(或VA-ECMO 与IABP 同期安装)意味着ECMO 的使用更加积极,这可能是改善本研究AMI-CS 患者预后的主要原因。
本研究虽为多中心回顾性研究,但纳入样本量较小,且仅对出院生存率进行了统计,未对出院患者进行长期随访,因此研究结论未来仍需大样本量的前瞻性随机对照试验进一步证实,并随访远期预后,以提供更有价值的循证学依据。
综上所述,对于急危重AMI-CS患者,在PCI基础上,先VA-ECMO 辅助或VA-ECMO 与IABP 同期联合辅助可以提供更强的心肺支持,降低AKI 的发生风险,提高出院生存率,且不会增加其他并发症的发生率。因此对于此类患者,应该制订一个更快速的AMI-CS 管理策略,迅速干预,积极处理,及时辅以VA-ECMO 治疗,对提高治疗效果、改善AMI-CS 患者生存率具有重要意义。
作者贡献:崔晓娜设计研究方案,负责研究实施,进行资料收集、整理、撰写;冯瑞霞、韩雨澎、周瑶瑶进行研究评估与实施、资料收集;刘小军、李建朝进行质量控制及审校;刘小军对文章整体负责。
本文无利益冲突。
