广泛耐药铜绿假单胞菌肺炎大鼠模型的制备
2023-08-21刘奉云赵启亮蔡文欣孙宏源陈明虎尹延重张慧琪
安 然,刘奉云,赵启亮,蔡文欣,孙宏源,陈明虎,常 力,尹延重,刘 凯,张慧琪,刘 旻
(1.天津中医药大学第一附属医院感染疾病科,天津 300193;2.国家中医针灸临床医学研究中心,天津 300193;3.天津中医药大学,天津 301617)
铜绿假单胞菌(Pseudomonas aeruginosa,P.aeruginosa,PA)是医院获得性肺炎和呼吸机相关性肺炎的常见致病菌[1,2]。PA 具有易定植、易变异、多耐药的特点,其耐药机制复杂[3],容易产生超级细菌,造成难以治疗的感染。有研究表明耐药PA 感染比不耐药PA 感染患者死亡风险增加24%,多重耐药PA 感染者比敏感PA 感染者住院死亡风险增加2 倍以上[4]。广泛耐药PA(Extensively drug-resistant PA,XDR-PA)是临床常见的PA 耐药类型,其导致的肺炎病情重、病程长、病死率高,抗生素选择严重受限,为临床治疗带来极大困难,加重了社会经济负担。构建XDR-PA 肺炎动物模型是研究其耐药机制、测试新型抗生素临床疗效的重要环节。本研究拟在前期预实验基础上,进一步比较不同菌量(低、中、高)所致肺炎大鼠肺部病理学特征,最后确立最佳的XDR-PA 肺炎模型。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性SPF 级SD 大鼠,体重(160±10)g,购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2019-0008。所有动物适应性饲养5 d,饲养条件:室内温度(24±1)℃、相对湿度55%±10%和12 h 明暗循环。
1.1.2 主要试剂与仪器 XDR - PA 菌株(210608091)来源于临床痰液标本,由天津中医药大学第一附属医院检验科微生物实验室分离、纯化,使用基质辅助激光解吸电离-飞行时间质谱法(Vitek MS 系统,bioMérieux)鉴定该菌株为铜绿假单胞菌,利用viteck2-compact(bioMérieux)全自动细菌鉴定药敏分析仪进行药敏测定。将菌株送往北京美优安诺生物科技有限公司进行测序分析,经16SrDNA 分子生物学鉴定为铜绿假单胞菌,与铜绿假单胞菌(Pseudomonas aeruginosastrain)JCM 5962 MK796437.1 同源性为100%。哥伦比亚血平板(广东环凯微生物科技有限公司,批号:M2357 Y),伊红染液(北京中杉金桥生物科技有限公司,批号:ZLI-9613),苏木素染液(北京中杉金桥生物科技有限公司,批号:ZLI-9610),酸性乙醇分化液(源叶生物,批号:R20777)。
比浊仪(梅里埃 DensiCHEK Plus),恒温箱(上海一恒,型号:DHP9121B),双功能气浴恒温振荡器(常州金坛旭日实验仪器厂,型号:ZD-85),离心机(北京北利,型号:DT5-3),脱水机(徕卡仪器有限公司,型号:LEiCA TP -1020),病理切片机(徕卡仪器有限公司,型号:LEiCA HistoCore MULTICUT),包埋机(金华市华速科技有限公司,型号:ES500-1),冻台(金华市华速科技有限公司,ES500-2C),组织摊片机(金华市华速科技有限公司,型号:ES500-3H),烤箱(上海一恒仪器有限公司,型号:BPG-9106A),显微镜(OLYMPUS,型号:OLYMPUS CKX43-LP),组织研磨仪(武汉塞维尔生物科技有限公司,型号:KZ-Ⅲ-F),全景扫片仪(3DHIS TECH)。
1.2 方法
1.2.1 菌悬液制备 从-80 ℃冰箱中取出XDRPA 菌株常温解冻,用一次性无菌接种环转种于血平板,分区划线以分离单菌落,倒置于恒温箱孵育培养,37 ℃,18~24 h,可见圆形、扁平湿润、边缘不规则、有特殊生姜味的灰绿色菌落,周围有透明溶血环,染色镜检为革兰阴性杆菌。挑选单菌落转种营养肉汤,摇床37 ℃过夜,转速200 r/min。观察肉汤均匀浑浊,离心(2 500 r/min)10 min,去上清液,留底层菌体,加入适量无菌生理盐水,冲洗混匀,再次离心(2 500 r/min)10 min,去上清液,加入适量无菌生理盐水制备菌悬液,此为原始菌液。吹打混匀后吸取少量原始菌液作为样品,样品倍比稀释后经比浊仪检测确定稀释液浓度,再乘以稀释倍数推算出原始菌液浓度,最后经换算后倍比稀释,配制出低、中、高3 种浓度菌悬液备用:7.5×109CFU/mL(低)、3×1010CFU/mL(中)、6×1010CFU/mL(高)。
1.2.2 分组及造模 SPF 级SD 大鼠24 只,随机分为4 组,分别为空白组、低菌量组、中菌量组、高菌量组。大鼠称重,腹腔注射戊巴比妥钠(30 mg/kg),麻醉后将大鼠仰卧位置于动物手术台,固定头部和四肢,抬高鼠板头端,与操作台面成30°角,剃除颈部体毛,暴露颈部皮肤,沿气管走行部位对皮肤进行局部消毒,随后于颈前正中纵向切开皮肤及皮下组织,钝性分离直至暴露气管,用1 mL 注射器抽吸XDR-PA 菌悬液0.1 mL,在直视下,针头朝向下气道方向,倾斜30 °刺入两软骨环之间,缓慢注入菌液,接种后立即拔出针头,使大鼠保持直立体位30 s,并左右旋转,使菌液均匀分布至两侧肺部,后立刻利用肌肉层封闭给药穿孔,随后缝合处理颈部切口,消毒,置头稍高位。待麻醉苏醒后,放开大鼠回到鼠笼,自由活动,给予水和饲料。低菌量组、中菌量组、高菌量组分别气管注射0.1 mL 浓度为7.5×109CFU/mL、3×1010CFU/mL、6×1010CFU/mL的菌悬液,接种量分别为7.5×108CFU、3×109CFU、6×109CFU;空白组气管注射0.1 mL 无菌生理盐水。
1.3 观察指标
1.3.1 大鼠一般状态 造模后观察各组大鼠精神状态、毛发、呼吸、活动、进食、体重等一般情况,观察大鼠有无死亡并记录死亡时间绘制生存曲线。
1.3.2 肺组织病理学特征 无菌操作打开胸腔,观察肺组织大体的病理变化情况,查看肺部体积的大小及颜色、质地的变化,观察肺组织表面是否有出血点、结节、实变等改变。取左肺组织于4%多聚甲醛溶液中固定72 h 以上,经脱水、包埋、切片、HE 染色,数字病理切片扫描成像系统观察肺组织病理学的变化。
1.3.3 肺组织细菌学鉴定 分离右肺下叶肺组织,称取一定量的肺组织(50~70 mg),加入10 倍体积无菌生理盐水在组织研磨仪中进行研磨,低温匀浆,取100 μL 匀浆液用一次性无菌涂布棒均匀涂布于血平板,将涂好的血平板放入37 ℃恒温培养箱中孵育18~24 h,观察血平板上菌落的生长情况,并进行细菌学鉴定。
1.4 大鼠XDR-PA 肺炎模型的鉴定
根据PA 肺炎大鼠的临床表现、肺组织病理学特征、肺组织细菌学鉴定结果,结合“主要研究者、病理学专家、微生物学专家”评价意见,达成共识,鉴定大鼠XDR-PA 肺炎模型构建成功。
1.5 统计学处理
用Kaplan-Meier 法进行统计分析,比较各组大鼠生存曲线是否一致,P<0.05 表示差异有统计学意义。
2 结果
2.1 大鼠一般状态
空白组大鼠精神活跃,反应灵敏,毛发光泽,造模后第一天体重稍有减轻,随后体重逐渐增加(图1B)。低、中、高菌量组大鼠精神萎靡,蜷缩于鼠笼一侧,毛发竖立无光泽,对外界刺激反应迟缓,逃避行为减少,双侧胸廓起伏大,呼吸频率加快,部分伴有呼吸杂音,口鼻及目内眦出血,进食减少,体重明显减轻,2~3 d 后体重逐渐增加,48 h 内出现不同程度的死亡(图1,表1)。4 组组间比较,生存时间总体分布存在统计学差异,Logrankχ2=8.248,P<0.05。

表1 造模48 h 内各组动物死亡情况(n=6)Tab 1 Death of animals of each group within 48 h of modeling(n=6)
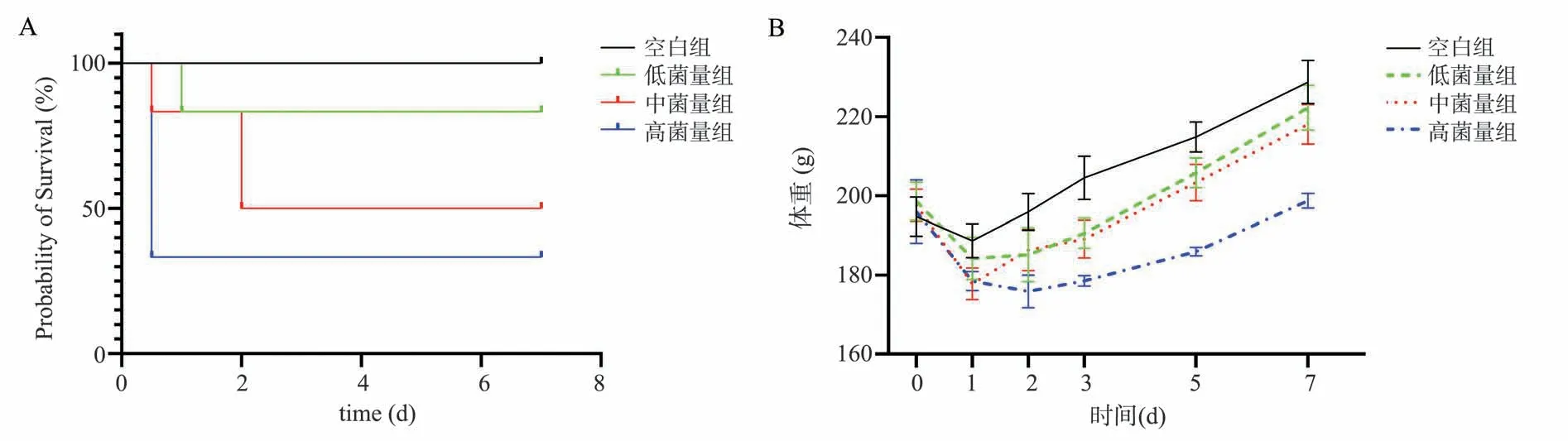
图1 XDR-PA 肺炎大鼠的生存曲线和体重变化Fig 1 Survival curve and body weight change of XDR-PA pneumonia rats
2.2 肺组织病理学观察
肉眼观察,空白组大鼠肺叶呈淡粉色,体积不大,无明显充血水肿;低、中、高菌量组大鼠肺体积增大,重量增加,组织充血,可见散在出血点,高菌量组组织充血、出血严重,部分肺叶实变。如图2 所示,镜下观察可见空白组大鼠肺泡结构完整,肺泡腔清晰无渗出,肺泡间隔稍有增厚;低、中菌量组细支气管腔内、细支气管及血管周围有较多炎性细胞浸润,肺泡腔内可见浆液性渗出及炎细胞,肺泡结构破坏,局灶有肺泡膨胀不全或肺泡塌陷、融合,肺泡间隔增厚,肺间质充血、水肿;高菌量组细支气管腔内可见炎性分泌物及炎症细胞,肺泡壁毛细血管扩张、充血,肺泡腔内有红细胞及大量纤维素样渗出,部分肺泡腔可见大量炎性细胞渗出。
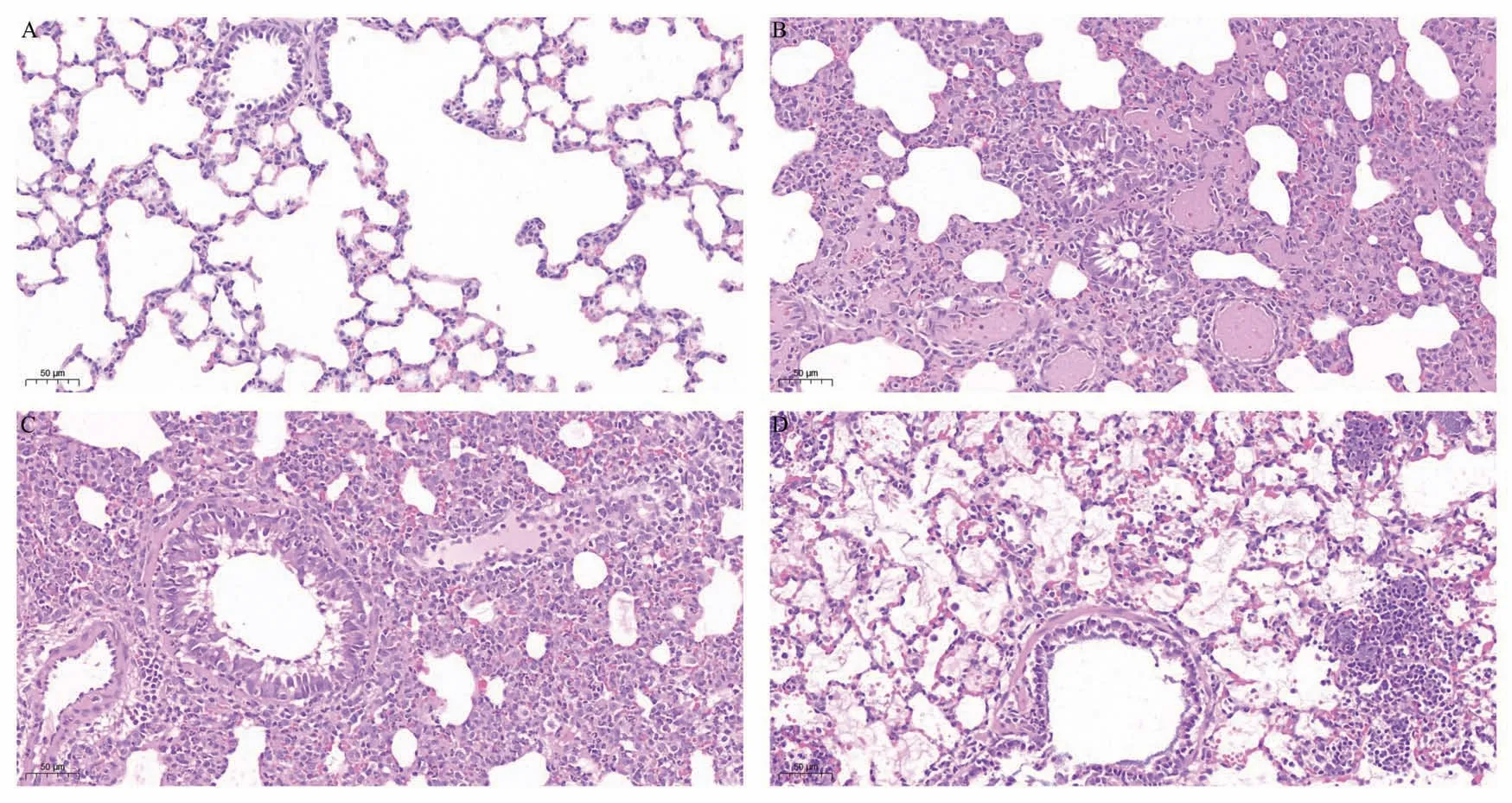
图2 各组大鼠肺组织病理切片(HE 染色,200×)Fig 2 Pathological sections of lung tissue in each group(HE,200×)
2.3 各组病原学鉴定
采用组织匀浆法和细菌培养法结合,对各组进行病原学鉴定。结果如图3 所示:低、中、高菌量组肺组织匀浆培养均可见扁平湿润、有金属光泽的菌落生长,空白组无PA 菌落生长。
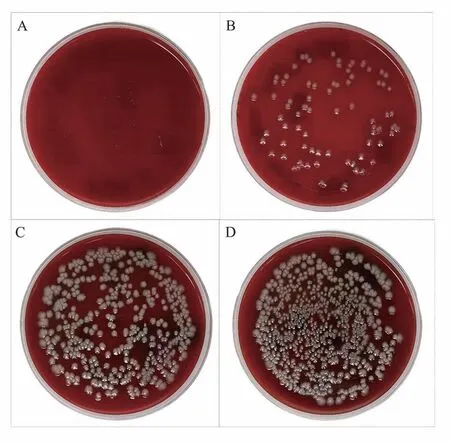
图3 各组大鼠肺组织匀浆菌培养结果Fig 3 Results of homogenate culture in lung tissue of rats in each group
3 讨论
PA 肺炎动物模型尚无统一的建立标准。根据文献报道,可用的实验动物有小鼠、大鼠、豚鼠、兔、猪等,其中使用最为广泛的是啮齿类动物。SD 大鼠体型较大,易于操作、取材,对于细菌感染耐受性较好,死亡率较低,容易饲养,且价格低廉[5,6],目前国内PA 肺炎相关动物实验研究中应用最多的即为SD 大鼠[7-10],所以本实验也选用SD 大鼠作为建模动物。造模用的实验菌株既有铜绿假单胞菌标准菌株,也有临床分离株,但关于XDR-PA 肺炎动物模型的研究较少,且使用的菌株多是从临床分离得到的[11-13],微生物学特性和流行特点尚不明确。常用的造模方法有气管内滴注法[14]、气管插管注射法[15]、细菌包被体雾化吸入法[16]和滴鼻法[17]。这些方法各有利弊,通过前期预实验多次操作尝试,我们选择了气管内滴注法造模,其优点是保证菌液进入下呼吸道的剂量具有可控性。
引发肺炎的微生物接种剂量是存在阈值的,阈值范围内没有打破微生物和宿主之间的生物平衡,无法引发肺炎,快速大规模的细菌入侵(超过阈值)突破呼吸道宿主防御系统可能诱发肺炎[18]。PA 肺炎模型建立过程中滴注菌液的浓度尚无统一标准,文献报道多在108~1010CFU/mL[7,19-23]之间,研究人员需要考虑菌株毒力和实验动物品系差异的影响,并进行预实验尝试以摸索能够引发肺炎的合适菌量。不同PA 菌株致病力不同。PA 可分泌大量的毒力因子,包括脂多糖、鼠李糖脂、外毒素A、蛋白酶、生物膜和Ⅲ型分泌系统(type 3 secretion system,T3SS)等,其中T3SS 与致病性高度相关[24]。T3SS 具有针管样结构,向宿主细胞注入ExoU,ExoT,ExoS 和ExoY 四种毒性效应蛋白,它们在不同的菌株中表达不同[25,26]。在急性呼吸道感染中,表达功能性T3SS 并分泌毒素的菌株会在肺部持续存在,导致更高的复发率、细菌负荷和死亡率[27]。不同实验动物对PA 的免疫清除能力不同。研究者筛选了九种不同的近交小鼠品系,观察它们对PA的遗传易感性,结果显示,A/J、129S2/SvPasCRL和DBA/2J 小鼠对PA 高度易感,较其余小鼠肺组织细菌载量更高,在感染48 h 内死亡,平均存活时间约为1 d[28]。相关研究[29]表明DBA/2 小鼠在对PA 定植的早期免疫防御方面存在缺陷,影响肺部细菌清除。
为了研究中医药或西药抗菌药物对XDR-PA肺炎的治疗效果,需要选用合适的PA 菌量制备XDR-PA 肺炎动物模型。前期预实验共测试了8 个不同的菌浓度(3×108CFU/mL、6×108CFU/mL、9×108CFU/mL、1.2×109CFU/mL、7.5×109CFU/mL、3×1010CFU/mL、6×1010CFU/mL、1×1011CFU/mL),当注射菌浓度达到109CFU/mL时,大鼠造模后开始出现倦怠少动、竖毛、呼吸急促的表现,菌液浓度达到1010CFU/mL 时,大鼠精神萎靡,弓背竖毛,呼吸急促,胸廓起伏明显,进食及体重下降明显,并出现死亡情况,当菌液浓度达到1011CFU/mL 时,大鼠精神状态极差,闭眼,蜷缩不动呈濒死状态,在短时间(12 h)内全部死亡。在综合考虑造模后临床表现、死亡率及病理学观察结果的基础上,确立了低、中、高3 个菌量:7.5×109CFU/mL、3×1010CFU/mL、6×1010CFU/mL 的菌悬液气管滴注0.1 mL 进行本次实验研究,以进一步确立最佳的菌浓度/菌量,从而制备符合本次研究目的、符合病理特征的大鼠肺炎动物模型。
肺炎模型的评价指标通常包括:临床表现、微生物学、肺组织病理学、肺部影像学、血常规、细胞因子等[30-38]。在众多指标中,组织病理学一直是评估肺部感染实验中动物组织形态学变化的强大、可靠且可重复的指标[39-41],是评估肺部炎症的金标准[32]。在预实验中多次尝试模拟临床,以影像学(肺部CT)检查来诊断大鼠PA 肺炎。但高菌量组大鼠在濒死状态时才可看到双肺斑片状实变影,后经解剖探查,肉眼可见肺组织出血性改变,并非细菌性肺炎特征;其余低、中菌量组均未见到肺炎CT征象,但其肺组织病理学染色(HE)均有不同程度肺部炎症浸润表现。预实验结果表明影像学不适合作为模型成功的判定标准,推测其原因可能与大鼠气道固有免疫清除细菌能力较强有关系,中、低菌量不容易在影像学上表现为肺炎,而过高的菌量超过大鼠自身固有免疫清除能力,又会快速脓毒症休克死亡。结合国内外文献,多以肺部炎性损伤的典型病理学特征表现作为肺炎模型判定依据,确立XDR-PA 肺炎大鼠模型判定标准为:肺炎的典型临床表现、病理学特征及病原学鉴定。
本研究结果显示:空白组一般状态(精神、活动、进食、呼吸等)均正常,其他各组,随着菌量增加、症状更重更显著,有不同程度的精神萎靡,竖毛,呼吸急促,进食及活动减少,体重减轻,高菌量组多数有口鼻出血,甚至死亡。病理学结果显示,空白组大鼠肺泡结构完整,肺泡腔清晰无渗出;低、中菌量组肺组织均出现明显炎症细胞浸润,肺泡结构破坏,肺泡间隔增厚,间质水肿,但中菌量组病理损伤更重,死亡率高达50%,低菌量组死亡率为17%;高菌量组肺泡腔内可见红细胞、炎症细胞及大量纤维素样渗出,有急性呼吸衰竭的病理学特征,死亡率高达67%。病原学鉴定结果显示空白组无细菌繁殖,低、中、高菌量组均可见XDR-PA 菌落生长。本课题组认为低菌量组既有肺炎的典型临床表现和病理学特征,又能保证死亡率低,有充分的治疗时间窗来观察药物对大鼠XDR-PA 肺炎的治疗效果,是符合后期实验研究需求的最佳肺炎模型。本研究是一个初步探索性研究,仍存在不足之处,每组实验动物样本量较少,且XDR-PA 动物肺炎和人类肺炎的临床特征和病理学演变特征仍存在一定差异性,今后有必要选择更合适的动物开展大样本基础研究。
作者贡献度说明:
安然:实验设计及实施、整理数据、统计分析、论文撰写;刘奉云、赵启亮:部分数据处理及图片制作;蔡文欣:参与动物造模、取材;孙宏源、陈明虎:对实验技术提供指导;常力、尹延重、刘凯:数据分析、行文建议;张慧琪老师、刘旻老师:指导实验设计、审阅并修改论文。
所有作者声明不存在利益冲突关系。
