托法替布联合皮内针治疗类风湿性关节炎的疗效研究*
2023-08-21荣晓凤
杨 威,荣晓凤
(重庆医科大学附属第一医院中西医结合科,重庆 400016)
类风湿性关节炎(rheumatoid arthritis,RA)是一种以滑膜炎为病理特点的全身性自身免疫性疾病,常侵犯机体小关节,炎症持续发展可导致关节破坏、畸形、脱位甚至功能丧失,临床致残率较高,严重影响患者生活质量。研究调查,我国发病率约为0.42%[1],目前无法根治,但大多数可临床控制和缓解。
目前,针对RA的主要治疗药物有非甾体抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDs)、改善病情类抗风湿药(disease modifying anti-rheumatic drugs,DMARDs)、激素、植物类药物、生物制剂及其他小分子靶向药物。近年来,因生物制剂、靶向药物和生物制剂仿制药发展迅猛,疗效快速且突出,常被用于RA的一线或二线联合治疗,尤其是对于传统DMARDs反应不佳或无法耐受的RA患者,指南推荐选择合适的生物制剂DMARDs或靶向药物[2]。
枸橼酸托法替布(简称托法替布)是第一个有效治疗RA的口服Janus激酶(Janus kinase,JAK)抑制剂,国内外大量研究显示,其在RA的治疗中展示出满意的疗效。但国内仿研托法替布使用时间不足5年,缺乏真实世界临床研究数据;同时生物制剂的最佳适应人群、选择使用时机也欠规范。皮内针具有良好的抗炎、镇痛、免疫调节作用,常用于风湿性疾病。作者应用仿研托法替布治疗RA已有300余例患者,临床也常使用皮内针协同缓减患者关节痛,因此本研究回顾性分析2020年1月至2021年12月住院和门诊RA患者临床资料150例,总结分析疗效以供临床参考。
1 资料与方法
1.1 一般资料
选取2020年1月至2021年12月在重庆医科大学附属第一医院中西医结合科确诊为RA的住院及门诊患者150例作为研究对象。所有受试者资料完整,根据治疗方式不同,分为A组51例,B组50例,C组49例。纳入标准:(1)所有患者均达到2010年美国风湿病学会(American college of rheumatology,ACR)和欧洲抗风湿病联盟(European league against rheumatism,EULAR)RA分类标准,确诊为RA;(2)连续使用托法替布+DMARDs+皮内针、DMARDs+皮内针、DMARDs治疗且疗程满3个月的RA患者;(3)临床资料完整。排除标准:未持续用药3个月以上患者,临床数据资料不完整的RA患者。本研究通过医院伦理委员会批准,患者均知情同意。
1.2 方法
A组患者接受托法替布(齐鲁制药有限公司,批准文号:国药准字H20193295)5 mg口服,2次/d和皮内针(苏州医疗用品厂有限公司)治疗,根据病情可单药或联合DMARDs药物,如氨甲蝶呤(7.5~10.0 mg,每周1次)和(或)来氟米特治疗;B组患者在DMARDs基础疗法上加用皮内针治疗,主穴:合谷、足三里、三阴交、阿是穴。留针24 h,隔天1次,8~10 d为1个疗程,共治疗3个疗程。C组所有患者接受单纯DMARDs药物治疗。
1.2.1实验室指标检测
分析3组RA患者基线一般资料及治疗前后的血常规、肝功能、肾功能、C-反应蛋白(C-reactive protein,CRP)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、类风湿因子(rheumatoid factor,RF)、抗环瓜氨酸肽抗体(anti-cyclic citrullinated peptide antibody,ACPA),视觉模拟量表(visual analogue scale,VAS,0~100 mm目测模拟评分)、28个关节疾病活动度(disease activity score-28,DAS-28)评分、压痛关节数(tender joint count,TJC)、肿胀关节数(swollen joint count,SJC)等指标。以VAS、DAS-28评分,以及ESR、CRP等指标中至少3项有20%的改善为标准,统计患者的ACR20反应率。
1.2.2安全性评估
分析总结各组用药期间血常规、肝功能、肾功能与不良反应等情况。
1.3 统计学处理
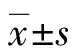
2 结 果
2.1 3组患者一般资料比较
A组患者发病年龄为(51.86±11.69)岁;B组患者发病年龄为(52.08±12.15)岁;C组患者发病年龄为(52.41±11.85)岁。3组患者年龄、性别、病程无明显差异(P>0.05)。治疗前,A组DAS-28评分,CRP、ESR、ACPA指标均高于B、C组,差异有统计学意义(P<0.05)。A组中既往使用过肿瘤坏死因子(tumor necrosis factor,TNF)抑制剂治疗不佳后调整为托法替布者有3例。B、C组DAS-28,VAS,以及CRP,ESR,RF,ACPA,TJC,SJC等指标比较,差异无统计学意义(P>0.05),见表1。

表1 3组患者一般资料比较
2.2 3组治疗前、后6项指标比较
治疗1个月后,A组患者DAS-28、VAS,以及CRP、ESR、TJC、SJC较治疗前明显下降(P<0.05),B、C两组上述指标与治疗前比较差异无统计学意义(P>0.05)。治疗3个月后,3组患者DAS-28、VAS,以及ESR、CRP、RF、TJC、SJC均较治疗前明显下降(P<0.05);B组患者DAS-28评分、ESR、ACPA、TJC均较C组下降,差异有统计学意义(P<0.05);B组患者VAS、CRP、SJC较C组下降,但差异无统计学意义(P>0.05),见表2。

表2 3组治疗前、后6项指标比较
2.3 3组治疗后ACR20反应率比较
治疗2周后,A组ACR20反应率为37.26%(19/51),明显高于B组的26.00%(13/50)和C组的12.25%(6/49),差异有统计学意义(P<0.05)。治疗3个月后,A组患者ACR20反应率为68.63%(35/51),明显高于B组的46.00%(23/50)和C组的30.61%(15/49),且B组明显高于C组,差异有统计学意义(P<0.05)。
2.4 3组治疗后RF、ACPA变化情况
治疗3个月后,3组患者RF滴度均较治疗前明显下降(P<0.05)。治疗3个月后A、B组ACPA水平明显下降,B组ACPA水平较C组明显下降,差异有统计学意义(P<0.05);C组患者治疗后ACPA无明显下降,差异无统计学意义(P>0.05),见表3。

表3 3组治疗后RF、ACPA变化情况[M(Q1,Q3)]
2.5 3组安全性及不良反应情况比较
治疗3个月后,A组仅有1例(1.96%)患者出现肝酶轻度升高;B组出现1例(2.00%)白细胞减少;C组有5例(10.21%)出现恶心、呕吐、肝酶异常,6例(12.25%)出现白细胞减少。未加用皮内针的C组药物不良反应率(22.45%)明显高于其他两组(P<0.05)。3组均未发现过敏反应、血栓、肿瘤、严重感染等不良反应,见表4。
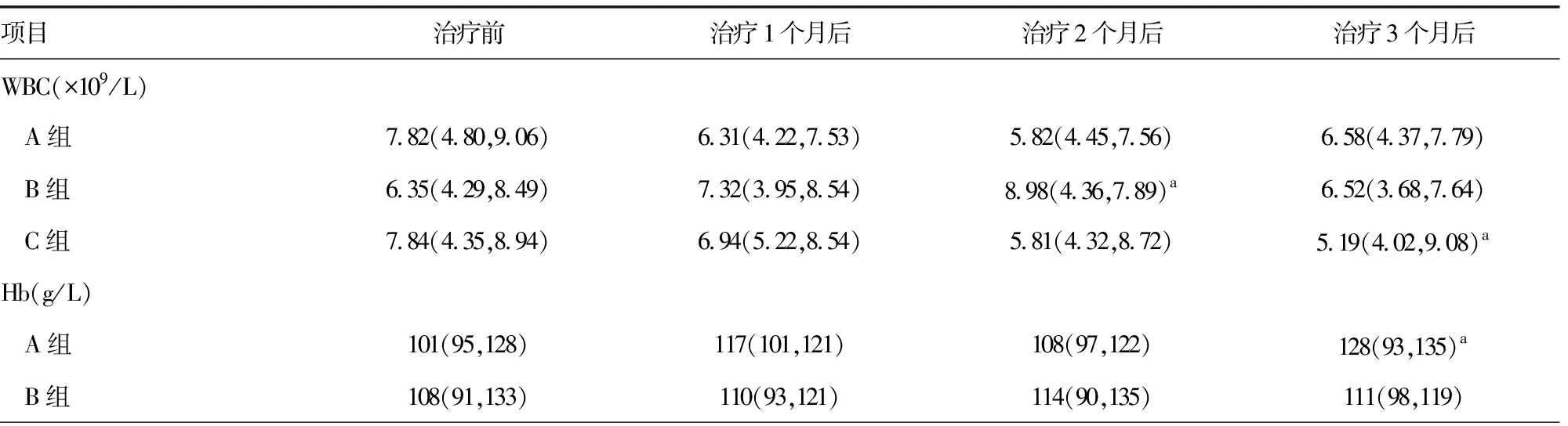
表4 3组血常规、肝肾功能指标变化情况[M(Q1,Q3)]
3 讨 论
RA的病因、发病机制仍未完全明确,可能与遗传、基因、环境等多种因素相互作用有关[3]。细胞因子在RA的发生、发展和病理过程中起着核心作用,各细胞因子之间可形成复杂的网络,最终可导致滑膜炎、滑膜增生及机体免疫功能失衡[4]。JAK可与信号传导及转录激活蛋白(STAT)形成JAK-STAT通路,在机体免疫调节、细胞增殖、凋亡中起着极为重要的作用。研究发现,JAK-STAT通路在RA患者部分滑膜组织中高表达,抑制该通路,RA患者的关节症状可明显缓解,炎症指标可明显下降[5]。托法替布可靶向JAK-STAT通路,抑制下游炎性细胞因子及介质的释放和合成,从而对RA起治疗作用[5]。多项研究表明,托法替布对RA的治疗显示出满意的疗效,具有良好的长期疗效[6-10]。
EULAR指南指出,对于第一种DMARDs治疗未达标并伴有不良预后因素的患者,可加用生物制剂或小分子靶向药物(如托法替布),且两种治疗方案的平均疗效相当[2,8]。多项随机对照研究提示,托法替布单药或联合DMARDs对RA均表现出了快速且持续的疗效[11-12]。研究证明,TNF-α抑制剂(TNFi)对氨甲蝶呤反应不足的患者有效[13]。托法替布与阿达木单抗的应用疗效大致相同[14],且托法替布为口服制剂,保存及携带较为方便,患者的依从性较好。
中医药具有双向免疫调节作用,尤其针灸疗法,具有良好的抗炎、镇痛和免疫调节,在风湿免疫疾病的治疗中具有重要地位。《灵枢·九针十二》:“凡用针者,虚则实之,满则泄之,宛陈则除之,邪胜则虚之”,概括说明了针刺的治疗原则。针刺疗法具有疏通经络、平衡阴阳、调理营卫的作用,国内外大量研究提示其在关节炎、疼痛的治疗方面疗效值得肯定[15-17]。皮内针是一种小型特定的针具,由浅刺和留针相结合发展而来,结合了皮部理论和腧穴理论,具有操作简便、疗效显确、安全无痛且可动态留针等特点,其针尖埋藏于皮下组织,对多种免疫反应进行调控,从而调节患者机体免疫功能,在治疗风湿性疾病尤其是慢性疼痛方面颇有优势[18-19]。
国内研发的托法替布上市时间较短,有关其真实世界研究数据非常有限,本研究回顾性分析了使用不同治疗方案的RA患者临床资料,结果提示联合应用托法替布治疗的患者RF、ACPA等指标明显增高,疾病处于高活动度,治疗2周即可明显提高ACR20反应率,治疗3个月后ACR20反应率比例更高,而其治疗1个月后DAS-28评分、VAS、CRP等指标明显下降。因此,建议高疾病活动度的RA患者,早期使用生物制剂或靶向合成DMARDs进行治疗,可迅速控制炎症,提高临床缓解率,这与国外文献报道和指南推荐意见一致[2,20-22]。DMARDs联合应用皮内针在改善RA患者DAS-28评分,降低ACPA、RF水平等有协同作用,并可提高RA患者治疗3个月后的ACR20反应率,说明加用皮内针可在一定程度上减轻患者关节疼痛、提高临床疗效。刘小飞等[16]也有报道皮内针联合DMARDs可有效治疗RA,改善患者关节症状,可能与皮内针调节免疫、抗炎镇痛的机制有关。加用皮内针治疗的RA患者药物不良反应发生率较低,说明皮内针有减轻抗风湿药药物不良反应的优势,考虑与皮内针具有调理脏腑气机、促进经络气血运行的作用有关[23]。
托法替布常见的不良反应为感染、头痛、带状疱疹再激活等[24]。本资料分析仅有1例肝酶轻度升高的患者,予以对症保肝后,恢复正常,未发现严重不良事件。但长程使用后导致的感染、静脉血栓等风险发生率有待进一步研究。
本研究也存在某些不足:(1)本研究为回顾性研究单中心研究,受用药情况复杂性、临床资料完整性等影响,符合筛选要求的病例数相对较少、随访时间较短,可能会影响疗效及不良反应的统计;(2)本研究中托法替布和皮内针为联合应用方案,未设置对照组比较未联合应用皮内针的疗效,故皮内针在本研究中协同托法替布的效果,需要进一步证实;(3)因评估随访时间短,疗效评估未纳入患者关节的影像学资料、机体免疫功能监测等资料,对RA患者关节结构的改善评估和药物效应机制未作深入探讨,有待下一步完成。
综上所述,根据病情使用不同治疗方案分组回顾性分析RA患者临床资料提示,疾病活动度高的RA患者,建议早期使用生物制剂DMARDs或靶向合成DMARDs,可使患者尽早诱导缓解,改善关节症状、提高生活质量。托法替布可明显降低RA患者DAS-28评分、CRP、ESR、RF、ACPA等指标,起效快速,疗效肯定,可明显提高ACR20反应率。联合中医皮内针疗法可在一定程度协同DMARDs疗效并降低药物不良反应。
