巨大卵巢恶性Brenner肿瘤合并胸腹水1例及文献回顾
2023-08-21宋诚王纪田石拴霞冯淑娴
宋诚,王纪田,石拴霞,冯淑娴
Brenner肿瘤是一种纤维上皮性卵巢肿瘤,其特征是由纤维基质包围的移行样上皮细胞巢。世界卫生组织根据增殖和侵袭性将其分为良性、交界性和恶性。恶性Brenner肿瘤(malignant Brenner tumors,MBT)因临床上极为罕见而容易被误诊,且预后较差,治疗困难[1]。目前治疗主要以外科手术为主,化疗仍有争议。现回顾性分析我院收治的1例72岁巨大卵巢MBT合并胸腹水患者的临床资料,同时查阅文献,探讨MBT的可能发病机制、临床病理特征和治疗选择。以期提高对卵巢MBT的认识,减少误诊误治。
1 病例资料
女性,72岁,因“腹部包块7月,腹胀不适伴心慌、胸闷、气短1周”收入我院。近1周自觉腹部包块增大,活动后感心慌、胸闷,呼吸困难。外院腹部超声提示“盆腔内囊实性占位,大小为3.5 cm×12.3 cm×17.5 cm,内透声差,多条光带分隔,盆腔积液(大量)”。入院查体:双肺呼吸音减弱,右侧为著。腹膨隆,全腹触及大小约24 cm×16 cm的包块,形态不规则,质中,活动欠佳,无压痛。入院后全腹CT提示“盆腔巨大囊实性密度影,以囊性密度为主,较大层面截面大小为235.60 mm×180.31 mm,其内可见分隔,多考虑右侧卵巢来源的恶性肿瘤性病变,黏液性囊腺瘤/癌?(见下页图1)”。胸部CT提示“右侧胸腔积液深度64.61 mm,右肺下叶局部肺组织膨胀不全(见下页图2)”。肿瘤标志物:糖类抗原125(carbohydrate antigen 125,CA125):576.7 U/mL、癌胚抗原(carcinoembryonic antigen,CEA):81.73 ng/mL、糖类抗原199(carbohydrate antigen 199,CA199)>12 000.0 U/mL、甲胎蛋白(alpha fetoprotein,AFP)3.50 μg/L、鳞状细胞癌相关抗原(squamous cell carcinoma antigen,SCC):14.2 ng/mL。初步诊断:盆腔恶性肿瘤,卵巢黏液性囊腺癌?
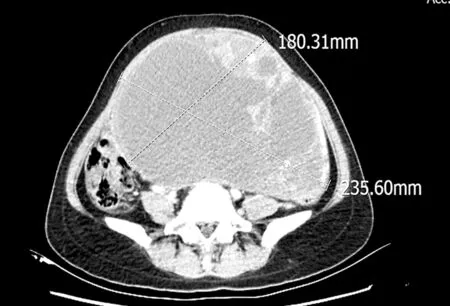
图1 盆腔CT:盆腔巨大多房囊实性肿块影,实性成分及分隔呈渐进性明显强化
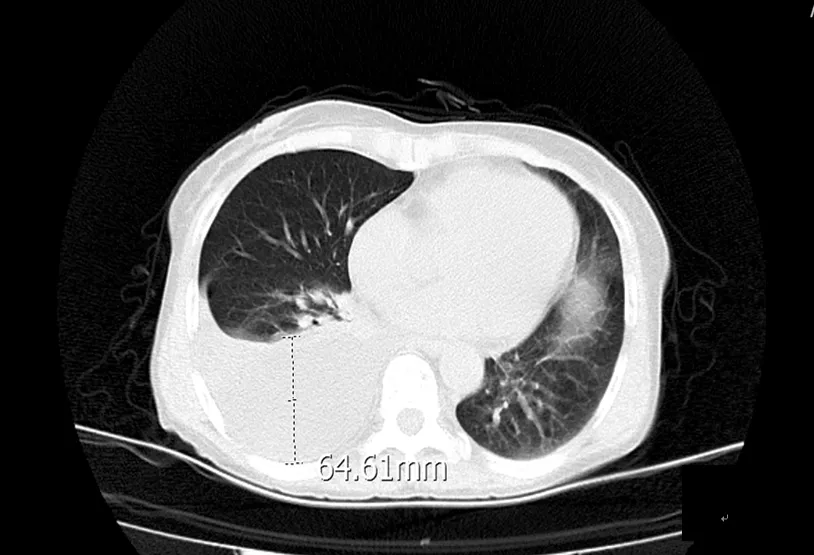
图2 胸部CT:右侧胸腔内见液性密度影积聚,邻近肺组织受压、聚拢
患者于2022年5月22日入院后行右侧胸腔置管引流术,引出淡血性液体900 mL,细胞学报告示:(胸水)未查见肿瘤细胞。患者完善相关检验检查,排除手术禁忌证后于2022年5月25日行剖腹探查术,术中见:血性腹水约1 000 mL,右侧卵巢可见大小约240 mm×160 mm×180 mm包块,包膜完整,张力大,呈黄白色,表面血管怒张,可见卵巢组织,右侧输卵管水肿增粗附着于包块表面,通过右侧输卵管卵巢切除术将肿块完整切除。剖视见:标本呈多房样改变,呈现梁状、巢状和乳头状,囊内充盈透明黏液,有出血坏死(见下页图3)。术中冰冻示:右侧卵巢交界性Brenner瘤。遂行“全子宫切除术+左侧附件切除术+大网膜切除术”。术后病理诊断:(右侧卵巢)恶性Brenner瘤(见下页图4),胸、腹水中未见瘤细胞。免疫组化结果:P63(+)、CK5/6(+)、CK 7(+)、S100(-)、GATA3(-),TP53(-)、Uroplakin-III(-)、Ki67≈20%。术后给予紫杉醇+卡铂(TC方案)化疗,后续已接受化疗4个疗程,肿瘤标志物降为:CA125:54.20 U/mL、CEA:32.01 ng/mL、CA199:74.39 U/mL。目前患者身体尚可,但因条件限制,未来我院复查,遂未能提供相关检查结果。
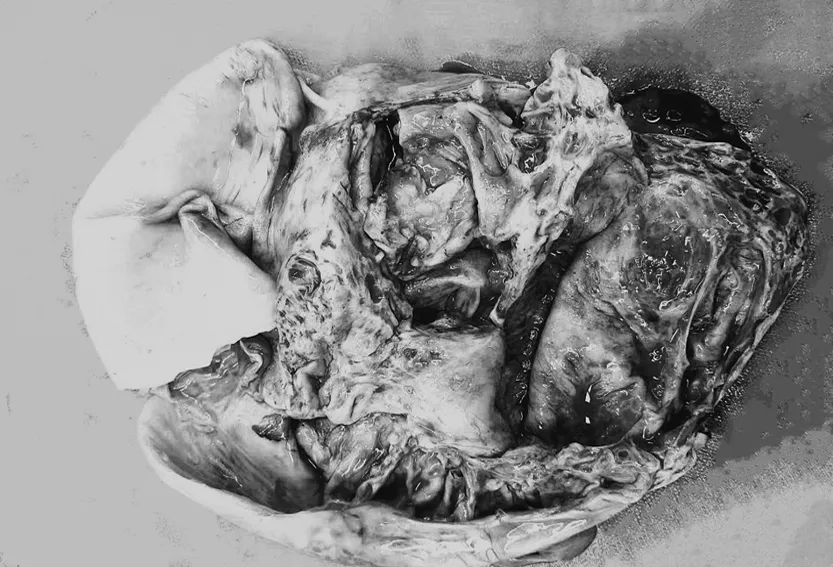
图3 手术切除标本:(右侧附件)囊实性肿物1个(直径=220mm)

图4 病理石蜡切片镜下特征(HE染色,10×10):瘤组织呈片团状、巢团状排列,局部鳞状分化,可见浸润生长。
2 讨论
2.1 发病机制
Brenner 肿瘤是一种少见的卵巢上皮性肿瘤,仅占卵巢肿瘤的2%[2]。1898年由 McNaughton-Jones 首次报道。病理类型分为良性、交界性及恶性Brenner 肿瘤[3]。
MBT被定义为表现超出良性Brenner瘤的上皮增殖,并存在间质浸润。交界性/恶性Brenner瘤极为罕见,约占Brenner 肿瘤的3%~5%[4]。MBT的发病机制目前并不明确,被认为可能起源于良性Brenner肿瘤,Brenner肿瘤有纤维基质和移行样上皮细胞两种不同的组织成分。研究揭示了Brenner肿瘤发病机制相关的一系列分子改变,特别是P16在交界性和MBT中的表达缺失以及KRAS和PIK3CA的体细胞突变。Cuatrecasas等[5]对13例Brenner肿瘤(5例良性、7例临界和1例恶性)进行了全面的免疫组织化学和分子遗传学研究。与良性Brenner肿瘤相比,在临界和恶性Brenner肿瘤中证明了EGFR和Ras的中度至强免疫反应性,这表明这些增殖标志物的表达增加可能有助于恶性转化,同时发现MBT中P16基因的杂合性丧失和高甲基化。Wang等[6]研究表明,MDM2的扩增和P16表达的丧失可能在恶性/临界Brenner肿瘤恶性转化中起作用,由于报道的病例数量较少,有关其生物学行为的数据有限。本例患者没有家族遗传病史,遗憾的是没有做分子检测。
2.2 诊断分析
2.2.1 临床分析 MBT的诊断具有困难性和挑战性。通常缺乏特征性症状,患者一般有腹胀、腹痛、盆腹腔包块,结合影像学检查,很容易被误诊为卵巢其他类型肿瘤,且因其罕见性,多数情况下忽略了Brenner肿瘤。据文献报道,临床上MBT合并胸腹水少见。本例患者自觉腹胀,无恶心、呕吐、腹痛消化道症状,误诊为右侧卵巢黏液性囊腺癌。MBT患者年龄范围广泛,从30~84岁,多发生于围绝经期和绝经后妇女[7],多发生在单侧,直径150~300 mm,外观呈灰白色。本例资料符合以上特征且合并有胸腹水。CA125、CA199和CEA等重要的血清标志物用以评估卵巢肿瘤,虽然CA125缺乏敏感性和特异性,但当其水平升高时,仍然具有推测卵巢恶性肿瘤的价值[8]。本例术前CA125、CA199和CEA均明显高于正常值,初步评估卵巢肿瘤性质为恶性,肿块去除和接受化疗后肿瘤标志物明显下降。
2.2.2 影像学诊断 阴道超声具有较好的分辨率,对诊断盆腔包块的敏感性和特异性高达96%和93%[9]。在超声检查中,Brenner肿瘤通常表现为实性或囊实性混合性包块,它可能包含囊性转化区域,内可见分隔,有研究认为肿瘤内的多发钙化伴后方声影是超声诊断Brenner肿瘤的可靠依据[10]。出血性和坏死性变化常见于MBT。在实际临床工作中,因超声图像本身具有多变性,诊断肿瘤性质较为困难,也有文献报道肿瘤内实性成分的占比可能是判断恶性程度的一个依据[11]。本例患者增强CT表现为多房囊实性肿块影,囊性成分占比较大,实性成分及分隔呈渐进性明显强化,病变内见多发增粗血管影穿行,符合文献报道的CT结果描述[12]。Matsutani等[13]报道PET/CT在鉴别Brenner肿瘤良恶性方面有较高敏感度(86.3%)和特异性(73.7%)。MRI也可用于卵巢异质性囊肿,它有助于对复杂囊肿进行术前诊断,同时能在已证实为恶性肿瘤的情况下评估局部区域受侵情况。本例患者因宫腔金属节育器,没有采用MRI检查。
2.2.3 病理诊断 MBT具有与良性成分共存的非典型区域,切面表现为单房或多房,特征是黏液或鳞状化生,小乳头状突起的存在,复杂的腺体形成,核异型性、突出的核仁和有丝分裂活性增加,存在间质浸润[14]。本例符合以上描述(图3、图4)。组织学上,MBT的特征是存在典型的高级别、较少低级别的移行细胞癌病灶,与嵌入纤维瘤间质中的良性或交界Brenner肿瘤成分相关,也可能与突出的腺体成分或钙化灶有关。本例患者肿瘤体积巨大,冰冻切片诊断为交界性Brenner肿瘤,结果病理诊断升级为恶性。有研究强调肿瘤的适当广泛取样对于建立准确的组织学诊断是必要的[15]。免疫组织化学染色有助于鉴别Brenner瘤组织发生,恶性Brenner瘤对Ras、EGFR、CK5/6、CK7、P63、GATA3、Uroplakin-III和 S100P蛋白可有阳性表达[16],对P16、P53、Rb表达阴性。但本例GATA3、Uroplakin-III、S100(-)均表达阴性,说明仍需要进一步的研究来阐明这种肿瘤的组织学起源。Ki-67增殖指数在恶性Brenner中明显增高,可达20%~30%[17],本例Ki67≈20%。
2.3 治疗与预后
治疗必须根据患者的临床状况和未来的生育要求进行定制。手术切除是MBT的治疗选择,研究报道大多数MBT表现为局部病变。本例符合MBT I期。卵巢恶性肿瘤的分期手术通常是全子宫切除术和双侧输卵管卵巢切除术,包括腹膜冲洗、隔膜细胞学检查、网膜切除术和肉眼可见的转移灶切除术[18]。在实践中,临床医生并不总是对交界性肿瘤进行全面分期,结合患者生育需求而行保守性单侧附件切除手术。在44例交界性Brenner瘤回顾性分析中发现,接受分期手术(29例)和附件切除(15例)结果差异无统计学意义,平均无疾病证据期为 4.3~4.9年。化疗药物对卵巢上皮性肿瘤敏感,初次手术后辅助化疗可以控制复发、缓解症状、延长生存期。方案多采用以铂类为基础的联合化疗,推荐标准的紫杉醇-卡铂一线方案(TC)[19]。由于MBT报道的病例数量很少,文献报道的组织学缓解率较低,且由于肿瘤异质性,因此使用辅助化疗甚至更少的新辅助化疗是有争议的。本例为老年患者,考虑患者年龄较大,对化疗药物不耐受,故选用顺铂60 mg单药化疗4个疗程,各项肿瘤标志物指标明显下降,治疗效果有待继续随访观察。且该患者有基础疾病,术前积极联合多学科会诊,专科指导用药,充分评估麻醉风险;术后蛋白较低,为补充营养、促进切口愈合,给予人血白蛋白20 mg。化疗后给予水化,加快化疗药物代谢。
综上所述,卵巢MBT极为罕见,无特异性临床表现,其最后诊断仍然依赖于组织病理学。由于不同的预后和管理方法,排除MBT至关重要。MBT的治疗主要以外科手术为主,但此类患者大多是绝经后女性,围术期管理同样是治疗该病的重要环节,此类患者的化疗适应证也仍有争议。对于有基础病的女性,应联合多学科诊治,排除对治疗该病造成不良影响的其他疾病。术后应加强患者的营养管理,对于一些术后胃肠功能较差的患者,可考虑结合中医手段进行辅助治疗,这在今后的工作中还需要更多的研究进一步探索。
