贮藏期间蛋白质氧化对牛肉品质的影响
2023-08-18马思丽李亚蕾罗瑞明张杏亚
张 萌,马思丽,李亚蕾,罗瑞明,张杏亚
(宁夏大学食品与葡萄酒学院 银川 750021)
随着肉制品行业的快速发展,肉类及其产品质量控制日益成为人们关注的焦点。据报道,从2020 年开始,中国的肉类生产量已经超过全球的1/3[1]。然而,肉及肉制品行业的销售量与生产量相比,相差较大,这是由于肉品质量下降所致,主要以脂肪氧化和蛋白质氧化两个方面最为突出[2]。脂类等食品组分的氧化对肉品质量的影响一直是研究热点,而蛋白质氧化在肉品质量中的重要作用却一直被忽视。近年来,有研究表明蛋白质氧化对食品体系的影响可能威胁到人类健康[3]。蛋白质氧化是蛋白质的共价修饰,其发生与脂肪氧化类似,也是由自由基链式反应引起,主要为起始、传递及终止3 个阶段[3]。由活性氧或氧化应激的副产物诱导产生,通过改变蛋白质的分子结构,造成氨基酸的损失以及蛋白质或肽链结构的改变,从而导致蛋白质生物功能的丧失[4-6]。最终影响肌肉蛋白的营养与功能性质,使肉及肉制品的质量降低[7]。此前,针对蛋白质氧化对肉品质量的报道多集中于肉品加工方面,对于牛肉贮藏过程中蛋白质氧化的规律及其与肉及肉制品之间的关系,鲜有报道。探究宰后贮藏期间蛋白质氧化变化规律及其对肉与肉制品品质的影响显得尤为重要。
冷鲜牛肉本身的抗氧化能力在宰后成熟期间显著下降,肌内活性氧和活性氮类物质不断累积,导致蛋白质氧化,进而对肉的品质性状,如保水性、颜色、质地等产生显著影响[8]。Kim 等[9]研究发现蛋白质的氧化对肉的嫩度有不良影响。牛建章等[10]探究了自然氧化过程中蛋白质氧化对牦牛肉品质的影响,结果发现随着贮藏时间的延长,剪切力减小,蒸煮损失增加,表明蛋白质氧化对牦牛肉品质有显著影响。蛋白质氧化对不同牛肉品质的影响已有初步研究,而蛋白质氧化究其根本对肉及肉制品影响的利弊仍存有很大争议。因此,本研究采用Pearson 相关性分析法,研究低温自然氧化过程中牛肉蛋白质氧化与肉品质的关系,揭示蛋白质氧化影响肉品质的内在机制,为从蛋白质氧化进程方面调控秦川牛宰后肉品质劣变/成熟进程提供理论依据。
本研究以4 ℃贮藏(0,2,4,6,8 d)秦川牛背最长肌为研究对象,通过测定其贮藏过程中羰基含量、巯基含量,以及pH 值、色差、剪切力、贮藏损失、离心损失和水分含量等指标,阐明冷鲜牛肉在贮藏过程中蛋白质氧化对其品质的影响,以期通过调控蛋白质氧化来提高牛肉品质。
1 材料与方法
1.1 材料与试剂
共采集3 头约48 月龄生长发育良好、体态相似、健康无疾病的秦川公牛背最长肌,采自宁夏清苑牧业有限公司。
磷酸三钠、尿素、磷酸(85%)、氢氧化钠均为分析纯级,国药集团化学试剂有限公司;无水氯化镁、抗坏血酸钠、盐酸胍、考马斯亮蓝R250、2-硝基苯甲酸(DTNB)、乙二醇双(2-氨基乙基)醚(EGTA)均为分析纯级,上海麦克林生化科技有限公司;2,4-二硝基苯肼(2,4-DNPH)分析纯级,北京索莱宝科技有限公司;乙醇(95%)、氯化钠、十二烷基硫酸钠、氯化钾、乙二胺四乙酸(EDTA)均为分析纯级,西陇化工股份有限公司。
1.2 仪器与设备
TGL-24M 高速冷冻离心机,长沙平凡仪器仪表有限公司;UV-1200 紫外分光光度计,上海美谱达仪器有限公司;SJ-3F 便携式pH 计,上海仪电科学仪器股份有限公司;JXFSTPRP-CL 全自动样品冷冻研磨仪,上海净信有限公司;JXH-100 恒温混匀仪,上海净信事业发展有限公司;TA.XT plus质构仪,英国Stable Micro Systems 公司。
1.3 试验方法
1.3.1 样品采集 采样对象选用3 头25 月龄左右的秦川公牛。取3 头牛的左胴体背最长肌,每个背最长肌样品平均分成3 份,共计9 个样品。屠宰后的秦川公牛对胴体修正后,用去离子水冲洗,剔除肉样可见脂肪后,分割成大小薄厚均等的肉块(约100 g/块),随后用聚乙烯(PE)薄膜包覆(透气性:23.5 g/m2/24 h),于4 ℃冰箱贮藏,采集贮藏0,2,4,6,8 d 的样品各约5 g,在液氮中快速冷冻2 h,之后贮存于-80 ℃冰箱,用于后续羰基与巯基含量测定。
1.3.2 总羰基的测定 蛋白质羰基含量根据Soglia 等[11]方法进行测定,并稍加修改。将1 g 切碎的牛肉样品与10 mL 0.15 mol/L 预冷KCl 混合,并用匀浆机以9 500 r/min 在冰水浴中均匀化30 s。将2 份等分(200 μL/份)匀浆与2 mL 20%三氯乙酸(TCA)混合。在5 000×g 离心5 min 并去除上清液后,添加800 μL 5%十二烷基硫酸钠(SDS)。混合物在40 ℃下超声处理60 min,然后用1 600 μL 的3 mol/L HCl(空白)处理1 个样品,而另一个样品用1 600 μL 含有0.3% 2,4-二硝基苯肼(DNPH)的3 mol/L HCl 处理。室温避光孵育30 min 后,加入800 μL 40%TCA 沉淀蛋白质,5 000×g 离心5 min,去除上清液,用2 mL 无水乙醇-乙酸乙酯(1∶1,V/V)洗涤,10 000×g 离心5 min,洗涤重复3 次(消除肌红蛋白的干扰反应)。最后,用3 mL 含有6 mol/L 盐酸胍的20 mmol/L NaH2PO4(pH 6.5)溶解微丸并在4 ℃培养过夜。5 000×g 离心5 min,上清液在波长280 nm 和370 nm 处测定添加DNPH 样品的吸光度。每次测定重复3 次。蛋白质羰基含量按公式(1)计算(以盐酸处理组为空白对照组,在波长370 nm 下测定吸光度值)。
1.3.3 总巯基的测定 根据Morzel 等[12]的方法进行测量,并稍加修改。称取约2.0 g 肉样于10 mL pH 值为8.0 的50 mmol/L 磷酸缓冲液(0.6 mol/L KCl,10 mmol/L EDTA)中匀浆(1 800 r/min,60 s),匀浆液离心(8 000×g,15 min)取上层清液为蛋白液提取液。用缓冲液将蛋白溶液配为1 mg/mL蛋白溶液,取4.5 mL Tris-甘氨酸缓冲液(8 mol/L尿素,pH 8.0)与0.5 mL,1 mg/mL 蛋白液混匀,在蛋白质液样加入0.5 mL Ellman 试剂,涡旋混匀后在30 ℃条件下反应30 min,总巯基含量在波长412 nm 处测定吸光度。根据巯基的分子吸光系数13 600 L/mol·cm 计算巯基含量。试验重复3 次,结果表示为nmol 巯基/mg 蛋白。用考马斯亮蓝法测定蛋白含量,用牛血清蛋白做标准曲线。
式中,A——样品在波长412 nm 处所测的吸光度;C——蛋白质浓度(mg/mL);13 600——摩尔吸光系数(L/mol·cm);11——稀释倍数。
1.3.4 pH 值的测定 参考Szerman 等[13]的方法,在测量前,使用pH 6.86 和pH 4.01 缓冲液对pH计进行校正,在肉块的截面处顺着肌纤维方向随机取不同的3 个位置进行穿刺测量,将电极头全部嵌入到肉中,待数值平稳后进行读数,最终结果取其平均值。
1.3.5 肉色的测定 冷却秦川牛肉贮藏的第0,4,8 天用便携式色差仪测定:L*(亮度值)、a*(红度值)与b*(黄度值),仪器在测量前用白盘进行校准,提供3 个生物副本2.5 cm×2.5 cm×2.5 cm,每个副本在肉表面的6 个位置进行测量,取平均值。
1.3.6 剪切力的测定 结合Lagerstedt 等[14]的方法并稍作修改,对剪切力进行测定,将宰后成熟0,2,4,6,8 d 的牛肉样品去除肉眼可见的脂肪以及结缔组织,将肉块放入蒸煮袋后,将热电偶温度计插入,当肉样内部中心温度达到70 ℃后,用流水冷却至室温,取出样品后用吸水纸吸干其表面水分,选取肉样随机区域将样品平行于肌纤维方向,切成约1 cm×1 cm×6 cm 的长方形,以1.0 mm/s垂直于样品方向剪切样品以测定其剪切力。各处理组的样本分别取3 个肉块进行平行测定,每块肉分成5 个肉条依次进行测定,剪切力的最终结果取其平均值。
1.3.7 贮藏损失的测定 参照Zhang 等[15]的方法,并稍加修改。将宰后的牛肉样品分为5 组,用滤纸擦干表面水分称重记为M1,分别在贮藏的0,2,4,6,8 d 时取出,并立即用滤纸擦干表面水分并称重记为M2,牛肉在贮藏成过程中的贮藏损失率按公式(3)计算:
1.3.8 离心损失的测定 参照Zhang 等[15]的方法,并稍加修改。将宰后成熟0,2,4,6,8 d 的牛肉样品分别切成约1 cm×0.5 cm×0.5 cm 的长条形,将其放在10 mL 的塑料离心管中,并称重(记为M1)。之后将装满了牛肉的离心管放入4 ℃离心机,以40 000×g 高速离心15 min,倒去离心管上层的水分,并用滤纸将其表面水分擦干,称重(记为M2)。牛肉在贮藏过程中的离心损失按公式(4)计算:
1.3.9 低场核磁测定 牛肉样品在贮藏期间水分含量及分布状态的测定参照Bertram 等[16]的方法并稍加调整。将不同贮藏时间(0,2,4,6,8 d)的牛肉样本沿平行肌纤维方向切成约1 cm×1 cm×1.5 cm 的肉样,随后将肉样放入低场核磁专用管中(直径为15 mm),然后将核磁专用管放入低场核磁共振仪中进行检测。测定时仪器温度为32 ℃,质子共振频率为21 MHz,回波时间τ 值为200 s,重复扫描4 次,每次扫描间隔2 s,选择CPMG 序列反演测定。每组样品做3 个平行试验,每个平行重复测定3 次。所有数据用Multi Exp Inv Analysis 软件进行反演分析。
1.4 数据分析
每个处理组做3 个重复,所有数据表示为“平均值±标准差”。采用SPSS Statistics 23 分析软件中的Duncan 进行差异显著性分析(P<0.05),数据绘图采用Origrin 2018 软件。
2 结果与分析
2.1 贮藏过程中羰基含量的变化
羰基化是蛋白质氧化最主要的特征类型[17]。肌肉中很多氨基酸能被直接氧化成羰基,如:赖氨酸、脯氨酸等;烷氧自由基(CO·)与烷基过氧化物(COOH)经过α-酰胺化途径最终使多肽骨架链β-断裂以及还原糖与赖氨酸也可直接反应生成羰基衍生物[18],以上3 种途径均可使羰基含量增多,所以蛋白质的氧化程度也可以通过测量羰基含量来衡量[6]。贮藏过程中牛肉的蛋白质羰基含量变化如图1 所示,随着贮藏时间的延长,牛肉中蛋白质的羰基含量显著增加(P<0.05),0 d 时,羰基含量为0.35 nmol/mg,第8 天时,羰基含量上升为1.80 nmol/mg,较第0 天增加了80.56%,这说明牛肉中蛋白质氧化随着贮藏时间的延长,蛋白质氧化程度逐渐上升。
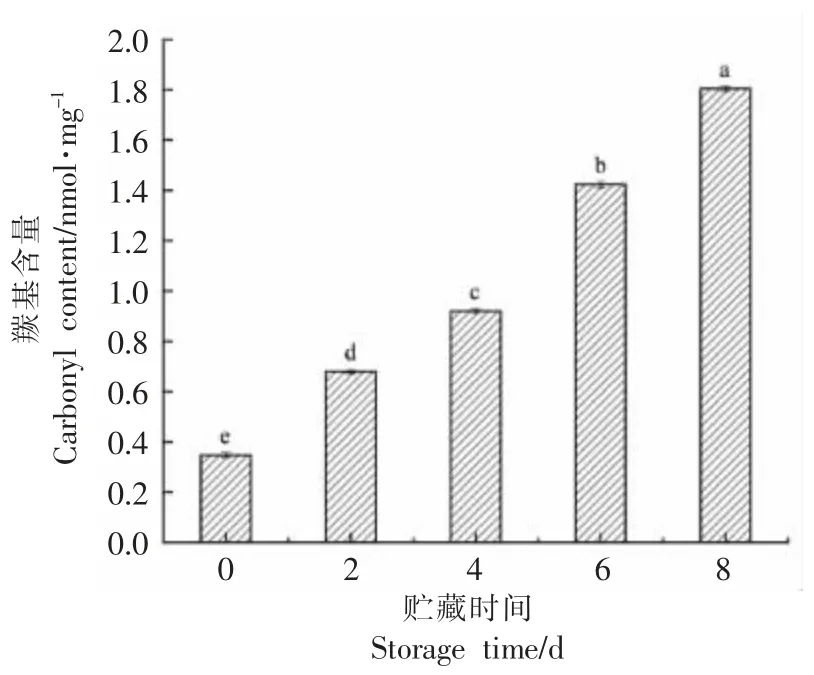
图1 贮藏过程中羰基含量变化Fig.1 Change in carbonyl content during storage
2.2 贮藏过程中巯基含量的变化
蛋白质分子中巯基基团的减少主要是由于含硫氨基酸、半胱氨酸等氨基酸中的巯基易被活性氧自由基攻击形成二硫键、亚磺酸、亚硫酸等氧化产物所致;半胱氨酸被氧化成磺酸、亚磺酸、次磺酸,蛋氨酸被氧化成亚砜和砜也可导致巯基含量降低,因此蛋白质的氧化程度也可通过巯基含量来衡量[7]。贮藏过程中巯基含量变化如图2 所示,随着贮藏时间的延长,巯基含量逐渐减少(P<0.05),第8 天时减少至68.78 nmol/mg,较第0 天减少了16.81%,这进一步说明秦川牛贮藏过程发生了蛋白质氧化现象。

图2 贮藏过程中巯基含量变化Fig.2 Change in sulfhydryl content during storage
2.3 贮藏过程中pH 值的变化
pH 值常被用来判断肉品质量的优劣,与肉的颜色、嫩度以及保水性显著相关[10]。贮藏过程中肉pH 值的变化程度如图3 所示,随着贮藏时间的延长,肉的pH 值呈先降低后升高的趋势(P<0.05),第0 天时,肉pH 值为6.96,第6 天时,肉pH 值下降到最低为5.48,较第0 天下降了21.26%,这可能是由于宰后肌肉中发生了无氧糖酵解反应,并产生了乳酸的积累所致,三磷酸腺苷分解后产生磷酸[19-20]。而乳酸、磷酸的累积均可使牛肉的pH值降低。第8 天时,pH 值升至5.56(P<0.05),这可能是由于贮藏时间较长导致肌肉呼吸方式发生改变,使氨和胺类等碱性物质的产生以及贮藏后期蛋白质在内源酶和微生物的作用下发生变性,分解产生氨、伯氨、仲氨和叔氨等一些碱性物质,导致pH 值升高[21]。刘佳东等[22]通过对牦牛、黄牛肉1~8 d 成熟过程中pH 值的变化分析,发现牦牛、黄牛肉的pH 值在1~8 d 成熟过程中均呈先降低后升高的趋势,与本研究结果相吻合。
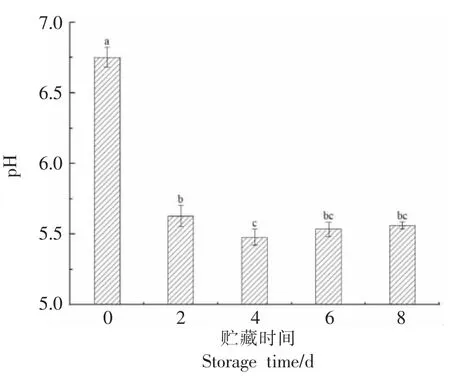
图3 贮藏过程中pH 值的变化Fig.3 Change in pH during storage
2.4 贮藏过程中肉色的变化
肉色是衡量肉类质量最直接的一个指标[23-24]。在宰后贮藏期间,3 种肌红蛋白的相对含量是决定肉色变化的主要因素。杜宇凡等[25]研究发现水产品中的蛋白质氧化是由肌红蛋白、氧化脂质或金属催化剂引发,位于氨基酸侧链上的官能团是这种攻击的主要目标,再经过进一步的反应,就会形成各种类型的蛋白质自由基和羟基衍生物,进而发生蛋白质羰基化,使肉品颜色发生变化。贮藏过程中肉色变化如图4 所示,L*表示牛肉的亮度值,随贮藏时间的延长,L*值呈先升高后降低的趋势(P<0.05),在第4 天时达到最大值,说明此时肉有较好的亮度值。这可能是由于长时间的氧化导致蛋白质变性,使水解肌肉结构的内源酶被激活,从而引起肌肉纤维小片化,致使背最长肌汁液渗出较多,表面含水量的提高增大了光的反射率,引起L*值增大[26]。a*为牛肉的红度值,它是衡量肉品色泽的一个主要指标。在贮藏过程中,a*值显著降低(P<0.05),这可能是由于氧化使宰后初期肌肉中残存的部分氧与脱氧肌红蛋白结合,生成氧合肌红蛋白使肉样呈鲜红色,而宰后细胞环境和所需的能量条件发生了变化,这就会导致不能进行还原反应,从而导致脱氧肌红蛋白被不可逆地氧化为深棕色的高铁肌红蛋白[27]。说明随贮藏时间的延长,蛋白质氧化使肉的红度值逐渐下降。b*值表示牛肉的黄度值,在贮藏过程中,b*值呈升高趋势(P<0.05),第8 天时肉品的b*值为14.23,较第0 天上升了83.14%。这可能是因为在贮藏时,肌肉和脂肪有了充分的接触,其中,脂肪被持续氧化,使得b*值升高。刘佳东等[22]的研究结果表明,在宰后排酸过程中,随贮藏时间的延长,牛肉的亮度值呈先上升后下降的趋势(P<0.05),本研究与其报道基本一致。扶庆权[27]也研究发现托盘包装的牛肉在冷藏成熟过程中L*值和a*值都呈先增大后减小的趋势(P<0.05),a*值的变化与本研究不一致,这与牛肉的包装方法及种类有一定关系。
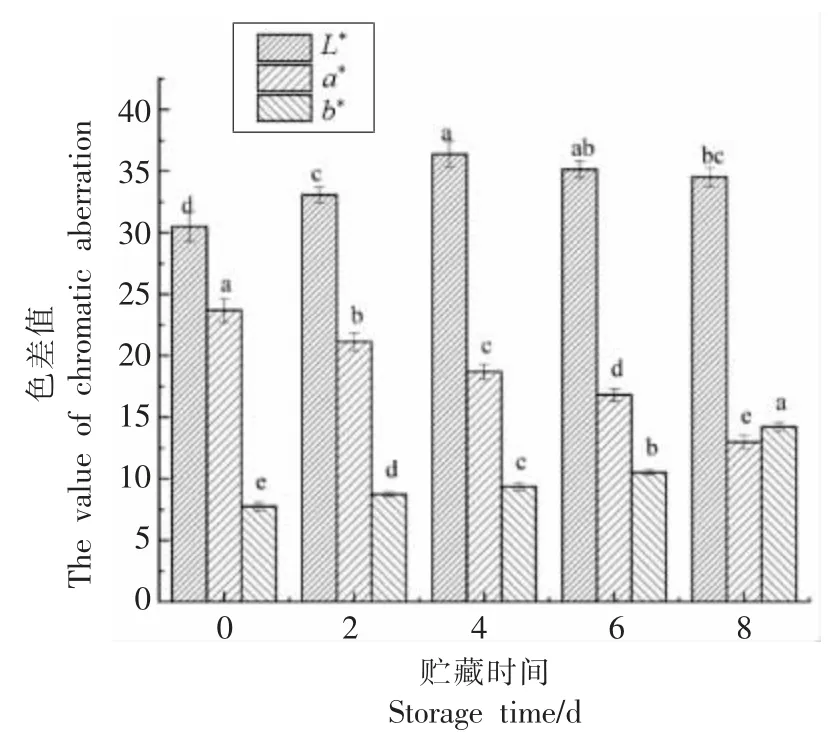
图4 贮藏过程中肉色的变化Fig.4 Changes in flesh color during storage
2.5 贮藏过程中剪切力的变化
剪切力作为肉嫩度的评价指标之一,与嫩度呈反比[28]。本研究中,剪切力的变化如图5 所示,随贮藏时间的延长,呈先升高后下降的趋势(P<0.05),在第4 天时,剪切力达到最大值为158.30 N,较第0 天上升了27.86%,说明此时肉的嫩度最差。目前认为氧化影响牛肉嫩度的机制是蛋白质氧化生成的羰基衍生物与赖氨酸反应形成交联,或巯基基团被氧化形成二硫键导致的交联,促使蛋白质发生聚合,进而使嫩度变差[29-30]。第8 天时,剪切力最小为87.75 N,较第0 天下降了41.09%,这可能是由于在蛋白质氧化作用下,牛肉自身的μ-钙活化酶被抑制,从而使细胞结构蛋白质的降解速率降低[31]。
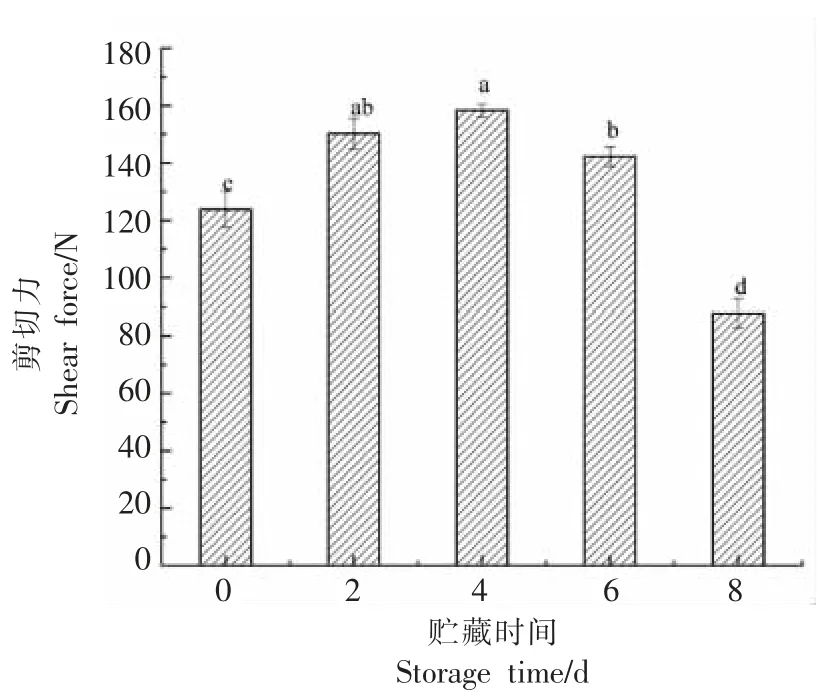
图5 贮藏过程中剪切力的变化Fig.5 Changes in shear force during storage
2.6 贮藏过程中贮藏损失率的变化
持水性对鲜肉品质有重要影响,贮藏损失和离心损失都反映了贮藏过程中牛肉的持水性。有研究证明,蛋白氧化会影响肌原纤维蛋白在肉中的持水性[32],贮藏损失仿真研究了冷鲜肉储藏期间水分的损耗情况,持水性降低会导致游离氨基酸、核苷酸以及维生素等水溶性营养成分的流失[33]。在试验中,随着贮存时间的延长,牛肉的贮藏损失率变化情况如图6 所示,牛肉的贮藏损失率呈上升趋势(P<0.05),在贮藏的第2,4,6,8 天时,牛肉的贮藏损失率分别为1.26%,1.66%,2.54%,4.15%,6~8 d 牛肉的贮藏损失率变化最大。这可能是由于蛋白质的氧化程度在贮藏后期逐渐加剧,导致蛋白质肽键发生断裂,而为了保持肉的持水性,肌肉纤维之间的缝隙会逐渐变大,原本的结构会变得松散,最终使得不易流动水渐渐变为自由水,因此,肌肉保持自身水分的能力变差[34-35]。

图6 贮藏过程中贮藏损失率的变化Fig.6 Change in storage loss rate during storage
2.7 贮藏过程中离心损失率的变化
在有外力的情况下,离心损失反应了牛肉的保水能力[27]。牛肉在贮藏期间的离心损失率的变化如图7 所示,随着贮藏时间的延长,牛肉的离心损失率呈先增加后降低的趋势(P<0.05),第0 天时,牛肉的离心损失率为1.11%,第6 天时到达最大值为4.59%,较第0 天增加了75.82%,第8 天时离心损失率又开始下降,为3.49%。离心损失率随贮藏时间的延长呈先升高后缓慢降低的趋势(P<0.05),这可能是由于在离心力的作用下,肌肉结构产生变化导致不易流动水转化为自由水,随着贮藏时间的延长,肌肉结构中可流失的总水分呈减少趋势,因此离心损失呈先上升后下降的趋势。
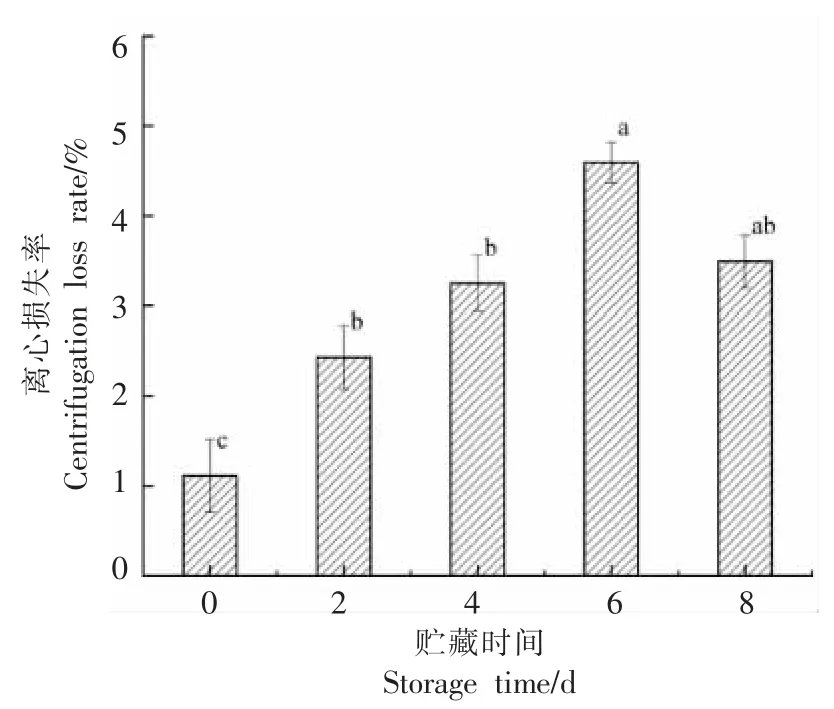
图7 贮藏过程中离心损失率的变化Fig.7 Changes in centrifugal loss rate during storage
2.8 贮藏期间牛肉中的水分含量及分布情况
横向弛豫时间T2的峰面积比反映了不同状态下细胞内、外水分的结合能力,以及能够自由移动的程度[29]。贮藏期间牛肉横向弛豫时间T2峰面积比的变化如表1 所示,P2b(%)、P21(%)和P22(%)分别表示牛肉样品中的结合水、不易流动水和自由水的相对含量。由表1 可知,随贮藏时间的延长,P2b和P21呈下降趋势(P<0.05),P22呈上升趋势(P<0.05),即牛肉样品中结合水和不易流动水含量下降,自由水含量上升。由此可以看出,牛肉在贮藏过程中3 种形态的水分子会发生变化,部分流动水转变为自由水。通过低场核磁共振测定发现,随贮藏时间延长,结合水和不易流动水的比例下降,而自由水的比例上升,这说明贮藏期间牛肉中的水分子形态发生了转变,不易流动水转变成了自由水。

表1 贮藏期间牛肉横向弛豫时间T2 峰面积比的变化Table 1 Change in the T2 peak area ratio of beef transverse relaxation time during storage
贮藏过程中牛肉的蛋白质氧化指标与品质指标的Pearson 相关性分析如表1 所示,羰基与巯基、pH、a*值、P2b和P21呈极显著负相关(P<0.01),相关系数r 分别为-0.981,-0.683,-0.977,-0.903,-0.948,相关性分析发现,P2b和P21与羰基呈极显著负相关(P<0.01),与巯基呈极显著正相关(P<0.01),贮藏损失、离心损失和P22与羰基呈显著正相关(P<0.05),与巯基呈显著负相关(P<0.05),表明蛋白质氧化会影响肉保持水分的能力,这与Huff-Lonergan 等[36]研究结果一致。与剪切力呈显著负相关(r=0.513,P<0.05),相关性研究发现羰基含量与剪切力呈显著负相关,表明一定程度的蛋白质氧化对牛肉嫩度有改善作用且有密切联系。Rowe 等[5]研究发现羰基含量与牛肉质地之间有显著的相关性,这与本研究结果一致。与b*值、贮藏损失、离心损失和P22呈极显著正相关(P<0.01),相关系数r 分别为0.944,0.950,0.745,0.945;巯基与pH、a*值、剪切力、P2b和P21呈显著正相关,相关系数r 分别为0.690,0.959,0.504,0.893,0.935,与L*值、b*值、贮藏损失、离心损失和P22呈极显著负相关(P<0.01),相关系数r 分别为-0.648,-0.936,-0.947,-0.722,-0.946,这表明蛋白质氧化与肉品质变化有密切联系。
3 结论
牛肉在4 ℃低温贮藏过程中,随贮藏时间的延长,蛋白质羰基含量、b* 值、贮藏损失和自由水含量逐渐增加,巯基含量、a* 值逐渐降低、不易流动水和结合水含量减少,pH 和离心损失呈先降低后升高的趋势,L* 值和剪切力呈先上升后下降的趋势,在第4 天时剪切力达到最大值,说明此时肉的嫩度最差。通过相关性分析发现,羰基和巯基含量与pH、L*、a*、b*、剪切力、贮藏损失和离心损失等品质指标显著相关,贮藏过程中蛋白质氧化对牛肉品质有显著影响,蛋白质氧化可能通过改变蛋白质结构引起蛋白质交联,同时,蛋白质氧化导致肽链骨架断裂,肌纤维结构疏松,最终影响肌肉结构,改变肌肉内部水分储存空间,促使牛肉剪切力增大,贮藏损失增加。
