发芽绿豆多酚的降血糖作用及对糖尿病小鼠肠道菌群的影响
2023-08-18沈鑫婷姜秀杰许庆鹏张爱武张东杰
沈鑫婷,姜秀杰,许庆鹏,张爱武,张东杰*
(1 黑龙江省农业科学院食品加工研究所 黑龙江省食品加工重点实验室黑龙江省全谷物营养食品工程技术研究中心 哈尔滨 150086 2 黑龙江八一农垦大学 黑龙江 大庆 163000)
2 型糖尿病(Type 2 diabetes,T2DM)是代谢性疾病,主要以高血糖和胰岛素抵抗为特征[1-2]。T2DM 的大多数治疗干预都集中在通过刺激胰岛素分泌、减少葡萄糖产生或增强胰岛素对靶组织的作用来降低血糖水平[3-4]。而近年来许多研究表明,肠道菌群也是参与糖尿病发生和发展的一个重要因素,由于肠道微生物群结构和功能上的变化和高血糖、胰岛素抵抗等糖尿病表型密切相关,肠道菌群及其相关代谢产物在血糖代谢、胰岛素抵抗以及慢性炎症等2 型糖尿病的病理生理机制中发挥着重要作用。研究发现无论是饮食干预还是药物治疗,肠道都是调节糖尿病的重要场所。对肠道菌群[5]调节影响最大的因素是饮食因素,如高脂或高糖饮食,可能导致肠道菌群发生变化,进而引发肠道炎症。T2DM 还存在不同程度的慢性低度炎症反应[6],常伴有炎症因子,如白细胞介素和肿瘤坏死因子升高。胰岛β 细胞的结构和功能受损可能由炎症因子的释放所致,甚至导致胰岛素分泌和转运发生障碍[7]。而通过肠道菌群可调节代谢疾病的屏障功能和宿主炎症状态。
绿豆是中国重要的食用豆类作物之一[8]。由于它的纤维成分含量高,糖分含量比较低,因此是糖尿病患者的推荐食物。绿豆的发芽过程实质是绿豆的活化过程。发芽处理为杂粮加工手段之一,可有效提高谷物的营养价值和生物活性成分含量。大量研究证实绿豆的化学成分,尤其是多酚具有降低慢性疾病风险的健康益处[9-11]。酚类物质是植物次生代谢产物,体外和临床研究均表明[12],多酚能够调节肠道微生物群,有助于肠道健康的积极变化,减少炎症过程,从而改善全身疾病状态。
本实验以绿豆为原料,发芽处理后,经提取、纯化得到多酚提取物。建立T2DM 小鼠模型,对造模成功的小鼠灌胃不同剂量的多酚提取物,通过空腹血糖值、葡萄糖耐受量、胰岛素水平以及炎症因子和肝脏组织切片的分析,探究发芽绿豆多酚提取物调控血糖及抗炎的效果。采用高通量测序技术,探究其对小鼠肠道菌群的影响,以及糖尿病与肠道菌群和炎症因子间的联系。旨在干预并改善2 型糖尿病,为天然、安全、有效的降糖功能性食品的开发提供理论参考。
1 材料与方法
1.1 动物、材料与试剂
SPF 级C57BL/6 小鼠(18~20 g),雄性,辽宁长生生物技术股份有限公司(许可证号:SCXK(辽)2020-0001),本实验动物处理遵循黑龙江八一农垦大学动物伦理委员会原则。基础饲料、高脂饲料,南通特洛菲饲料有限公司。
绿豆,黑龙江省大庆市巴哈西伯绿豆,发芽绿豆多酚提取物由黑龙江八一农垦大学食品学院实验室自制;STZ,美国Sigma 公司;GA-3 血糖试纸,三诺生物有限公司;盐酸二甲双胍,上海源叶生物科技有限公司;检测试剂盒(FINS、TNF-α、IL-6、IL-10、CPR),南京建成生物有限公司;其它化学试剂均为分析纯级。
1.2 仪器与设备
GA-3 血糖仪,三诺生物有限公司;TU-1810紫外-可见分光光度计,北京普析通用仪器有限责任公司;酶标仪,中国迈瑞医疗公司;RE-2000A旋转蒸发仪,上海亚荣生化仪器厂;高速冷冻离心机,美国Eppendorf 公司。
1.3 方法
1.3.1 发芽绿豆多酚的制备流程 发芽绿豆多酚的制备[13-16]:挑选新鲜优质绿豆进行发芽处理,利用响应面优化法,确定绿豆最佳的发芽工艺为:浸泡温度25 ℃,浸泡时间11 h,发芽温度28 ℃,发芽时间3 d,浸泡液CaCl2浓度2 mmol/L,在此条件下,多酚含量为487.81 mg/100 g。绿豆经过发芽处理,取出冲洗、烘干(40 ℃,鼓风干燥箱)、粉碎(过80 目筛)。称取过筛后的发芽绿豆粉于烧杯中,根据1∶26(g/mL)的料液比加入70%的乙醇溶液,经过超声、离心(5 000 r/min,15 min)、取上清液,在45 ℃条件下,旋转蒸发至干,即得发芽绿豆多酚粗提物。对多酚粗提物纯化(AB-8 大孔树脂),收集纯化后溶液,冷冻干燥,制得绿豆发芽多酚提取物(Germinated mung bean polyphenol,GMP)。
1.3.2 2 型糖尿病小鼠模型的建立 SPF 级C57BL/6 雄性小鼠在12 h 明暗交替(8∶00~20∶00),室温(23±2)℃,相对湿度40%左右且通风良好的环境下,分笼饲养,实验期间均自由饮食、饮水。适应性喂养1 周后,根据体质量进行随机分组:正常对照组(n=6)和造模组(n=30),正常组进食基础饲料、造模组进食高脂饲料。饲养4 周后,禁食12 h,造模组小鼠腹腔注射30 mg/kg bw 的STZ,正常组注射相同体积柠檬酸缓冲液(pH=4)[17-18]。注射72 h 后测定空腹血糖值,并在造模后第7 天检测空腹血糖水平仍超过11.1 mmol/L 且伴随表现出“三多一少”特征的小鼠视为造模成功。
1.3.3 动物分组及给药方法 造模成功的小鼠随机分为5 组:模型组(M)、阳性对照组(MET,二甲双胍,150 mg/kg)、高剂量组(MGPH,150 mg/kg)、中剂量组(MGPM,100 mg/kg)、低剂量组(MGPL,50 mg/kg)。日常饲养期间采取自由饮食、饮水。MET 组以及低、中、高剂量干预组分别用二甲双胍水溶液和发芽绿豆多酚提取物水溶液进行灌胃,正常组(N)和模型组(M)灌胃相同体积的生理盐水,连续灌胃5 周。实验期间,每天观察动物进食量、精神状态、毛发色泽等,每周按时称量小鼠体质量。
1.3.4 空腹血糖值测定及口服葡萄糖耐受实验每周按时禁食12 h,测定空腹血糖值(FBG)。在最后一次灌胃结束后,小鼠禁食6 h,灌胃25%的葡萄糖溶液(2 g/kg bw),测定灌胃0,30,60,90,120 min 的血糖值,根据公式(1)计算血糖曲线下面积(AUC),并通过曲线下面积表达葡萄糖耐受量(OGTT)的变化。
1.3.5 血清指标检测 实验结束时,小鼠禁食12 h,用乙醚麻醉,眼球取血,室温下静置30 min,低温高速离心机3 500 r/min 离心10 min,取血清。采用ELISA 法进行指标检测。
胰岛素抵抗的稳态模型评估(HOMA-IR)根据公式(2)计算:
1.3.6 肝组织的病理切片观察 取部分固定在4%多聚甲醛中新鲜的肝脏组织,进行石蜡包埋、切片(厚度约为4 μm)、染色、水洗、封片处理,自然晾干,用电子显微镜观察组织变化,拍照记录。
1.3.7 肠道菌群检测 取小鼠粪便样品收集在密封的无菌塑料管中。采样后立即用液氮将粪便冷冻,并保存在-80 ℃下。对粪便进行DNA 的提取、PCR 扩增、测序。
1.4 数据统计分析
用SPSS 26.0 对实验结果进行分析处理,组间两两比较用ANOVA 方差分析法。P<0.05 表示有统计学显著差异,P<0.01 表示有极显著性差异。
2 结果与分析
2.1 GMP 对糖尿病小鼠一般体征的影响
实验期间,观察发现正常组小鼠精神状态良好,毛发光滑,实验前、后的进食量、饮水量比较稳定,体质量逐渐增长。糖尿病模型组小鼠精神比较萎靡,毛发暗淡无光泽,实验前、后对比出现了“三多一少”的症状。阳性对照组和GMP 各剂量干预组小鼠体质量下降幅度减少,精神状态也有所好转。如表1 所示,造模成功后,模型组小鼠的体质量和正常组小鼠相比显著下降(P<0.01);实验结束时,与模型组对比,GMPM 组、GMPH 组和MET组小鼠的体质量都显著增加。
表1 GMP 对小鼠体质量的影响(,n=6)Table 1 Effect of GMP on body weight of mice(,n=6)
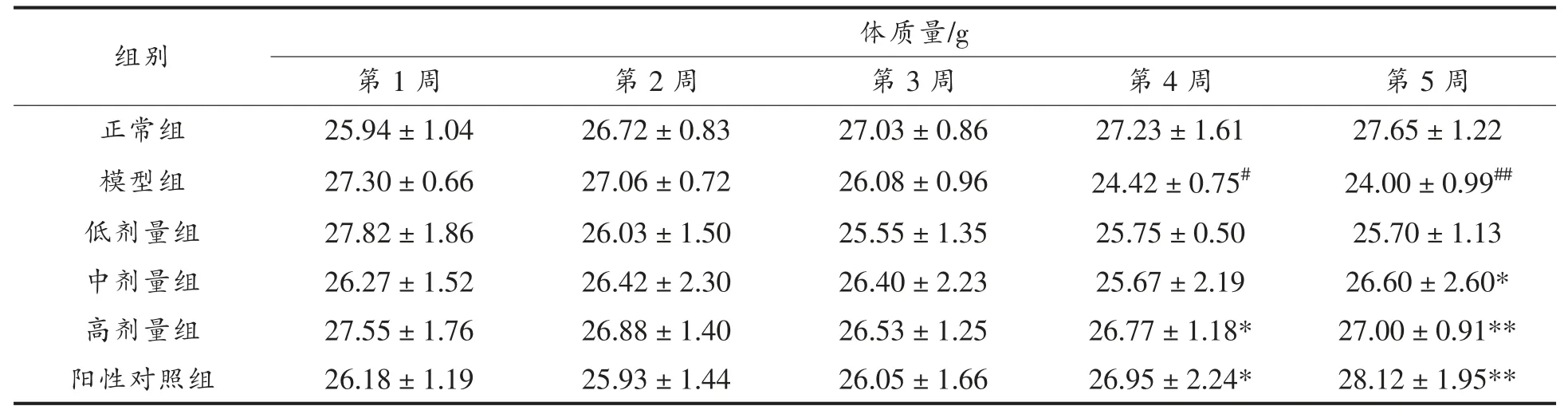
表1 GMP 对小鼠体质量的影响(,n=6)Table 1 Effect of GMP on body weight of mice(,n=6)
注:##.表示模型组与正常组比较差异极显著(P<0.01);*.表示各组与模型组比较差异显著(P<0.05);**.表示各组与模型组比较差异极显著(P<0.01),下同。
2.2 GMP 对糖尿病小鼠空腹血糖及口服葡萄糖耐量的影响
由表2 可知,正常组小鼠空腹血糖浓度比较稳定,模型组小鼠的空腹血糖浓度在造模成功后呈逐渐上升的趋势;与模型组相比,在干预第4 周时,中、高剂量组空腹血糖均极显著低于模型组;在实验结束时,低、中、高剂量组的空腹血糖浓度表现出极显著低于模型组(P<0.01)。测定结果表明,GMP 可以改善T2DM 小鼠干预期间的血糖水平,各剂量干预组中以高剂量组的多酚溶液效果最佳。
表2 GMP 对小鼠血糖的影响(,n=6)Table 2 Effect of GMP on blood glucose in mice(,n=6)

表2 GMP 对小鼠血糖的影响(,n=6)Table 2 Effect of GMP on blood glucose in mice(,n=6)
糖耐量即机体对葡萄糖的耐受情况,判断干预后胰岛β 细胞对血液中血糖调节能力的强弱。血糖曲线下面积(AUC)反映的是人体利用和清除葡萄糖的程度,当AUC 增大则说明机体对葡萄糖的耐受能力下降,反之能力升高。如表3 所示,N组的血糖值随着时间的延长变化平缓,M 组小鼠血糖在前30 min 内迅速升高,在达到峰值后呈下降趋势,而血糖值一直较高。各剂量干预组的血糖值在60 min 后出现缓慢下降的趋势,均未恢复到初始血糖值。根据AUC 显示,M 组显著高于N 组(P<0.01),与M 组相比,各剂量干预组和阳性对照组呈现显著性降低(P<0.01)。结果表明,GMP 可以在一定程度上提高T2DM 小鼠的糖耐量,而且从恢复程度上看,高剂量组的效果较好。

表3 发芽绿豆多酚对小鼠糖耐量的影响Table 3 Effects of germinated mung bean polyphenols on glucose tolerance in mice
2.3 GMP 对糖尿病小鼠胰岛素水平及胰岛素抵抗指数的影响
胰岛素是胰岛β 细胞分泌的、唯一能够降低血糖的激素,对调节血糖有重要影响。如图1 所示,与正常组比较,模型组的胰岛素水平和HOMA-IR 指数显著升高(P<0.01);与模型组相比,阳性对照组胰岛素水平明显降低(P<0.05),多酚提取物各剂量干预组显著降低了HOMA-IR 指数水平(P≤0.01),而胰岛素水平虽有下降,但无显著性差异。表明发芽绿豆多酚提取物可以增加2 型糖尿病小鼠的胰岛素敏感性,降低胰岛素抵抗。
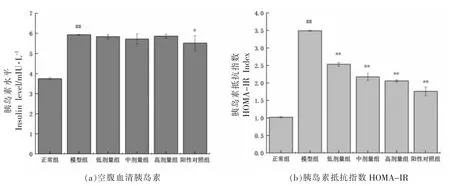
图1 GMP 对糖尿病小鼠胰岛素水平及胰岛素抵抗指数的影响Fig.1 Effect of GMP on insulin level and insulin resistance index in diabetic mice
2.4 GMP 对糖尿病小鼠的炎症反应
GMP 对T2DM 小鼠炎症反应的影响如图2所示,与正常组相比,模型组小鼠血清中IL-6 从227.37 ng/L 上升到309.25 ng/L,显著升高了36%;TNF-α 从44.22 ng/L 升高到81.64 ng/L,显著升高了84.62%;C 反应蛋白(CRP)从27.84 μg/mL 升高到47.68 μg/mL,显著升高了71.26%;IL-10 显著降低了37.54%。CRP 是一种非特异的炎症标志物,由肝细胞所合成,其合成的最重要的调节因子是IL-6 和TNF-α,其升高的程度反映了炎症组织的大小和活动性。当C 反应蛋白值为10~50 mg/L时,表示轻度炎症。说明与正常组相比,模型组出现了炎症反应。
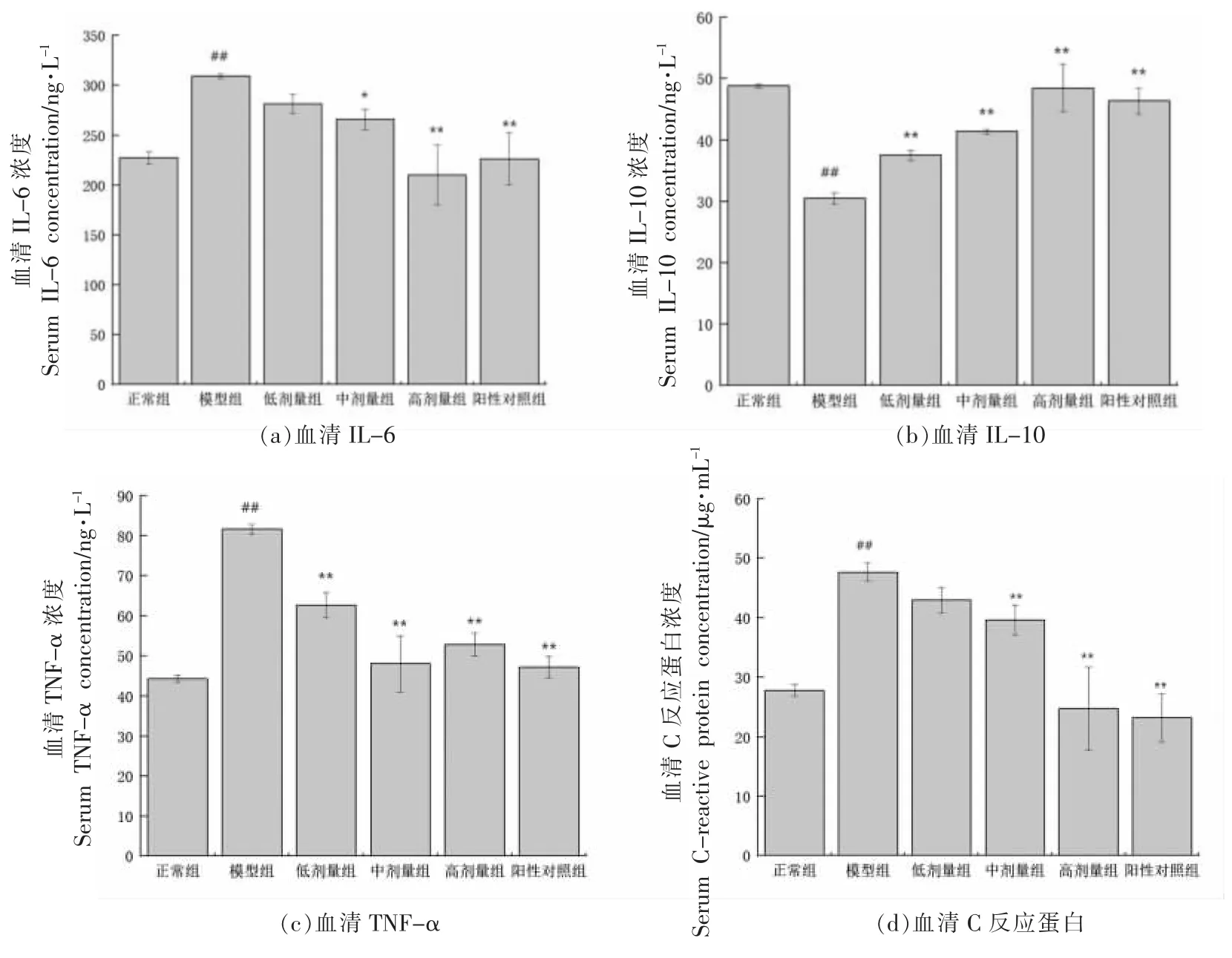
图2 GMP 对糖尿病小鼠炎症因子的影响Fig.2 Effect of GMP on inflammatory factors in diabetic mice
与模型组比较,GMP 中、高剂量干预组的IL-6 质量浓度从309.25 ng/L 分别降低至265.83,209.91 ng/L,显著降低了14.04%,32.12%(P<0.05,P<0.01),低剂量干预组降低了9%,而无显著差异。低、中、高剂量干预组以及阳性对照组的TNFα 质量浓度与模型组相比,显著降低了23.33%,41.18%,35.25%,42.16%(P<0.01);IL-10 质量浓度与模型组比,显著升高了23.02%,35.88%,59.07%,52.15%(P<0.01);中、高剂量干预组以及阳性对照组的CRP 质量浓度与模型组相比,显著降低了16.97%,48%,51.13%,低剂量干预组降低了10%,然而无显著差异。说明GMP 干预组可以显著降低IL-6、TNF-α、CPR 的水平,升高IL-10的水平,进而缓解糖尿病引起的炎症反应。
与模型组对比,动物内脏均未出现严重损伤情况,说明发芽绿豆多酚灌胃剂量对动物是安全的。如图3 所示,N 组的肝组织结构基本正常,未见炎症细胞浸润,肝细胞结构饱满,组织中央静脉清晰可见,肝窦呈放射状沿着中央静脉,红色箭头所示为肝窦巨噬细胞。M 组的肝组织结构异常,肝细胞结构疏松,组织可见较多炎症细胞浸润(黑色箭头所示)。MET 组的肝组织未见明显炎症细胞浸润,肝细胞结构饱满。GMPL 组部分肝细胞轻微水肿,组织可见明显炎症细胞浸润(黑色箭头所示)。GMPM 组的肝组织结构轻度异常,未见明显炎症细胞浸润,部分肝细胞轻微水肿(黄色箭头所示)。GMPH 组的肝组织结构基本正常,肝细胞结构饱满,组织中央静脉清晰可见,未见明显炎症细胞浸润。

图3 GMP 对糖尿病小鼠肝脏炎症反应的影响Fig.3 Effect of GMP on liver inflammation in diabetic mice
2.5 GMP 对糖尿病小鼠肠道菌群的影响
2.5.1 小鼠肠道Alpha 多样性分析 Alpha 多样性(Alpha diversity)表示单独样品的物种丰度及其物种多样性,有不同衡量指标。如图4 所示,模型组的肠道菌群ACE、Chao、Shanon、Simpson 指数低于正常组,表明了T2DM 小鼠的物种多样性降低。与模型组相比,GMP 能够提高肠道菌群的α多样性指数,抑制肠道菌群丰富度下降的能力,并能增加菌群的物种多样性。本实验还统计了覆盖率,其数值反映测序结果是否代表了样品中微生物的真实情况,覆盖率越高,则物种被检测出来的概率越大。说明GMP 干预可以在一定程度上平衡失调的肠道菌群。

图4 小鼠肠道菌群的α 多样性指数Fig.4 Changes of intestinal flora in mice α diversity index
2.5.2 小鼠肠道微生物物种分类分析 如图5 所示,对每组在门水平上比较分析,结果显示肠道菌群主要有:厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、疣孢菌门(Verrucomicrobia)等。与N 组小鼠对比,M 组小鼠肠道厚壁菌丰度显著升高,拟杆菌的丰度显著降低(P<0.01),与M 组比较,多酚提取物干预后,厚壁菌丰度显著降低,拟杆菌丰度显著升高,变形杆菌门相对丰度显著降低。表明菌株在门水平上的丰度会影响肠道菌群的平衡。

图5 肠道菌群门水平分析Fig.5 Analysis of phylum level of intestinal flora in mice
2.6 血清炎症因子和肠道菌群与代谢指标的相关性分析
用Spearman 相关分析,血清炎症因子、肠道菌群与糖代谢指标的相关性。如图6 显示,小鼠的空腹血糖(FBG)与IL-6、TNF-α、CPR、厚壁菌门、变形菌门呈正相关,与IL-10、拟杆菌门呈负相关。厚壁菌门、变形菌门与IL-6、TNF-α、CPR 呈正相关,与IL-10 呈负相关。拟杆菌门与IL-6、TNF-α、CPR 呈负相关,与IL-10 呈正相关。
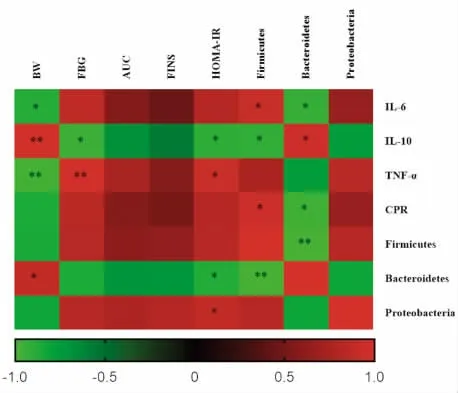
图6 血清炎症因子和肠道菌群与代谢指标的相关性分析热图Fig.6 Heat map of correlation analysis between serum inflammatory factors,intestinal flora and metabolic indexes
3 讨论
2 型糖尿病通常被称为非胰岛素依赖型糖尿病,是一种以持续高血糖诊断为基础的代谢性疾病[19]。近年来,2 型糖尿病的患病率逐年上升,目前市场上治疗糖尿病的常用药物虽然具有较好的效果,但大多存在一定副作用[20]。因此开发一种天然、安全、有效的降糖功能性食品,成为当前糖尿病研究的热点。一项流行病学研究表明,摄入富含多酚的饮食可以大大降低患糖尿病的风险[21]。
本文探究发芽绿豆中提取的多酚的降糖效果。在GMP 干预5 周后,结果显示,GMP 可显著改善T2DM 小鼠的“三多一少”症状,降低T2DM小鼠的高血糖和胰岛素抵抗,减轻炎症反应,并对肝脏组织起到保护或修复作用。肝脏是参与代谢的关键炎症器官,参与代谢物的储存和排泄[22],实验结果表明GMP 能修复小鼠肝细胞溶解、炎症细胞浸润现象,使肝损伤情况得到改善。其上述作用的发挥与肠道菌群的调节存在相关性。GMP 可调节糖尿病小鼠门水平上的菌群丰度,厚壁菌门和变形菌门丰度增加,其血糖和炎症指标水平也越高;拟杆菌门丰度增加,其血糖和炎症指标水平降低。有研究发现拟杆菌门具有抗炎、调节免疫的作用,在炎症小鼠模型的肠道菌群中,拟杆菌门的数量降低[23-24]。与本实验结果一致。近年来有许多动物实验和临床试验表明,多酚可以通过不同机制调节肠道中微生物菌群、微生物多样性以及厚壁菌门与拟杆菌门的比例(F/B)[25-27];并且多酚对葡萄糖代谢有益,可显著改善机体葡萄糖耐受[28],由于饮食摄入后第1 个接触的器官是胃肠道,因此肠道可能是多酚发挥代谢作用的主要场所[29]。而且T2DM 小鼠肠道菌群的物种多样性、丰度与血糖、炎症因子水平密切相关。因此通过调节肠道菌群、改善炎症反应来改善T2DM 等代谢性疾病,被认为是目前新的治疗策略[30]。
综上所述,一定剂量的发芽绿豆多酚提取物可以显著改善2 型糖尿病小鼠的血糖水平,同时改善炎症反应,并对肝损伤起到一定程度的修复作用;增加肠道菌群的多样性,平衡失调的肠道菌群。结果表明发芽绿豆多酚提取物是一种具有潜力和研究价值的天然降糖物质,在糖尿病治疗中具有广阔前景。
