凡纳滨对虾抗菌肽的筛选及与DNA 的结合机制
2023-08-18王铭遥郑明静任中阳石林凡邓尚贵
王铭遥,郑明静,2,3,任中阳,2,3,石林凡,2,3,邓尚贵,杨 燊,2,3*
(1 集美大学海洋食品与生物工程学院 福建厦门 361021 2 福建省食品微生物与酶工程重点实验室 福建厦门 361021 3 大连工业大学 海洋食品精深加工关键技术省部共建协同创新中心 辽宁大连 116034 4 浙江兴业集团 浙江舟山 316014)
食源性疾病是一个全球性的公共卫生问题,每年约有420 万人因食物中毒而死亡[1]。虽然我国食源性疾病的发生率整体呈下降趋势,但是部分地区形势仍然不容乐观,特别是由细菌引起的食物中毒事件频频发生[2]。副溶血性弧菌(Vibrio parahaemolyticus)是变形菌门的一种游动的、非孢子形成的、杆状革兰氏阴性菌,有嗜盐和嗜温的特性,它作为海洋食品主要的食源性致病菌,引起的食物中毒事件占水产食物中毒的60%以上[3-4]。该菌通过侵入宿主细胞(肠上皮细胞),在体内释放大量毒力因子,导致宿主细胞死亡,进而引起肠胃炎等疾病[5-6]。
抗菌肽(AMPs)也被称为宿主防御肽,广泛存在于自然界的各种生物体内,是机体先天性免疫系统的重要组成部分[7]。抗菌肽因快速、广谱的抑菌活性和独特的抑菌机制而被认为是化学防腐剂潜在的替代品[8-9]。例如,抗菌肽mBjAMP1 可在短时间内杀灭革兰氏阳性细菌金黄色葡萄球菌和革兰氏阴性细菌大肠杆菌,展现出较强的广谱抑菌活性[10]。凡纳滨对虾又称南美白对虾,是对虾科的一个重要经济虾种,2020 年我国对虾的年总产量高达近120 万t[11]。副溶血性弧菌作为凡纳滨对虾的主要感染细菌,严重威胁着对虾及其加工制品的食用安全。有研究发现,凡纳滨对虾感染副溶血性弧菌后,其血清中能产生一定数量的抗菌片段来应对感染[12]。如凡纳滨对虾抗菌肽LvALF8LBD对大肠杆菌、哈维氏弧菌、金黄色葡萄球菌和表皮葡萄球菌等展现出良好的广谱抑菌活性[13]。虽然人们在海洋无脊椎动物中发现了许多抗菌肽,但是发现数量远不及陆地动物,其原因是海洋无脊椎动物中抗菌肽的质量浓度通常小于1 mg/kg,且提取工艺复杂,很难从海洋无脊椎动物中获得足够数量的抗菌肽,用于结构鉴定及抗菌活性测定[14-16]。相比传统的抗菌肽提取方法,生物信息学技术可以提供快速、准确的抗菌肽筛选、识别方法[17-18]。基于此,本研究通过超高效液相色谱-质谱联用技术鉴定出凡纳滨对虾体内分子质量为1 500~3 000 u 的多肽片段,再利用生物信息学对具有潜在抑菌活性的多肽片段进行评估和筛选,并合成已确定的抗菌肽对象,探索抗菌肽对副溶血性弧菌的抑菌活性及与DNA 的结合机制,为抗菌肽在食品工业上的应用提供技术支持。
1 材料与方法
1.1 材料与试剂
细菌(副溶血性弧菌ATCC 17802 和金黄色葡萄球菌ATCC 29213)由广东省汕头大学海洋生物技术重点实验室提供,并于营养肉汤中,37 ℃条件下培养24 h;抗菌肽由北京中科亚光生物科技有限公司合成,纯度99%以上;细菌基因组DNA提取试剂盒、Gene Green 核酸染料,TIANGEN 公司;营养肉汤,广东环凯微生物科技有限公司;琼脂糖,北京兰博利德生物技术有限公司;所有试剂均为分析纯级。
1.2 仪器与设备
GelDoc XR 电泳成像系统,美国Bio-Rad 伯乐公司;Nano Acquity UPLC system、Thermo Scientific Q-Exactive,美国Waters 公司;Chirascan V100 圆二色谱仪,英国Applied Photophysics Ltd公司。
1.3 抗菌肽的质谱分析
将凡纳滨对虾洗净后加入100 mL PBS 缓冲液(10 mmol/L,pH 7.2)中绞碎,取1 mL 绞碎后的悬浊液离心(15 min,10 000 r/min)取上层清液,再利用超滤膜截留分子质量为1 500~3 000 u 的多肽,所得样品于-20 ℃保存。利用超高效液相色谱-质谱联用技术对多肽的氨基酸序列进行鉴定分析,液相色谱的流动相分别是含0.1%甲醇的超纯水溶液和乙腈,进样体积为5 μL,梯度洗脱条件如表1 所示。质谱的一级扫描分辨率为70 000,扫描范围是350~1 600m/z;二级扫描分辨率为17 500,动态消除10.0 s。最后使用搜库软件MAXQUANT v1.6.5.0 和数据库Uniprot 白脚虾蛋白库Penaeus vannamei(Whiteleg shrimp)进行蛋白序列比对[19]。
1.4 生物信息学筛选及合成
分别使用在线软件APD3(https://aps.unmc.edu/AP/)和CAMP(http://www.camp.bicnirrh.res.in/)计算多肽的电荷数和疏水率,并评估其抗菌肽的可靠性[20]。多肽采用固相合成法合成,首先将9-芴基甲氧羰基氨基酸(甲氨基甲酸)和2,6-二氯苯甲酰氯(DCB)添加到树脂中以附着第1 个氨基酸,再向其中加入哌啶脱去保护基,不断搅拌将活化的氨基酸连接到树脂上以偶联下一个氨基酸残基,如此往复循环,直至目标肽段全部合成,最后用TFA 将目标肽段从树脂上切下得到较低纯度的多肽。利用高效液相色谱法(HPLC)纯化目标肽段,使其纯度≥99%,通过超高效液相色谱-质谱联用仪测定纯化合成多肽的分子质量[21]。
1.5 PV13 抑菌活性分析
1.5.1 最低抑菌浓度(MIC)取200 μL 副溶血性弧菌和金黄色葡萄球菌分别加于20 mL 营养肉汤液体培养基中,37 ℃振荡培养13 h 至细菌的对数生长期,再用0.01 mol/L,pH 7.2 的磷酸盐缓冲溶液稀释细菌浓度至106~107CFU/mL。取1 mg 抗菌肽于离心管中,加入1 mL 的磷酸盐缓冲液使其溶解。将稀释过的细菌和抗菌肽等比例混合,使抗菌肽最终质量浓度分别为31.3,62.5,125,250,500 μg/mL,并于37 ℃条件下静置孵育2 h。充分反应后取20 μL 样品涂布,并于37 ℃生化培养箱中培养20 h 后,开始计算菌落总数,以0.01 mol/L,pH 7.2 的磷酸盐缓冲液代替抗菌肽做空白对照[22]。
1.5.2 时间杀伤曲线 取200 μL 副溶血性弧菌于20 mL 营养肉汤液体培养基中,37 ℃振荡培养13 h 至细菌的对数生长期,用0.01 mol/L,pH 7.2的磷酸盐缓冲溶液稀释细菌浓度至106~107CFU/mL。将1×MIC 的抗菌肽与106~107CFU/mL 的副溶血性弧菌等比例混合,以磷酸盐缓冲液代替抗菌肽做空白对照,混匀后的样品置于37 ℃生化培养箱中孵育,而后分别在0,0.5,1.0,1.5,2.0,2.5 h处,取20 μL 样品加样并涂布,37 ℃培养20 h 后开始菌落计数[23]。
1.6 PV13 抑菌机制分析
1.6.1 内膜通透性测定 通过测量副溶血性弧菌细胞质中β-半乳糖苷酶产生的邻硝基酚含量来确定抗菌肽的内膜通透性。首先将对数生长期的细菌置于离心机中离心(8 000 r/min,10 min),使最终菌体沉淀质量大于0.1 g,接着将菌体沉淀重悬于以乳糖作为唯一碳源的M9 培养基中,培养至OD600>0.4。将100 μL 不同浓度抗菌肽(1/2×MIC和2×MIC)、100 μL 菌悬液与10 μL 质量浓度为5 mg/mL 的2-硝基苯基-β-D-半乳吡喃糖苷(O-nitrophenyl-beta-D-galactopyranoside,ONPG)溶液吸取到96 孔板中混匀,立即测定其在波长420 nm 处的吸光值,完成测定后将细胞悬浮液在37℃振荡培养,每1 h 记录一次数据,以0.01 mol/L,pH 7.2 的磷酸盐缓冲液做空白对照[24]。
1.6.2 透射电子显微镜观察 将培养至对数生长期的副溶血性弧菌和抗菌肽PV13 分别用磷酸盐缓冲溶液稀释至106~107CFU/mL 和2×MIC,再按照5∶1 的体积比将二者混合后,于37 ℃培养箱中孵育2 h,用磷酸盐缓冲液代替抗菌肽做空白对照。将充分反应的样品离心(8 000 r/min,10 min),弃上清液取下层沉淀,采用相同的PBS 缓冲液洗涤2 次,体积分数为2.5%戊二醛和1%锇酸溶液进行双重固定。之后使用乙醇溶液对样品进行脱水处理,并在70 ℃条件下加热过夜包埋。最后使用LEICA EM UC7 型超薄切片机得到70~90 nm的切片,切片经柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液各染色5~10 min,晾干后即可用透射电子显微镜观察[25]。
1.6.3 圆二色谱 取抗菌肽于离心管中,分别加入磷酸盐缓冲溶液(0.01 mol/L,pH 7.2)和25 mmol/L 十二烷基硫酸钠(SDS)溶解,使抗菌肽最终质量浓度为0.2 mg/mL,再吸取200 μL 溶解后的抗菌肽置于1 mm 石英比色皿中,在波长为180~260 nm 条件下2 次扫描光谱,扫描速度为130 nm/min,数据以1 nm 为间隔记录,平均扫描时间为5 s[26]。之后用磷酸盐缓冲液溶解后的抗菌肽与副溶血性弧菌基因组DNA 混合,使其质量比为37∶1,并于37 ℃条件下静置孵育2 h。接着稀释样品最终质量浓度为0.2 mg/mL,以SDS 缓冲液稀释的抗菌肽为对照,在圆二色谱仪下扫描,扫描条件如上所述。利用CD-Tool 软件处理扫描数据,分析抗菌肽结构以及与其副溶血性弧菌基因组DNA的结合效果。
1.6.4 DNA 凝胶阻滞 根据DNA 提取试剂盒方法提取副溶血性弧菌基因组DNA,通过在波长260 nm 和280 nm 处的光度密度比(OD260nm/OD280nm≥1.90)来测定基因组DNA 的纯度。取1 mg 抗菌肽于离心管中,加入1 mL 磷酸盐缓冲液溶解,并按照抗菌肽与基因组DNA 质量比为100∶1,50∶1,25∶1,25∶2,25∶4,25∶8 将二者混合,37 ℃条件下孵育2 h。而后加入上样缓冲液,用微量移液器吸取8 μL 加到0.8%琼脂糖凝胶样品槽中进行电泳,利用凝胶成像系统在紫外线照射下观察DNA迁移结果[27]。
1.7 抗菌肽三维结构预测
抗菌肽的三维结构由在线软件I-TASSER(https://zhanglab.ccmb.med.umich.edu/ITASSER/)预测,并在PyMol 2.3 程序中进行编辑和修改,最终得到抗菌肽结构[28]。
1.8 数据分析
每次试验独立平行重复3 次,数据以“平均值±标准偏差”表示,利用软件SPSS 22.0 进行统计分析,单因素方差分析(ANOVA)检验计算结果显著性,P<0.05。
2 结果与分析
2.1 凡纳滨对虾中抗菌肽的鉴定与筛选
采用超高效液相色谱-质谱联用技术从凡纳滨对虾中鉴定出13 个肽段序列(表2),多肽序列平均为20 个氨基酸序列长度,分子质量从1 500~2 500 u。使用在线软件APD3 对肽段序列的电荷数和疏水率进行计算,其净电荷数从-4~+3,疏水率范围从18%~60%,在线软件CAMP 测得13 个肽段的抗菌肽可靠性范围从0~0.873。

表2 凡纳滨对虾中小分子多肽片段的分析筛选Table 2 Analysis and screening of small molecular peptide sequence from Penaeus vannamei
一般来说,抗菌肽的抑菌活性与肽链的长度、净电荷数和疏水性等因素有关[29]。有研究表明,抗菌肽的长度对于维持构象十分重要,通常较长的肽链更有利于形成特殊的二级结构,然而往往许多较短的多肽抑菌活性更强,这些抗菌肽大多由20~30 个氨基酸序列组成,分子质量在2 000~3 000 u 范围内[30-31]。同时,净电荷数也是影响抗菌肽抑菌活性的关键因素之一,阳离子抗菌肽通过和呈负电性的细胞膜之间产生静电吸引作用来发挥抑菌活性,大多电荷数在+2~+9 之内的抗菌肽具有更强的杀菌效果[32-33]。此外,疏水性对抑菌活性的调控也同样重要,在30%~60%范围内,疏水率与抗菌活性成明显的正相关。然而疏水率较小的抗菌肽,其与细菌细胞膜之间的相互作用较弱,渗透性效应减小,而高疏水性的抗菌肽可能导致细胞溶血[34-36]。因此,只有当抗菌肽的序列长度、电荷数和疏水性等因素达到一个相对平衡的状态时,才会发挥最大的抑菌活性[37]。经筛选多肽序列ALPWVLPWALPRALPRVLPR(命名为PV13),其分子质量为2 320 u,疏水率为60%,带3 个净正电荷是满足以上条件的唯一肽段序列,抗菌肽可靠性评估为0.873(图1),接下来对其抑菌活性做进一步探究。

图1 抗菌肽PV13 质谱分析图Fig.1 Mass spectrometry analysis of antimicrobial peptide PV13
2.2 抗菌肽PV13 对副溶血性弧菌的抑菌活性分析
为探究多肽PV13 的抑菌活性,对副溶血性弧菌和金黄色葡萄球菌的最低抑菌浓度进行测定。多肽PV13 对金黄色葡萄球菌几乎无抑菌活性(图2),然而对副溶血性弧菌有较强的抑菌效果。当PV13 质量浓度为125 μg/mL 时,副溶血性弧菌总数减少了约92%;当PV13 质量浓度为62.5 μg/mL 时,副溶血性弧菌减总数少了约81%;当PV13 质量浓度为31.3 μg/mL 时,副溶血性弧菌总数减少了约60%,即随着PV13 浓度减小,细菌总数随之增多(图3),由此可以判断PV13 对副溶血性弧菌的最低抑菌浓度为62.5 μg/mL。

图2 抗菌肽PV13 对金黄色葡萄球菌的最低抑菌浓度Fig.2 Minimum inhibitory concentration(MIC)of antimicrobial peptide PV13 against Staphylococcus aureus
抗菌肽PV13 对革兰氏阴性菌的抑制效果远优于革兰氏阳性菌,这可能是由于细胞外的独特成分导致,革兰氏阳性细菌表面较厚的肽聚糖层使得抗菌肽很难穿透细胞壁[38]。而革兰氏阴性菌细胞膜表面特有的成分脂多糖(Lipopolysaccharide,LPS)为抗菌肽的结合提供了更大的可能性,Shang 等[39-40]证明了抗菌肽可以通过直接结合脂多糖或穿过脂多糖层靶向细胞内功能成分,进而实现对革兰氏阴性菌抑制作用。
从图4 可知PV13 对副溶血性弧菌的生长有明显的抑制效果。没加入抗菌肽之前,细菌的时间杀伤曲线较为平缓,仅在1 h 后有较少的衰亡,加入抗菌肽PV13 后,曲线呈明显的下降趋势,1 h后细菌总数减少了51.7%,2 h 后细菌全部死亡。结果表明,抗菌肽PV13 对副溶血性弧菌具有很高的杀菌效率。与本课题组前期发现的泥蚶血红蛋白抗菌肽TGH1 相比,TGH1 在5 h 后才杀死99.1%的副溶血性弧菌,因此PV13 对副溶血性弧菌的抑菌效率更高[28]。
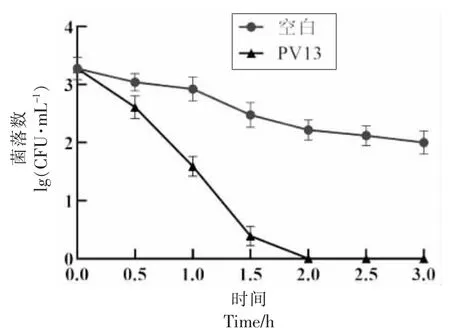
图4 抗菌肽PV13 对副溶血性弧菌的时间杀伤曲线Fig.4 Time-kill curve of antimicrobial peptide PV13 against V.parahaemolyticus
2.3 抗菌肽PV13 对副溶血性弧菌的抑菌机制分析
2.3.1 抗菌肽PV13 对副溶血性弧菌内膜通透性的影响 β-半乳糖苷酶是一种膜内酶,当细胞内膜产生通透性后,磷脂双分子层间的孔洞扩张,β-半乳糖苷酶泄漏到细胞外,将无色的ONPG 降解产生黄色的邻硝基苯酚和半乳糖,因此本研究通过添加ONPG 来评估抗菌肽PV13 对副溶血性弧菌内膜通透性的影响[41]。由图5 可知,细菌吸光度值整体呈上升的趋势,并且随着抗菌肽PV13 浓度的增加,细菌的吸光度也随之增大,这表明PV13 可对副溶血性弧菌的细胞膜通透性产生影响,膜的通透性与PV13 质量浓度成正比。细胞膜是细胞阻碍外界干扰的第一道屏障,因此大多数已知的抗菌肽直接作用于细胞膜,如抗菌多肽Hp1404 就是通过靶向鲍曼不动杆菌的细胞膜,使膜的完整性丧失从而发挥其抗菌活性[42]。然而靶向细胞膜不是抗菌肽唯一的作用机制,抗菌肽NP-6 通过破坏大肠杆菌细胞膜,抑制了β-半乳糖苷酶的活性,并与其DNA/RNA 结合[43];BO18 也通过穿透溶藻弧菌细胞膜,结合细菌基因组DNA和总RNA 发挥抑菌活性[44]。然而,抗菌肽PV13 是否也可以靶向胞内成分尚不清楚。

图5 抗菌肽PV13 对副溶血性弧菌的内膜通透性Fig.5 Inner membrane permeability of V.parahaemolyticus treat with antimicrobial peptide PV13
2.3.2 副溶血性弧菌超微结构变化 为进一步探究抗菌肽PV13 对副溶血性弧菌细的作用机制,通过透射电子显微镜观察菌体的微观结构变化。如图6 所示,未经处理的正常细菌表面完整光滑,组织分布均匀,无内容物流出(图6a)。而经抗菌肽PV13 处理后,副溶血性弧菌表面变的模糊,细胞膜部分区域变薄,细胞开始萎缩和变形(图6b),证实抗菌肽PV13 可以对副溶血性弧菌细胞膜造成损伤,迫使细胞膜通透性增加,从而加快了细胞内容物的流出和抗菌肽的进入。

图6 副溶血性弧菌的透射电镜图像Fig.6 Transmission electron microscopy images of V.parahaemolyticus
由于阳离子型抗菌肽与阴离子型磷脂之间有较高的亲和力,所以当抗菌肽平行或插入细胞膜后会导致磷脂双分子层中形成一定的 “自由空间”,从而容纳更多的抗菌肽。这种现象将直接使细胞膜变薄,膜流动性增加,进而导致细胞膜脂质成分重排,边界产生缺陷[45]。抗菌肽P7 也是采用类似的抑菌机制杀灭沙门氏菌,即通过改变沙门氏菌细胞膜的流动性,使抗菌肽进入胞内并在细胞质中积累,从而诱导细胞内容物流出,引起细胞膜通透性增加和变形[46]。而抗菌肽PV13 对副溶血性弧菌的细胞膜并未产生剧烈的破坏作用,结合时间杀伤曲线和细胞膜通透性结果来看,其可能存在胞内作用机制,因此,对其DNA 结合活性做进一步探索。
2.3.3 抗菌肽PV13 与菌体基因组DNA 的相互作用 通过DNA 凝胶阻滞试验来表征抗菌肽PV13 与副溶血性弧菌基因组DNA 之间的相互作用。未处理的细菌基因组DNA,凝胶电泳图谱显示清晰明亮的DNA 条带,而经抗菌肽PV13 处理过的基因组DNA,条带亮度随着PV13 质量浓度的增大而变暗,说明PV13 可以直接与副溶血性弧菌的基因组DNA 结合,且结合程度与PV13 的质量浓度成正相关(图7),这与Yi 等[47]的研究发现一致,大肠杆菌O157:H7 基因组DNA 条带随着ZP37 浓度的增加而消失。
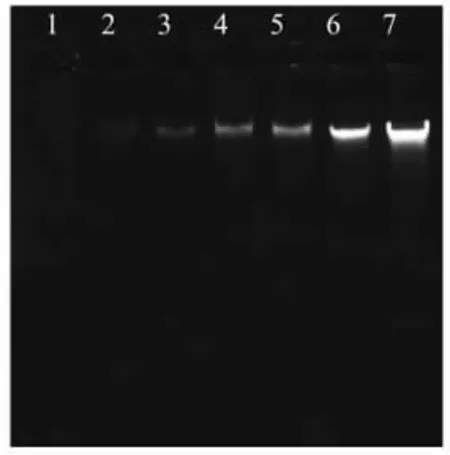
图7 凝胶阻滞分析抗菌肽PV13 与DNA 的相互作用Fig.7 Gel retardation analysis of the interaction between antimicrobial peptide PV13 and DNA
抗菌肽与细菌基因组DNA 的结合可以抑制或阻碍细胞基因表达,阻断酶和受体正常合成,进而使细胞生命周期所需物质供应不足,导致细胞死亡[48]。本课题组前期从大黄鱼乳清酸性蛋白中发现的抗菌肽LCWAP 就具有DNA 结合活性,LCWAP 首先通过聚集在细胞表面,破坏细菌细胞膜的完整性,使细胞内容物泄漏形成空泡化,进入细胞后再与基因组DNA 结合,导致细菌死亡[49]。苏冠芳等[50]也发现buforin II 采用类似于“孔”型机制穿过磷脂双分子层进入金黄色葡萄球菌胞内,并以嵌入的方式与DNA 合成相关基因特异性结合,从而阻止细胞分裂达到抑菌目的。由此可以推断,抗菌肽除了利用膜损伤机制杀灭细菌之外,DNA 结合活性也是抗菌肽杀灭细菌的有效途径。
2.3.4 抗菌肽PV13 的结构分析 基于左旋和右旋圆偏振光吸收的差异,圆二色谱已被广泛应用于研究生物分子的构象,特别是用于研究生物分子在各种环境中的构象变化[51]。远紫外(175~260 nm)范围内的圆二色性(CD)光谱是研究溶液中蛋白质结构的既定方法,因为构成所有蛋白质和寡肽骨架的肽键的构象在远紫外区有特定的CD 信号[52]。本课题组前期研究表明,在不同溶液环境中,抗菌肽呈现不同的结构状态,其抑菌活性也各不相同[53]。如图8 所示,溶于PBS 的抗菌肽PV13在波长199 nm 处有1 个正峰;在SDS 溶液中,多肽在波长188 nm 处有1 个较小的正峰,在波长202 nm 和223 nm 处分别有2 个明显的负峰,其峰形发生明显变化,而以上2 种峰形都属于无规则卷曲结构,这可能是因为抗菌肽PV13 序列上存在多个脯氨酸,由于脯氨酸的亚氨基缺少1 个氢原子,分子无法形成氢键,C-N 键无法旋转,因此脯氨酸的存在会导致抗菌肽无法形成α-螺旋和β-折叠等特殊结构[54]。

图8 不同溶液中抗菌肽PV13 的二级结构分析Fig.8 Secondary structure analysis of antimicrobial peptide PV13 in different solutions
抗菌肽的二级结构与抑菌活性密切相关,一般来说具有特殊结构的抗菌肽(α-螺旋、β-折叠)的抑菌活性更强[55],而并非所有抗菌肽都具有特殊的二级结构,对于富含脯氨酸的多肽,结构呈楔形状,当多肽插入磷脂双分子层后,可进入细胞内发挥其抑菌活性[56]。例如,富含脯氨酸的磁蓖麻毒素通过与RNA 结合,特异性地抑制蛋白质翻译,从而导致蛋白质合成受到阻碍并最终导致细胞死亡[57]。以上结果表明,DNA 结合活性可能是富含脯氨酸的无规则卷曲抗菌肽的重要抑菌途径之一。
此外,抗菌肽PV13 的一级结构是由重复的氨基酸序列串联而成,即每隔2 个氨基酸就会出现亮氨酸和脯氨酸,形成X(LP)X 的规律(图9)。有研究表明,含有2 个或2 个以上重复序列的多肽是产生抑菌活性所必需的条件。Sadler 等[58]把抗菌肽Bac 7 中大量的脯氨酸-精氨酸(PR)重复区域切除,无论其电荷或疏水含量如何改变,都无法产生抑菌活性。由此推测,重复的亮氨酸-脯氨酸(LP)区域可能是产生抑菌活性的功能区域,这为抗菌肽的设计提供了新的思路。
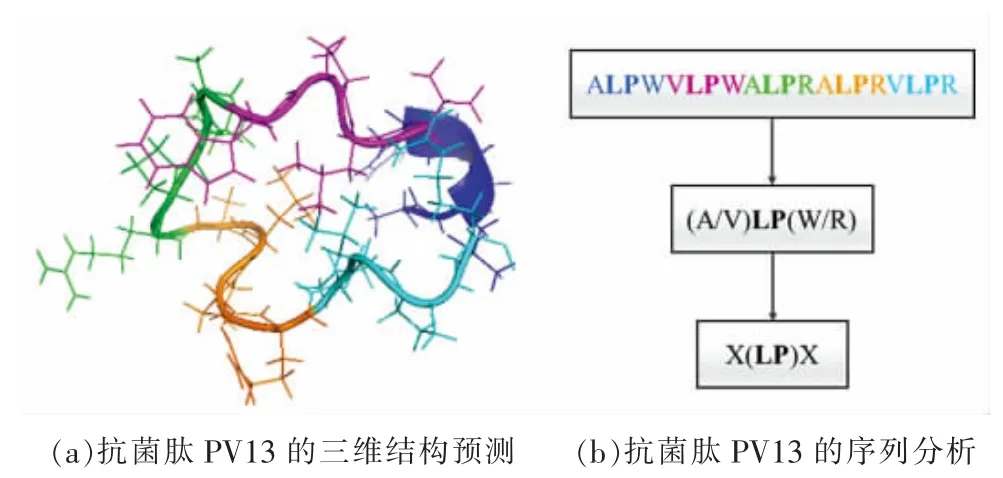
图9 抗菌肽PV13 的三维结构预测及序列分析Fig.9 Three dimensional structure prediction and sequence analysis of antimicrobial peptide PV13
2.3.5 圆二色谱分析PV13 与菌体基因组DNA 的相互作用 圆二色谱是评价多肽二级结构的重要工具[59]。Satish 等[60]利用圆二色谱法来监测抗菌肽GDNF 与糖胺聚糖分子形成复合物过程中的多肽构象变化,Contini 等[61]也采用相同的方法揭示了寡聚体与DNA 具有形成复合物的能力。由图10可以看出,加入副溶血性弧菌基因组DNA 后,圆二色谱吸收峰强度发生变化,而位移并没有明显改变,主要还是停留在波长200 nm 附近的无规则卷曲结构,说明PV13 和副溶血性弧菌基因组DNA 相互作用后,改变了PV13 的构象,从而使圆二色谱发生变化,并且此结果也与DNA 凝胶阻滞试验结果相吻合,进一步证实了抗菌肽PV13 可以结合副溶血性弧菌基因组DNA 来发挥抑菌活性。

图10 抗菌肽PV13 与副溶血性弧菌基因组DNA结合的圆二色谱Fig.10 Circular dichroism of antimicrobial peptide PV13 binding with genomic DNA of V.parahaemolyticus
含有α-螺旋和β-折叠等特殊二级结构的抗菌肽更容易与细胞膜发生相互作用[62]。如抗菌肽PaDBS1R6 的螺旋度与其对大肠杆菌细胞膜的亲和力成正比[63]。而无规则卷曲的抗菌肽由于没有特殊的二级结构,因此DNA 结合活性往往是其主要的抑菌作用形式[64]。这与抗菌肽buforin II 酰胺具有某些相似之处,二者都呈现无规则卷曲结构并通过结合基因组DNA 来展现抑菌活性[65]。因此,PV13 作为一种富含脯氨酸的阳离子抗菌肽,其抑菌机制可能是通过增加细菌细胞膜内膜通透性,引起细胞膜部分区域变薄,再利用亮氨酸-脯氨酸的活性功能域穿透副溶血性弧菌细胞膜进入到胞内,结合基因组DNA 来杀灭细菌。
3 结论
本研究从凡纳滨对虾体内鉴定出13 种分子质量介于1 500~3 000 u 的多肽序列,经分析筛选得到一种新型抗菌肽PV13。抗菌肽PV13 对副溶血性弧菌的最低抑菌浓度为62.5 μg/mL,可在2 h内将细菌全部杀死,具有良好的杀菌效果。抗菌肽PV13 通过增加细胞膜内膜通透性,使得细胞膜部分区域变薄,进而利用亮氨酸-脯氨酸(LP)活性功能域快速进入胞内,采用与细菌基因组DNA 相结合的方式,实现其对副溶血性弧菌的抑菌活性。本研究为抗菌肽的筛选与设计提供了参考,同时也为抗菌肽PV13 作为食品新型防腐剂的应用提供了理论支持。
