不同提取方式的柚皮果胶对小鼠结肠炎的缓解作用
2023-08-18崔洁芬赵成英郑金铠
崔洁芬,赵成英,王 凤,郑金铠*
(1 青岛农业大学食品科学与工程学院 山东青岛 266109 2 山东省特种食品技术创新中心 山东青岛 266109 3 青岛特种食品研究院 山东青岛 266109 4 中国农业科学院农产品加工研究所 农业部农产品加工重点实验室 北京 100193)
溃疡性结肠炎会导致结肠黏膜的损伤,临床上表现为腹痛、腹泻以及便血等症状。该病具有反复性,且当机体长期处于慢性炎症状态时,易发展成结肠癌[1-3]。溃疡性结肠炎与多种因素密切相关,如遗传因素、免疫功能缺陷、肠道菌群失调等[4]。目前,溃疡性结肠炎的治疗方法包括炎症抑制剂、免疫抑制剂以及生物抑制剂等。这些治疗方法虽有一定效果但也伴随着复杂的副作用和毒性[5]。寻找新的替代干预手段来预防溃疡性结肠炎迫在眉睫。
研究表明果胶等膳食纤维可以缓解小鼠的回肠炎[6]和胰腺炎[7],且安全、无副作用。柑橘皮渣是商业果胶的重要来源[8]。从结构上来讲,柑橘果胶主要由同聚半乳糖醛酸(HG)、鼠李半乳糖醛酸聚糖I(RG-I)和鼠李半乳糖醛酸聚糖II(RG-II)组成[9]。除了被用作增稠剂、凝胶剂和乳化剂外,柑橘果胶还具有多种生物活性,包括调节肠道菌群[10],缓解非酒精性脂肪肝[11]和改善肠道炎症[12]。
柑橘果胶虽然可以缓解结肠炎,但是其结构具有可变性,可能会导致其发酵特性差异较大[12],进而影响其生物活性。此外,柑橘果胶的提取方法对其结构和功能特性有很大影响[13]。在本课题组之前的研究中,采用碱、纤维素酶、碱+纤维素酶分别提取柚皮果胶(分别为P10、C、P10+C),结果发现3 种柚皮果胶在一级结构和空间构象上都存在显著差异。体外发酵试验表明,P10+C 的紧密构象有助于短链脂肪酸(SCFAs)的产生,有益肠道微生物的增殖和潜在致病菌的抑制[14]。由于结肠炎患者的肠道菌群失调与SCFAs 的产生密切相关[15],故推测P10+C 可能对溃疡性结肠炎具有更好的缓解作用。
本文以碱、纤维素酶和碱+纤维素酶3 种提取方法得到的柚皮果胶(P10、C、P10+C)为对象,研究不同柚皮果胶对葡聚糖硫酸钠(DSS)诱导的小鼠急性结肠炎的缓解作用,并探讨提取方法、结构特性和对小鼠急性结肠炎的影响,为柚皮果胶的提取-结构-功能间关系提供科学依据,为精准营养提供理论支撑,同时为结肠炎的预防提供新思路。
1 材料与方法
1.1 实验动物、材料与试剂
6 周龄雌性C57BL/6N 小鼠(16~20 g),北京维通利华实验室。动物饲养环境温度为(22±2)℃,相对湿度为(55±10)%,光照/黑暗周期为12 h/12 h。
柚子皮(Citrus paradisi),中国台州柑橘水果罐头工厂;柚皮果胶P10、C、P10+C,根据本实验室报道的方法制得,其结构参数见表1;葡聚糖硫酸钠(DSS:36~50 ku),上海益盛生物科技有限公司;白细胞介素-10(IL-10)、IL-6、IL-1β 和肿瘤坏死因子-α(TNF-α),上海生工生物工程股份有限公司;4%多聚甲醛固定液和卡诺氏固定液,武汉塞维尔生物科技有限公司;其它试剂均为分析纯级。

表1 不同提取方法得到的柚皮果胶的结构特性[14]Table 1 Structural characteristics of grapefruit pectins extracted by different methods[14]
1.2 仪器与设备
磁力搅拌器RHD S25,德国IKA 公司;多功能微孔板检测仪酶标仪,瑞士Tecan 公司;高通量组织研磨仪,上海林嘉科教仪器有限公司;水浴锅BWS-5,上海一恒科学仪器有限公司;pH S-25 数显pH 计,上海精密科学仪器有限公司;倒置相差显微镜IX71,日本Olympus 公司。
1.3 实验方法
1.3.1 动物实验设计 经过适应性喂养7 d 后,将小鼠随机分为正常组、模型组、P10 组、C 组和P10+C 组,每组10 只小鼠。正常组和模型组小鼠每天灌胃饮用水,其余组小鼠每天灌胃相应的果胶,灌胃剂量为200 mg/kg。21 d 后,除正常组外,给其余组小鼠饮用水中加入2.5%DSS,混合均匀,连续饮用7 d 后,处死小鼠。立即采集结肠、脾脏和血液等样本,待测。
1.3.2 体质量和疾病活动指数(DAI)实验期间每天记录小鼠体质量和粪便情况。DAI 是评价小鼠结肠炎严重情况的常用指标。根据文献[16]报道的DAI 计算方法,每天记录各组小鼠体质量的变化、粪便出血情况和粪便硬度,具体的评分标准如下:体质量减轻比例(0 为无减轻;1 为1%~5%;2为5%~10%;3 为10%~20%;4 为>20%);粪便出血(0=未出血;1=略微带血;2=一些带血;3=较多带血;4=大量带血);粪便硬度(0=正常粪便;1=轻微稀便;2=稀便;3=水样粪便;4=严重拉稀)。
1.3.3 炎症因子检测 根据ELISA 试剂盒提供的方法检测结肠中IL-10、IL-6、IL-1β 和TNF-α 的含量。具体步骤为:结肠用预冷的PBS 冲洗,称重后将其剪成小块。将剪碎的结肠组织与PBS 按照1 ∶9(g/mL)加入匀浆器中,在冰上充分研磨均匀。最后将匀浆液在8 000 r/min 转速下离心15 min得到上清液,进行相关炎症因子的检测。
1.3.4 结肠组织病理学观察 结肠组织用4%多聚甲醛固定液固定48 h。用乙醇进行梯度洗脱,包埋好后冷却,将蜡块切成薄片。将石蜡切片脱蜡至水后,将切片放入苏木精(HE)染液染色5 min,用自来水冲洗后,用分化液分化,再用自来水冲洗,返蓝液返蓝,流水冲洗。将切片依次放入85%和95%的乙醇中各脱水5 min,然后放入伊红染液中染色5 min。切片经无水乙醇脱水,二甲苯透明后,用中性树胶封片[17-18]。在显微镜下观察并采集图像。观察结肠杯状细胞,结肠组织用卡诺氏固定液固定48 h。将制备好的切片放入阿利新蓝-过碘酸雪夫(AB-PAS)染液中染色,流水冲洗。切片经脱水后用中性树胶封片。在显微镜下观察,采集图像。
1.3.5 肠道菌群检测 采集各组小鼠的新鲜粪便,用于肠道菌群的检测。小鼠粪便提取DNA 后,通过PCR 扩增获得PCR 产物,PCR 产物用于构建微生物多样性测序文库,在Illumina Miseq PE300(Illumina,Inc.,USA)高通量测序平台进行Paired-end 测序。测序原始序列上传至NCBI 的SRA 数据库。下机数据经过QIIME1 软件根据Barcode 序列拆分样本。使用Pear 软件对原始数据进行筛选和匹配。用软件对数据进行过滤、拼接。去除分值低于20 且含有模糊碱基,引物错配的序列。拼接时最小overlap 设置为10 bp,错配率为0.1%。合格的读取序列使用特定样本的条形码序列进行分离,并使用Illumina Analysis Pipeline进行修剪。使用QIIME 分析数据集,Usearch 对优质序列进行OTU 聚类,OTU 相似性设置为97%。使用Python 进行Kruskal-Wallis 检验,P<0.05 认为差异显著。
1.3.6 短链脂肪酸检测 在小鼠的盲肠内容物中按照1∶3(g/mL)比例加入超纯水匀浆。10 000 r/min 低温离心30 min,收集上清液。取100 μL 的250 g/L 的偏磷酸与500 μL 的上清液混合均匀,静置0.5 h,10 000 r/min 离心30 min,取上清液100 μL 加入100 μL 的色谱级的50%乙醇。使用气相色谱-火焰离子化检测器检测短链脂肪酸的含量。
1.4 数据处理与统计分析
所有实验均做3 次平行,结果用“平均值±标准差”表示。采用SPSS 18.0 软件进行方差分析,样本间比较采用单因素方差分析(ANOVA)和最小显著差异(LSD)检验,P<0.05 为统计学上的差异显著。
2 结果与分析
2.1 不同结构柚皮果胶缓解小鼠结肠炎的效果差异比较
小鼠饮用DSS 水实验期间的体质量变化如图1a 所示。可以看出饮用DSS 水第7 天时,与正常组小鼠相比,模型组小鼠体质量显著降低(P<0.05),降低为初始体质量的80.34%。柚皮果胶组小鼠体质量下降最少的依次为P10+C(96.99%),P10(91.16%)和C(83.30%)。可以看出P10+C 对减缓小鼠体质量下降的效果最好。各组小鼠的DAI 结果如图1b 所示。与正常组(0 分)相比,模型组(9.7 分)的DAI 评分显著升高(P<0.05),表明DSS 诱导了严重的结肠炎。柚皮果胶C 组小鼠的评分最高(8.9 分),P10+C 组小鼠的评分最低(1.4分)。因此碱+纤维素酶提取的柚皮果胶P10+C 对于抑制小鼠体质量的减轻、腹泻和粪便出血效果显著。当机体出现各种急慢性炎症时,会导致炎性细胞浸润,进而诱发脾脏肥大[16]。由图1c 可知,与正常组相比,模型组的脾脏指数显著增加(P<0.05)。与模型组相比,所有柚皮果胶组小鼠的脾脏指数都显著降低(P<0.05),说明柚皮果胶可以不同程度缓解DSS 诱导的脾脏肥大。其中,P10+C组小鼠的脾脏指数降低最为显著(P<0.05),说明P10+C 可以有效预防DSS 引起的脾脏肥大。
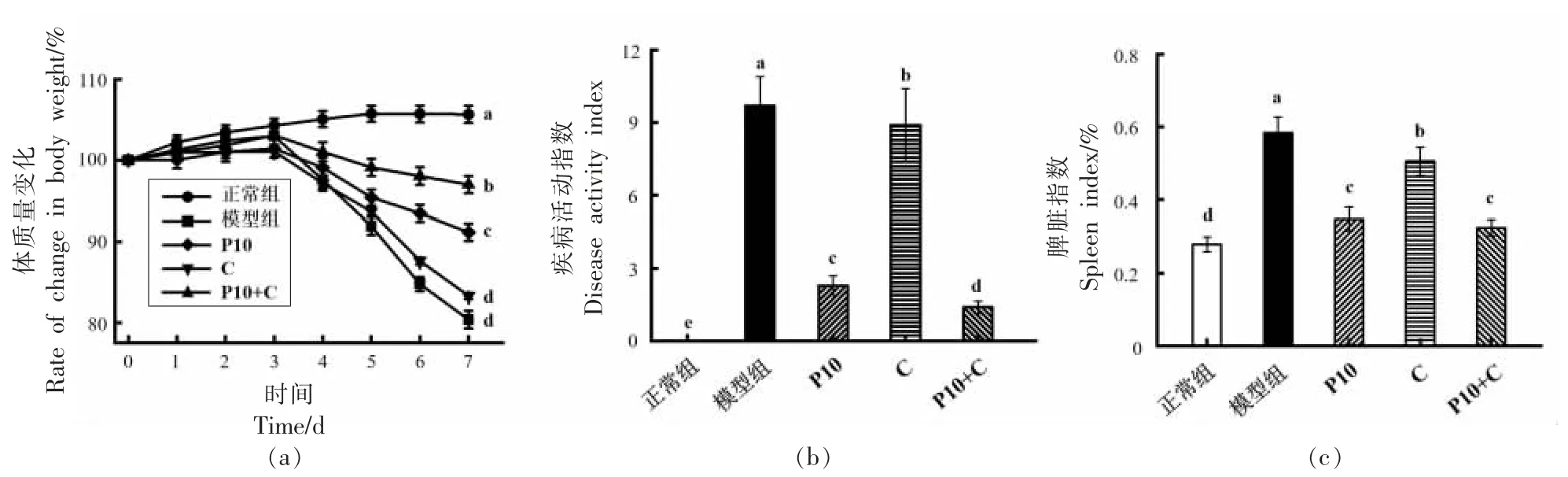
图1 不同组小鼠的体质量(a)、第7 天小鼠疾病活动指数评分(b)、脾脏指数(c)的变化Fig.1 The change of body weight of the mice in different groups(a),DAI score of the mice on day 7(b),spleen index of the mice in different groups(c)
2.2 不同柚皮果胶对结肠炎小鼠结肠结构的影响
小鼠结肠缩短是黏膜炎症和水肿的重要指标[19]。与正常组相比(7.9 cm),模型组(5.5 cm)的结肠长度明显缩短(P<0.05),且结肠出现明显的红肿、充血(图2a)。柚皮果胶P10+C 效果最好,结肠未出现明显缩短和红肿、充血,说明P10+C 可以有效预防DSS 诱导的结肠缩短和炎症现象。进一步通过组织病理学观察评估结肠损伤的严重程度。如图2b 所示,正常组结肠组织的HE 染色图像有整齐的绒毛和完整的隐窝结构,无充血、红肿及溃疡。模型组小鼠的结肠黏膜严重损伤,表现为上皮破坏,隐窝缺失和炎症细胞浸润。与模型组相比,柚皮果胶均不同程度地缓解了DSS 对结肠结构的破坏。然而,除P10+C 以外,其它果胶干预组小鼠的结肠隐窝都有变形且都有不同程度的黏膜上皮细胞缺失。此外,P10+C 的组织病理学评分最低,其余依次是P10 和C。说明P10+C 能更有效地缓解DSS 引起的小鼠结肠黏膜受损,隐窝破坏和炎症浸润现象。
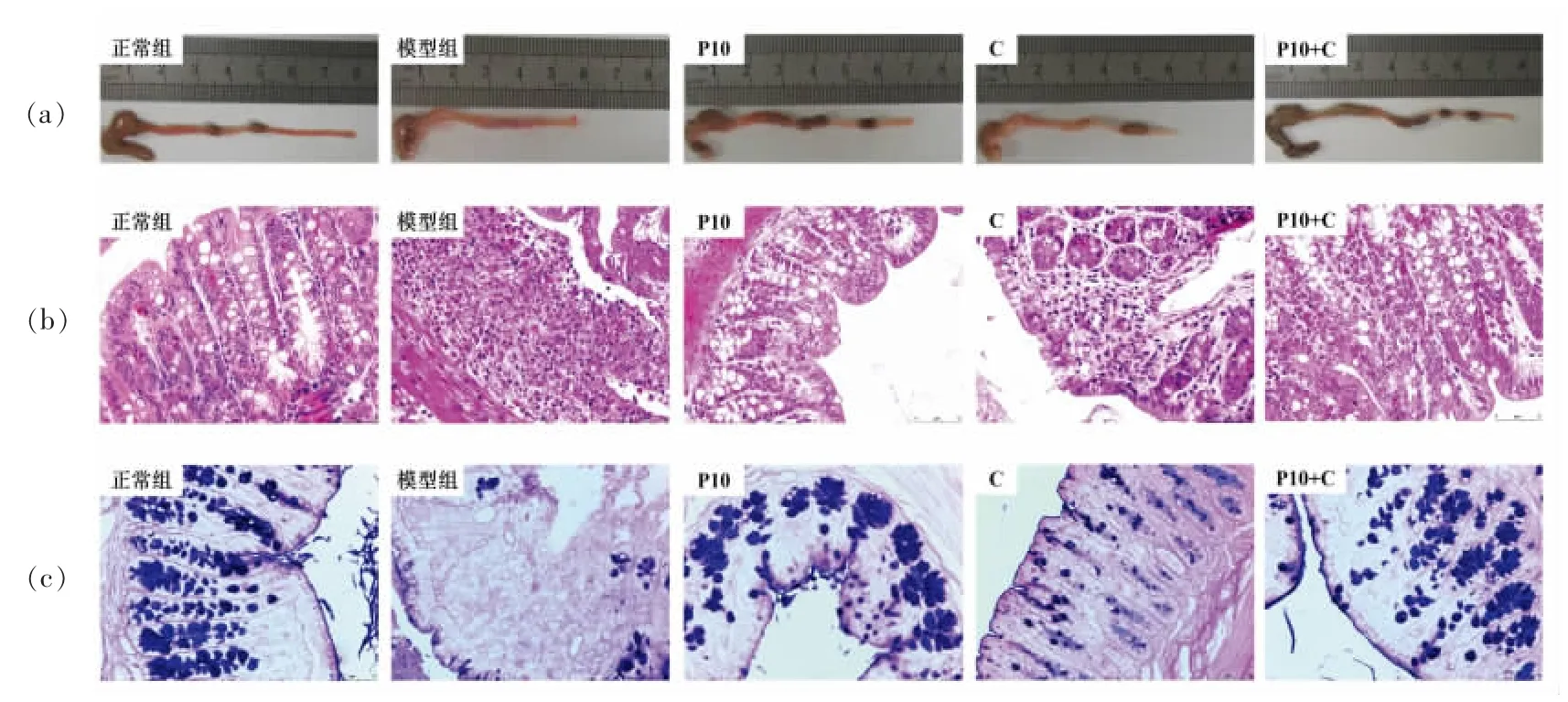
图2 小鼠结肠的外观(a)、HE 染色(b)、AB-PAS 染色(c)的图片Fig.2 Images of the gross colon appearance(a),HE stained sections(b),and AB-PAS stained sections(c)
杯状细胞在维护肠道黏膜的完整性方面发挥着重要作用[20]。如图2c 所示,正常组小鼠的结肠中杯状细胞较多,没有炎症浸润和黏膜糜烂的现象。模型组小鼠的肠道黏膜被破坏,大部分杯状细胞缺失,且模型组小鼠结肠中的杯状细胞数量显著低于正常组小鼠。对于柚皮果胶干预组来说,P10+C 组小鼠的杯状细胞数量最多,形态正常,无炎症浸润和溃疡的出现,且杯状细胞数量与正常组相比无显著性差异,而其它的柚皮果胶组的杯状细胞都有不同程度的损伤及减少。因此,P10+C可以显著抑制DSS 引起的结肠隐窝变形,杯状细胞减少和黏膜层的破坏,有效地保护肠道屏障。
2.3 不同柚皮果胶对结肠炎小鼠炎症因子的影响
IL-10 是一种抗炎因子,在免疫反应和肠道炎症中发挥重要作用[16]。如图3a 所示,与正常组相比,模型组小鼠的结肠IL-10 水平显著降低(P<0.05)。与模型组相比,柚皮果胶P10+C 的结肠IL-10 水平显著增加(P<0.05),说明P10+C 可以有效刺激机体的免疫细胞产生抗炎因子。IL-1β 和IL-6 是促炎细胞因子,它们的过度表达会引起机体出现炎症[21-23]。如图3b 和3c 所示,与正常组相比,模型组小鼠的结肠IL-1β 和IL-6 水平显著升高(P<0.05)。柚皮果胶中,P10+C 组小鼠的结肠IL-1β 和IL-6 水平最低,说明P10+C 可以有效抑制炎症因子IL-1β 和IL-6 的表达,有效缓解DSS小鼠的肠道炎症。如图3d 所示,与正常组相比,模型组小鼠结肠组织中TNF-α 的水平显著升高(P<0.05)。与模型组相比,碱+纤维素酶提取的柚皮果胶P10+C 的结肠TNF-α 水平在所有果胶样品中最低,且与正常组相比,均无显著差异(P>0.05),柚皮果胶P10+C 说明可以有效抑制DSS 引起的TNF-α 含量升高,且可以恢复到正常水平。因此,柚皮果胶P10+C 可以显著提高抗炎因子的水平,同时抑制促炎因子的分泌,进而有效缓解结肠炎小鼠的肠道炎症。

图3 不同柚皮果胶对炎症因子的影响Fig.3 Effect of different grapefruit pectins on the levels of inflammatory cytokines
2.4 不同柚皮果胶对结肠炎小鼠肠道菌群的影响
正常生理状态下,肠道菌群处于动态平衡,当肠道菌群的这种动态平衡遭到破坏时,便会引起一系列的肠道炎症[24-26]。如图4a 所示,Chao 1 代表菌种的丰富度指数,与正常组相比,模型组的Chao 1 指数显著降低(P<0.05),说明DSS 引起了结肠炎小鼠的肠道菌群丰富度降低。与模型组相比,柚皮果胶C 的Chao 1 指数并无显著性差异(P>0.05),说明纤维素酶提取的柚皮果胶并不能提高结肠炎小鼠的肠道菌群丰富度。而碱+纤维素酶提取的柚皮果胶P10+C 的Chao 1 指数与模型组相比显著升高(P<0.05),且达到了与正常组相当的水平(P>0.05)。Shannon 指数可以用来评估菌群多样性,由图4b 可以看出,与正常组相比,模型组的Shannon 指数显著降低(P<0.05),说明结肠炎小鼠的肠道菌群多样性遭到了严重破坏。与Chao 1 指数类似,P10+C 的Shannon 指数与模型组相比显著升高(P<0.05),且与正常组相比无显著性差异(P>0.05)。通过以上分析,可以得出P10+C 能提高结肠炎小鼠的肠道菌群丰富度和多样性,缓解DSS 引起的肠道菌群紊乱。
不同组小鼠的肠道菌群在门水平的组成情况如图4c 所示。与正常组相比,模型组小鼠的厚壁菌门(Firmicutes)和疣微菌门(Verrucomicrobia)明显减少,拟杆菌门(Bacteroidetes)明显增加。有研究表明健康受试者肠道菌群中的疣微菌门的相对丰度较高[27]。模型组中疣微菌门丰度的显著降低也说明了小鼠的肠道健康受到了破坏。与模型组小鼠相比,碱+纤维素酶提取的果胶P10+C 组小鼠的疣微菌门的相对丰度增加最为明显。因此,P10+C 可以在门水平上有效调节结肠炎小鼠的肠道菌群。不同组小鼠在属水平的肠道菌群组成的差异如图4d 所示,与正常组小鼠相比,模型组小鼠的肠道菌群中的阿克曼菌(Akkermansia)、严格梭状芽胞 杆菌-1(Clostridium_sensu_stricto_1)、毛螺旋菌 NK4A136(Lachnospiraceae_NK4A136_group)、乳酸杆菌(Lactobacillus)、瘤胃球菌UCG-014(Ruminococcaceae_UCG-014)的相对丰度显著降低(P<0.05)。阿克曼菌是一种对肠道健康有益的细菌,可以减少结肠炎小鼠的慢性炎症并恢复肠道屏障的正常功能[28],而其它细菌是短链脂肪酸的产生者。与模型组小鼠相比,柚皮果胶P10+C 组小鼠肠道菌群中的阿克曼菌和SCFAs 产生菌的相对丰度显著升高(P<0.05),因此P10+C 可以有效缓解DSS 引起的结肠炎小鼠的肠道菌群失调,促进肠道有益菌的增加,从而有效缓解肠道炎症。
2.5 不同柚皮果胶对结肠炎小鼠短链脂肪酸的影响
柑橘果胶对胃和小肠中存在的内源性消化酶具有抗性,然而在大肠中可被肠道菌群发酵生成短链脂肪酸(SCFAs)。研究表明SCFAs 可以调节结肠上皮细胞的通透性和肠道屏障的功能,缓解肠道炎症[29]。为探究不同柚皮果胶在结肠炎小鼠体内的代谢差异,进一步测定了小鼠盲肠内容物中的SCFAs 含量。如图5 所示,模型组小鼠的乙酸、丙酸、正丁酸和总SCFAs 水平与正常组相比显著降低(P<0.05)。柚皮果胶处理组小鼠的盲肠内容物中,短链脂肪酸的水平均比模型组小鼠高。其中P10+C 组小鼠的SCFAs 水平最高,说明P10+C 能调节肠道菌群,使其更好地利用底物,产生更多的SCFAs。肠道菌群之间存在着高度的竞争,取得竞争优势的细菌,能产生特异性很高的酶,从而有效水解底物[30]。与其它果胶相比,P10+C的构象更加紧凑、Rc 值最大,有利于细菌与果胶链的结合,产生足够的果胶水解酶来水解果胶,进而产生更多的短链脂肪酸。
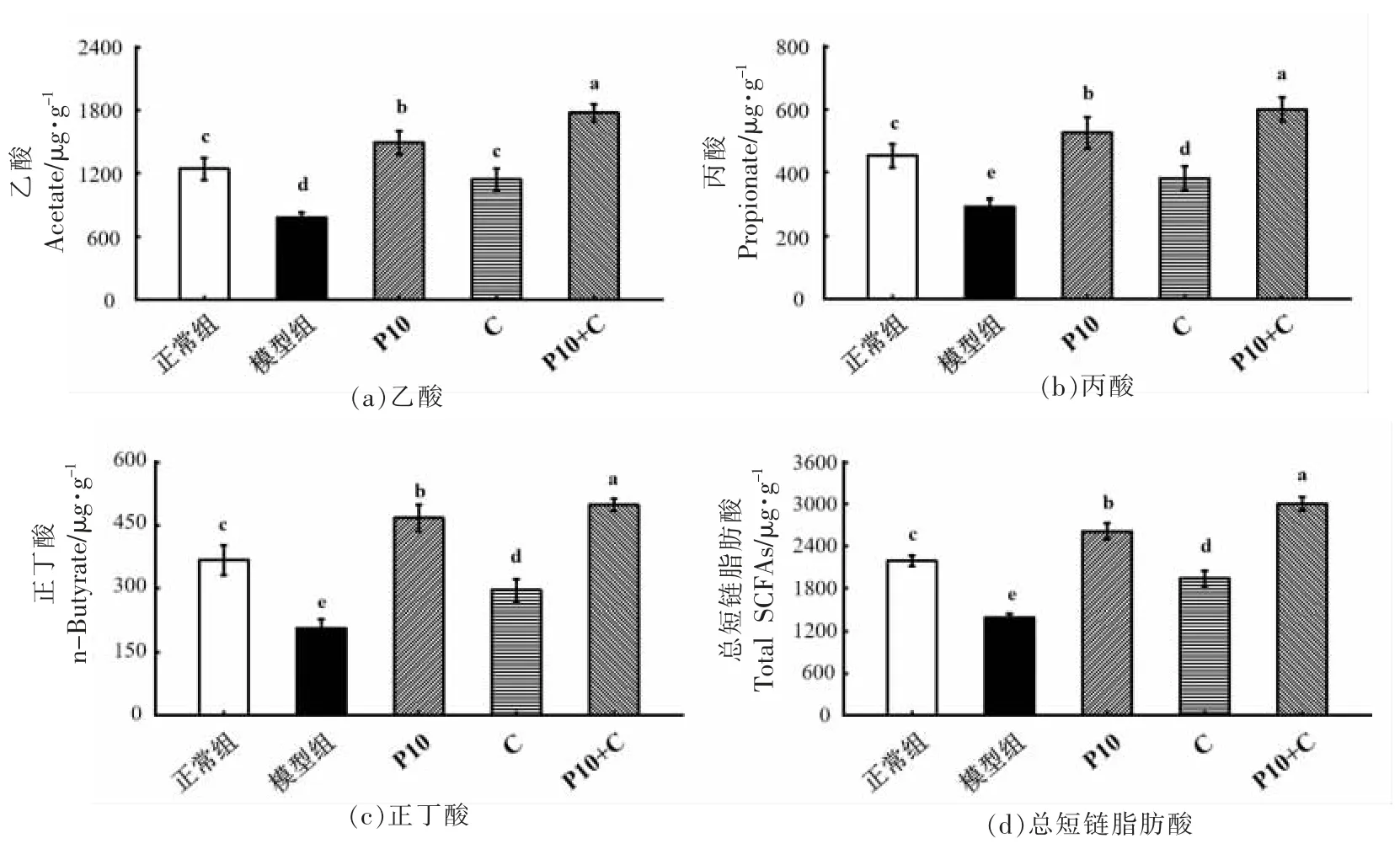
图5 不同组中小鼠盲肠内容物的短链脂肪酸水平Fig.5 SCFAs level in cecal content of the mice in different groups
3 结论
本文探究了3 种柚皮果胶P10、C 和P10+C对DSS 诱导的小鼠急性结肠炎的缓解作用。其中碱+纤维素酶提取的柚皮果胶P10+C 对小鼠结肠炎的缓解作用最好。P10+C 显著减缓了结肠炎小鼠体质量减少,降低了疾病活动指数及脾脏肥大,缓解了结肠缩短、隐窝破坏、杯状细胞减少,有效保护了结肠炎小鼠的肠道屏障。P10+C 显著促进了抗炎因子的水平,同时抑制了促炎因子的分泌。16S 测序表明P10+C 提高了结肠炎小鼠的肠道菌群多样性,提高了肠道有益菌阿克曼菌和短链脂肪酸产生菌的相对丰度,促进了SCFAs 的产生,进而有效缓解了小鼠结肠炎。
