狭叶白蜡秋季叶片呈色生理变化研究
2023-08-17王燕龙车晓雨李彦慧王金鑫王纪明
王燕龙,车晓雨,李彦慧,王金鑫,王纪明
(园林与旅游学院,河北农业大学,河北 保定 071000)
彩叶植物,是指在一定季节或常年叶片呈现稳定的非绿色的、有明显观赏价值的植物[1]。与花色的重要性一样,叶色也是植物重要的观赏性状[2]。彩叶植物体内色素含量受特定因素的影响而发生变化,尤其是类胡萝卜素或花青素苷与叶绿素的比例变化导致叶片呈现红色或黄色[3]。发达国家从事彩叶植物的栽培与应用已有百年以上的历史。在美国、加拿大等国家,彩叶树种的种植面积可达到树木总量的30%以上。
色素主要有3 大类:一为叶绿素类,主要有叶绿素a、叶绿素b;二为类胡萝卜素类,主要有类胡萝卜素和叶黄素;三为类黄酮类色素,又称为花色素苷。不同的色素在外观上表现为不同的颜色,普通叶片中叶绿素比类胡萝卜素多,所以叶片总是呈现绿色。研究表明,类黄酮、花青素和类胡萝卜素的组合可增加叶片颜色的多样性。银杏(Ginkgo bilobaL.)、金钱松(Pseudolarix amabilis)等叶片含有较多的类胡萝卜素而呈现黄色;鸡爪槭(Acer palmatum Thunb)、三 角 枫(Acer buergerianumMiq)等花青素含量升高时呈现红色[4-5]。雁来红(Amaranthus tricolor)秋季叶片由紫色转变为鲜红色也是由于细胞衰老、叶绿素减少,使花青素的颜色显示出来的结果[6]。类胡萝卜素和花青素也在光系统的光保护中起着重要的作用,这有利于植物适应环境并在叶片衰老期间维持其内部机制的正常运行。研究认为,可溶性糖、PAL、PPO、POD 等在不同程度上影响着花色素苷的合成与降解[7]。
狭叶白蜡(Fraxinus angustifolia)是木犀科白蜡属植物,落叶乔木,原产欧洲西南部、非洲北部,树形优美,秋季叶色呈现紫红色,可作行道树或者与其他园林树木相搭配组成园林绿地,观赏价值极佳[8]。但是,有关于狭叶白蜡的研究还处于起步阶段,尤其是叶色变化过程中的生理指标鲜有报道。因此,本研究以狭叶白蜡为试验材料,测定其在秋季叶色变化过程中的叶色参数、色素含量、抗坏血酸-谷胱甘肽循环系统、氮含量及相关酶活性、渗透调节物质含量、营养元素含量及PAL、PPO、POD 酶活性等指标,探究狭叶白蜡叶片在转色过程中的生理差异,阐明狭叶白蜡呈色的生理机制,为彩叶植物呈色机理的研究及狭叶白蜡的推广应用提供重要的理论依据。
1 材料与方法
1.1 试验材料
试验地位于河北省保定市易县河北省洪崖山林管局七里亭林场苗圃(东经115°24′12″~115°31′06″和北纬39°28′31″~39°33′28″之间)。该地区四季分明,年平均气温11.5 ℃,极端高低温分别为41 ℃和-23 ℃,年均降水为616.0 mm,年均蒸发量为1 162.7 mm。
2015 年3 月份在七里亭林场苗圃内以3 年生的小叶洋白蜡为砧木进行狭叶白蜡的插皮接,嫁接100 株,狭叶白蜡接穗采自衡水市红旗大街的行道树,接后进行正常养护管理。于2019 年10 月底选取长势正常、没有病虫害的狭叶白蜡9 株,3 株为1 重复并分别做好标记。10 月31 日、11 月10 日、11 月20 日分别于狭叶白蜡的绿叶期(stage-1)、红紫叶期(stage-2)、落叶前期(stage-3)于上午8 点到9 点间取东、西、南、北方向当年生新梢中上部羽状复叶的中部功能叶片72 片,每次每树种3次重复(图1)。

图1 3 个时期狭叶白蜡叶片采样示例Fig.1 F. angustifolia leaves sampling of 3 stages
1.2 试验方法
1.2.1 叶色参数的测定 用色差计CR-400 对狭叶白蜡、秋紫白蜡、小叶洋白蜡叶色进行测定,记录L*、a*、b*的值,其中L*值由小变大表示由暗转亮,a*值由负转正表示由绿色转向红色,b*值由负转正表示由蓝色转向黄色。
1.2.2 色素含量的测定 色素含量采用丙酮乙醇混合液法测定。取新鲜植物叶片洗净剪碎混匀,称取0.2 g,共3 份,加入少量碳酸钙和石英沙研成匀浆,放入10 mL 丙酮和无水乙醇等量混合液中,用黑塑料袋罩住,至暗处,24 ~48 h 后,待样品变白即可测定。吸取上液1.5 mL,再加入3 mL 丙酮和无水乙醇混合液后,在波长663、645、470 nm 下测定吸光值。
1.2.3 花青苷含量测定 采用0.1 mol/L 盐酸乙醇浸提法,将新鲜叶片剪碎混匀后称取0.1 g 于盛有10 mL 0.1 mol/L 盐酸乙醇溶液的试管中暗提取24 h,过滤后用紫外可见分光光度计测定OD535值,将每克鲜重在10 mL 提取液中改变0.1 个OD 值当作1 个色素单位。
1.2.4 抗坏血酸-谷胱甘肽(ASA-GSH)循环中抗氧化物质含量及酶活性的测定 ASA、DHA、GSH、GSSG酶液提取:取叶片0.2 g,放入5 mL 的10% TCA 充分研磨,在4 ℃,12 000 r/min 转速下离心15 min,取上清液为酶提取液。ASA、DHA、GSH、GSSG的测定方法参照李忠光[9]。APX、GR、DHAR、GPX 酶液提取:取0.2 g 叶片,加入5 mL 预冷的PBS(pH 7.8,含0.2 mmol/L EDTA,2%PVP,2 mmol/L ASA),冰浴研磨,4 ℃,12 000 r/min 下离心20 min。APX、GR、DHAR 测定方法参照Ma[10]。GPX 测定方法参照孟庆瑞[11],并做部分改进。取0.2 mL 酶液,加入2.7 mL 25 mmol PBS(pH7.8,含0.1 mmol EDTA),0.2 mL 20 mmol/L H2O2,0.2 mL 1%愈创木酚,以PBS 缓冲液为对照,记录470 nm 下的OD 值变化。
1.2.5 氮含量和相关酶活性的测定 硝态氮含量测定:10 mL 去离子水放入0.3 g 剪碎的叶片,沸水浴30 min,静置至室温,定容到25 mL。取上述提取液0.1 m,与0.4 mL 5%水杨酸-硫酸溶液混匀后静置20 min,加入8%NaOH 溶液9.5 mL 后,测定410 nm下OD 值。
铵态氮含量测定:取0.3 g 叶片加入5 mL 10%醋酸研磨成匀浆后于4 ℃,10 000 r/min 转速下离心10 min,将上清液用蒸馏水稀释至100 mL,取出2 mL 稀释液与3 mL 60 mmol/L 茚三酮和0.1 mL 1%抗坏血酸摇匀后沸水浴15 min,冷却至室温后加入无水乙醇至10 mL,在580 nm 下测定OD 值。
硝酸还原酶活性的测定方法参照施晟璐试验方法[12]。GS、GDH 活性的测定方法参考Debouba 试验方法[13],GOGAT 活性的测定方法参考王伟香试验方法[14]。
1.2.6 游离脯氨酸的测定 游离脯氨酸采用磺基水杨酸提取,分光光度法测定。
待测液的制定:称取0.2 g 左右的幼苗叶片,用3%磺基水杨酸溶液提取研磨,使最终磺基水杨酸体积为5 mL,匀浆液转入玻璃离心管中,在沸水浴中浸提10 min,冷去后,以3 000 r/min 离心10 min,取上清液待测。
样品测定:吸取2 mL 上清液于试管中,再加入2 mL 水,2 mL 冰乙酸和4 mL 2.5%的酸性茚三酮溶液,置于沸水浴中显色l h,冷却后加入4 mL甲苯,用手充分振荡,以萃取红色物质,静置后,吸取甲苯层于722 分光光度计(Thermo ScientificTMGENESYS 10S)于520 nm 波长进行测定。
标准曲线的绘制:配置浓度为1 ~10 μg/g,10 个系列的游离脯氨酸标准溶液,吸取标准液2 mL(参比液2 mL 水)和2 mL 3%磺基水杨酸溶液代替样品测定2 mL 上清液和2 mL 水,按上述程序进行显色,萃取和比色,最后绘制标准曲线。根据标准曲线求得样品的游离脯氨酸含量。
1.2.7 可溶性糖的测定 采用蒽酮比色法测定叶片中可溶性糖的含量,用可见分光光度计(Thermo NanoDrop 2000c)进行测定。酶液提取方法同MDA。测定时取5 mL 考马斯亮蓝和0.1 mL 酶液混合后摇匀,静置2 ~5 min 后,以pH7.8 磷酸缓冲液调零,在595 nm 波长下测定相关数据。
称取叶片0.1 g,研磨成浆并定容至10 mL,沸水煮10 min,离心一定时间后,取其上清液。用移液枪加入提取液0.5 mL 和1.5 mL 蒸馏水,再加葱酮-乙酸乙酯试剂0.5 mL,再加入5 mL 浓硫酸,充分摇匀。采用葱酮比色法,在630 nm 波长下测定相关数据。根据标准曲线求出标准方程,再根据630 nm波长下吸光度值分别计算出样品中可溶性糖的含量(μg)。
1.2.8 可溶性蛋白的测定 采用考马斯亮蓝G-250染色法测定叶片中可溶性蛋白质的含量。酶液提取方法同MDA。测定时取5 mL 考马斯亮蓝和0.1 mL酶液混合后摇匀,静置2 ~5 min 后,以pH 7.8 磷酸缓冲液调零,在595 nm 波长下测定其值。
1.2.9 营养元素的测定 将新鲜材料用去离子水洗净,用分析滤纸拭干。放在80 ~90 ℃的烘箱中鼓风烘15 ~30 min,然后降温在60 ~70 ℃条件下烘干至恒重。将干样用研钵研碎,过0.5 mm 塑料筛,装入纸袋放入干燥器内备用。称取样品0.5 g 左右于消煮管中,加混酸(浓HNO3∶HCLO5=5∶1)15 mL,在管口放上弯颈小漏斗,在远红外消煮炉中加热,消煮至冒白烟,液体变为无色透明为止。然后转到50 mL 容量瓶中。全氮、磷、钾、钠、钙、镁的测定参照林业行业标准LY/T 1271-1999;全铁、锰、铜、锌的测定参照林业行业标准LY/T 1270-1999。
1.2.10 PAL 活性的测定 称取处理干净的新鲜叶片0.1 g 于预冷研钵,用5 mL 0.1 mol/L pH8.8 内含巯基乙醇2 mmol/L 的硼酸缓冲液冰浴研磨后冰冻离心20 min(12 000 r/min),将上清液转入干净带塞试管,于0 ~4 ℃冰箱中贮存作备用酶液。另外在别的试管中吸取l mL 0.02 mol/L 的苯丙氨酸和2 mL 0.1 mol/L pH8.8 的硼酸缓冲液混合(对照管则用1 mL 硼酸缓冲液替代苯丙氨酸反应底物),于40 ℃水浴锅中保温30 min 后加入0.1 mL 酶液混合,恒温反应30 min 后加入0.2 mL 6 mol/L HCl 终止反应。取反应液于290 nm 波长下测定其吸光度。最后以每小时吸光度OD290增加0.01 为1 个酶活性单位(U),计算PAL 的活性大小。
1.2.11 PPO 活性的测定 多酚氧化物酶(PPO)活性测定。取0.5 g 叶片,剪碎后放入预冷的研钵中,加 入5 mL 0.05 mol/L PBS 缓 冲 液(pH6.8,内含1% PVP),在冰浴中研磨匀浆。10 000 r/min离心30 min,上清液即为粗酶液。反应体系中有1.5 mL PBS,1.0 mL 0.1 mo/L 联苯二酚,35 ℃保温10 min,立即加酶液0.5 mL,测定420 nm 处吸光度在2 min 内的变化,以每分钟OD420变化0.01 为1 酶活性单位。
1.2.12 POD 活性的测定 酶液的提取:取洗净的新鲜材料0.15 g 置于冰浴的研钵中,先加入2 mL pH7.8 的磷酸缓冲液,充分研磨至无粗纤维为止导入离心管,再用3 mL 磷酸缓冲液洗净研钵转入离心管中,在4 ℃,离心20 min,取上清液用于保护酶活性的测定。
SOD 活性测定采用氮蓝四唑(NBT)光还原法。取透明度好、质地相同的15×150 mm 试管5 支,以3 支作为测定管、2 支作为对照管。向5 支试管中加入下列试剂:50 mmol/L 磷酸缓冲液1.5 mL、130 mmol/L Met 溶液0.3 mL、750 μmol/L NBT 溶液0.3 mL、100 μmol/L EDTA-Na2 液0.3 mL、20 μmol/L核黄素0.3 mL,然后再向2 支测定管中加入酶提取液0.1 mL,对照管不加酶液。最后向2 支测定管加入蒸馏水0.5 mL,对照管中加入蒸馏水0.6 mL。混匀后,给对照管中的1 支罩上比试管稍长的双层黑色硬纸套遮光,与其他各管同时置于4 000 lx 日光灯下反应20 min。反应结束后,用黑布罩上试管以终止反应,以遮光的对照管作为空白调零,在560 nm 波长下测定各管的吸光度,并计算SOD活性。
POD 活性测定采用愈创木酚法[15]。采用2.91 mL pH7.0 磷酸缓冲液(10 mmol/L)、50 μL 愈创木酚(20 mmol/L)、200 μL 酶液和20 μL 过氧化氢(40 mmol/L)作为反应体系溶液。取3 mL 反应液,加入上述测定SOD 活性的酶提取液20 μL 于小管中,充分混合后,充分混匀后置于34 ℃恒温水浴中3 min,然后加20%三氯乙酸20 μL 终止反应。用分光光度计(Thermo ScientificTMGENESYS 10S)测定在470 nm 波长下吸光度,计算POD 活性。
CAT 活性测定:取50 mL 三角瓶,2 支作为对照,测定瓶加入上述酶液2.5 mL,对照瓶加煮死酶液2.5 mL,再加入2.5 mL H2O2,同时计时于30 ℃恒温水浴锅中保温10 min,立即加入10%硫酸2.5 mL,然后用0.1 mol/L 高锰酸钾滴定至出现粉红色(30s 不消失)。
1.2.13 统计学方法 本试验数据结果由Excel 进行初步处理,利用SPSS23.0 软件进行单因素方差显著性分析。
2 结果与分析
2.1 狭叶白蜡3 个时期叶片叶色参数变化
为了明确狭叶白蜡转色期叶色变化的原因,选取3 个时间段,对狭叶白蜡体内参数进行测定。发现狭叶白蜡叶片L*值随时期推移呈平缓上升趋势,a*值呈不断上升的趋势,b*值趋势平缓。其中,L*值在绿叶期最低,比红紫叶期和落叶前期分别显著低10%、10.37%,落叶前期最高。a*值在落叶前期最大,比绿叶期和红紫叶期依次高275.11%、56.04%,且差异显著,其次是红紫叶期,比绿色期高212.21%,差异显著,绿色期最小。b*值在3 个时期无显著差异(图2)。
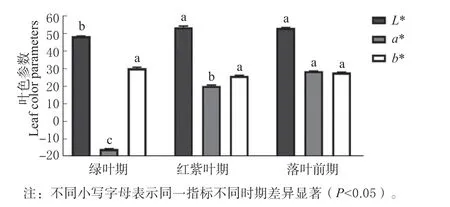
图2 狭叶白蜡转色期叶色参数的变化Fig.2 Variation of leaf color parameters in transchromatic stage of F.angustifolia
2.2 狭叶白蜡3 个时期叶片色素含量变化
通过丙酮乙醇混合液法测定狭叶白蜡的色素含量。结果发现,狭叶白蜡叶片内叶绿素a 含量和叶绿素总量随时期变化呈下降趋势,叶绿素b 与类胡萝卜素呈平缓趋势,花色素苷相对含量呈上升的趋势(图3A)。其中,叶绿素a 最大值出现在绿叶期,是红紫叶期和落叶前期的1.89 倍和1.93 倍,差异显著;红紫叶期与落叶前期无显著差异。叶绿素总量最大值出现在绿叶期,是红紫叶期和落叶前期的1.86倍和1.83 倍,差异显著,红紫叶期与落叶前期无显著差异。叶绿素b 和类胡萝卜素在3 个时期内无显著差异。花色素苷最大值出现在落叶前期,是绿叶期和红紫叶期的1.51 倍和1.40 倍,差异显著;红紫叶期与绿叶期值接近,无显著差异。

图3 狭叶白蜡转色期色素含量及比值的变化Fig.3 Variation of pigment content and ratio in transchromatic stage of F. angustifolia
狭叶白蜡叶片内类胡萝卜素/叶绿素总量、花色素苷/类胡萝卜素在3 个时期内的变化趋势均比较平缓,均无显著差异。花色素苷/叶绿素总量随时期变化呈上升趋势,在落叶前期出现最大值,为1.57,较绿叶期与红紫叶期分别提高了191.34%、46.16%,与绿叶期差异显著;绿叶期与红紫叶期无显著差异(图3B)。
2.3 狭叶白蜡3 个时期叶片抗坏血酸-谷胱甘肽(ASA-GSH)循环中抗氧化物质含量及酶活性变化
为了明确狭叶白蜡叶片颜色变化与抗坏血酸-谷胱甘肽(ASA-GSH)循环相关,对该循环中抗氧化物含量及酶活性进行了测定。结果显示,ASA、GSH、GSSG、ASA/DHA 含量均随时间推移呈上升趋势,DHA、GSH/GSSG 含量呈下降趋势(表1)。其中ASA 落叶前期是绿叶期和红紫叶期的1.78 倍和1.16 倍,与绿叶期差异显著;ASA/DHA 落叶前期是绿叶期和红紫叶期的3.51 倍和1.14 倍,与绿叶期差异显著;GSSG 落叶前期是绿叶期和红紫叶期的1.84 倍和1.16 倍,与绿叶期差异显著;DHA 绿叶期是红紫叶期和落叶前期的2.14 倍和2.08 倍,差异显著;GSH、GSH/GSSG 3个时期无显著差异。
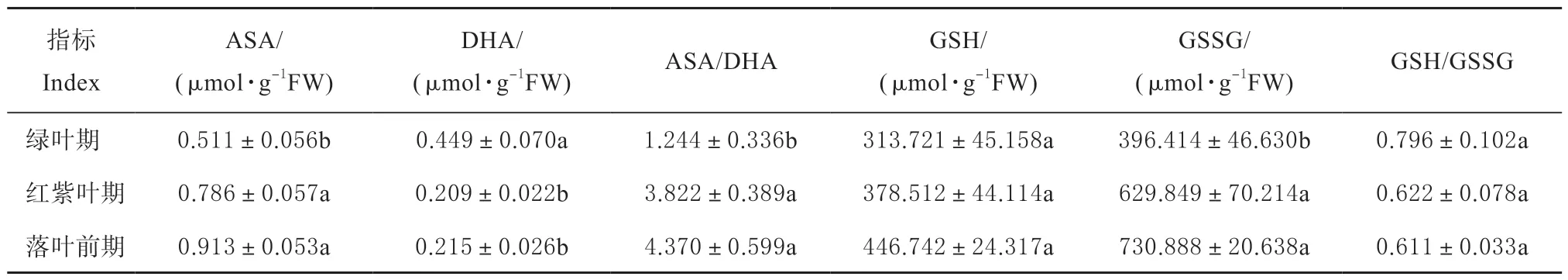
表1 狭叶白蜡转色期抗坏血酸-谷胱甘肽(ASA-GSH)循环中抗氧化物质含量Table 1 Antioxidant substances in ascorbate-glutathione(ASA-GSH) cycle during the ranschromatic stage of F. angustifolia
DHAR、GR 活性随时间推移呈一直减小的趋势,绿叶期活性最大,DHAR 活性比红紫叶期、落叶前期显著高54.48%、68.86%;GR 活性比红紫叶期、落叶前期显著高44.35%、54.23%。APX、GPX 活性处于波动变化,3 个时期并无显著差异(表2)。

表2 狭叶白蜡转色期抗坏血酸-谷胱甘肽(ASA-GSH)循环中酶活性变化Table 2 Variation of enzyme activity in ascorbateglutathione(ASA-GSH) cycle during the ranschromatic stage of F. angustifolia μmol·(g·min)-1 FW
2.4 狭叶白蜡3 个时期叶片氮含量和相关酶活性变化
为了明确狭叶白蜡叶片颜色变化与氮含量相关,对氮含量和相关酶活性进行了测定。发现硝态氮含量随时间变化呈增大趋势,落叶前期比绿叶期提升43.43%,差异显著;铵态氮呈先增大后减小的趋势,绿叶期、红紫叶期比落叶前期显著高54.75%、63.24%;硝酸还原酶(NR)活性呈增大趋势,落叶前期是绿叶期、红紫叶期的3.79、1.34 倍,3 个时期差异显著;谷氨酰胺合成酶(GS)活性呈增大趋势,落叶前期活性最大,是绿叶期、红紫叶期的1.53、1.43倍;谷氨酸合成酶(GOGAT)活性呈增大趋势,但是趋势平缓,3 个时期无显著性差异;谷氨酸脱氢酶(GDH)活性呈先增大后减小的趋势,红紫叶期活性最大,显著高于绿叶期、落叶前期,落叶前期活性最小,与绿叶期无显著性差异(表3)。
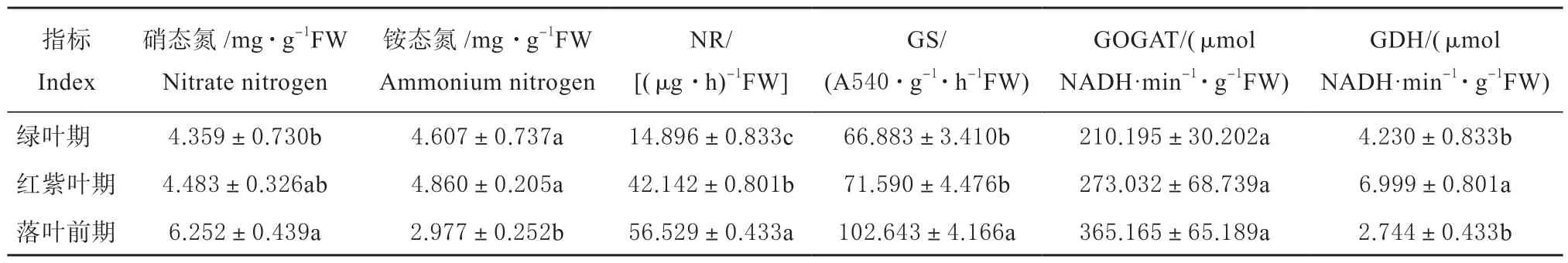
表3 狭叶白蜡转色期氮含量和相关酶活性的变化Table 3 Variation in nitrogen content and related enzyme activities during the ranschromatic stage of F. angustifolia
2.5 狭叶白蜡3 个时期叶片渗透调节物质含量变化
为了明确渗透水平也会影响狭叶白蜡叶片颜色变化,对渗透调节物质含量进行测定。观察发现,狭叶白蜡叶片内脯氨酸含量和可溶性糖含量在3 个时期的变化趋势一致,随着叶片从绿叶期转变到落叶前期,脯氨酸与可溶性糖含量均呈不断上升的趋势,可溶性蛋白含量趋势平缓(图4C)。脯氨酸最大值出现在落叶前期,是绿叶期和红紫叶期的4.79倍和1.72 倍,差异显著;其次是红紫叶期,显著高于绿叶期(图4A);可溶性糖最大值出现在落叶前期是绿叶期和红紫叶期的8.22 倍和1.64 倍,差异显著(图4B);其次是红紫叶期,显著高于绿叶期;可溶性蛋白含量3 个时期无显著差异(图4C)。

图4 狭叶白蜡转色期脯氨酸、可溶性糖和可溶性蛋白含量Fig.4 Proline, soluble sugar and soluble protein content during the ranschromatic stage of F. angustifolia
2.6 狭叶白蜡3 个时期叶片营养元素含量变化
对狭叶白蜡3 个时期叶片营养元素含量变化进行分析,明确叶片颜色变化对营养物质的影响。结果发现:狭叶白蜡叶片内全磷、全铁、全锰、全铜、全钙含量在3 个时期呈增加趋势,全氮含量和全镁含量在3 个时期无显著差异,全钾、全锌含量呈减小趋势。其中,全磷含量落叶前期显著高于绿叶期和红紫叶期;全铁和全钙含量3 个时期均有显著差异;全锰和全铜含量均是绿叶期显著低于红紫叶期和落叶前期,而红紫叶期与落叶前期无显著差异;全钾含量落叶前期显著低于绿叶期和红紫叶期;全锌含量则是绿叶期显著高于红紫叶期和落叶前期(表4)。

表4 狭叶白蜡转色期叶片营养元素含量的变化Table 4 Variation of nutrient elements content in F. angustifolia leaves during the ranschromatic stage
2.7 狭叶白蜡3 个时期叶片PAL、PPO、POD 活性变化
对狭叶白蜡3 个时期叶片PAL、PPO、POD 活性变化进行测定,发现狭叶白蜡叶片内PAL 和PPO活性在3 个时期的变化趋势一致,随着叶片从绿叶期转变到落叶前期,PAL 和PPO 活性均呈不断上升的趋势,POD 呈先减小后增大的趋势。PAL 最大值出现在落叶前期,为384.36,是绿叶期和红紫叶期的1.65 倍和1.21 倍(图5A)。PPO 最大值出现在落叶前期,为49.87,是绿叶期和红紫叶期的2.51倍和1.15 倍,与绿叶期差异显著;其次是红紫叶期,显著高于绿叶期(图5B)。POD 最大值出现在落叶前期,为672.25,是绿叶期和红紫叶期的1.38 倍和1.66 倍,与绿叶期和红紫叶期差异显著;红紫叶期与绿叶期无显著差异(图5C)。
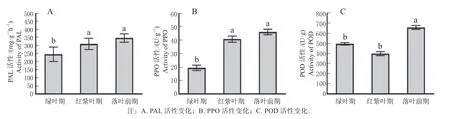
图5 狭叶白蜡转色期PAL、PPO、POD 活性的变化Fig.5 Variation of PAL, PPO and POD activities in F. angustifolia leaves during the ranschromatic stage
3 结论与讨论
环境变化会导致植物叶片颜色的变化,通常温度、光照、湿度、逆境环境、生殖生长等外部条件的变化可诱导植物叶片产生相应信号,从而调控叶色变化相关基因表达和相关生理过程的发生,使叶片呈现不同的颜色。研究彩叶植物叶片变色的生理和分子调控机制,深入挖掘参与叶色调控的相关基因并明确其功能及作用机理,将为丰富园林绿化景观奠定坚实的理论基础,为彩叶树种的应用推广提供重要的理论指导。
3.1 抗坏血酸-谷胱甘肽循环中抗氧化物质含量及酶活性的变化
ASA-GSH 循环是植物清除体内活性氧自由基重要途径之一。ASA 和GSH 是2 种重要的抗氧化物质。植物细胞中的抗氧化物质含量和ASA/GSH、GSH/GSSG 是控制ASA-GSH 循环运行效率的关键因素。研究表明,ASA 的热降解产物会降低花色素苷的稳定性。本研究中,ASA、ASA/DHA、GSSG 含量均随时间变化呈上升趋势,DHA 含量呈下降趋势,GSH、GSH/GSSG 含量趋势平缓;DHAR、GR 活性随时间推移呈一直减小的趋势,APX、GPX 活性无明显变化,同时ASA 与花色素苷显著正相关。这表明从绿叶期到落叶前期狭叶白蜡植物体内的ROS增加导致ASA 和GSH 含量增加。ASA 作为APX的电子供体催化的H2O2还原,并被氧化成脱氢抗坏血酸(DHA);后者可以经脱氢抗坏血酸还原酶(DHAR)催化还原[15]。ASA 和DHA 的相对平衡在ASA-GSH 循环中起着重要作用。落叶前期的ASA/DHA 显著高于绿叶期,说明狭叶白蜡在落叶前期拥有较高的ASA 周转和再生能力及较高的清除活性氧胁迫的效率,ASA 不断升高,DHA 不断降低,有利于花色苷在植物体内稳定存在,与Gérard[16]的研究结果一致。
3.2 氮含量和相关酶活性的变化
植物利用氮素的主要形式之一是硝态氮,硝酸根离子被植株吸收后,首先经硝酸还原酶的催化作用被还原成亚硝酸根离子,再通过还原转变为氨,合成氨基酸等一系列含氮化合物。本研究结果显示从绿叶期、红紫叶期到落叶前期,这段时间变化中硝态氮含量、硝酸还原酶(NR)、谷氨酰胺合成酶(GS)、谷氨酸合成酶(GOGAT)均呈上升趋势,而铵态氮、谷氨酸脱氢酶(GDH)呈先增大后减小的趋势。硝酸还原酶(NR)是氮代谢系统中催化硝酸盐还原成亚硝酸盐过程中的限速酶,其活性可反应植株氮素营养状况和氮代谢水平。谷氨酸合成酶(GOGAT)与谷氨酰胺合成酶(GS)协同一起构成GS/GOGAT 途径,催化NH+4同化反应。植物吸收硝态氮含量不断上升,导致硝酸还原酶(NR)、谷氨酰胺合成酶(GS)、谷氨酸合成酶(GOGAT)活性不断提高。第2 条NH4+同化途径是由谷氨酸脱氢酶(GDH)催化。而在这段时期内,谷氨酸脱氢酶(GDH)呈先增大后减小的趋势,可以看出,第1 条途径为狭叶白蜡在叶色变化时期NH4+同化的主要途径。周卫等[17]研究显示,谷氨酸脱氢酶(GDH)活性升高会抑制谷氨酰胺合成酶(GS)活性。这与本研究中谷氨酸脱氢酶(GDH)呈先增大后减小的趋势,谷氨酰胺合成酶(GS)活性不断上升结果一致。本研究中,GS、GOGAT 与L*值、a*值、花色素苷、PAL、PPO、POD 均显著正相关,说明,催化NH4+同化的第1条途径与狭叶白蜡叶色变红有密切联系,但是与陈静蕊[18]对水稻的叶色变化研究中得出的氮素通过影响水稻体内叶绿素含量进而影响叶色的结论不一致,氮代谢过程对叶色的调控较为复杂,有待进一步研究。
3.3 渗透调节物质的变化
渗透调节是植物通过积累无机物和有机物,降低渗透势以应对胁迫环境的一种生理机制。在外界逆境环境下,植物体内脯氨酸含量会增加进而保护质膜系统和细胞内酶的结构,降低蛋白质降解速度。可溶性糖在花色素苷的合成中作为开始信号出现,而可溶性蛋白作为渗透调节物质,也能够一定程度上对花色素苷的合成起到生理调控的作用。本研究中,从绿叶期到落叶前期脯氨酸和可溶性糖含量一直升高,并且差异显著,这说明狭叶白蜡在这时期可能遭遇了某种逆境,但是其能通过增加脯氨酸含量来保持有机物的积累,这与任金兰[19]的研究一致。可溶性糖与L*值、a*值、花色素苷含量均表现出了显著或极显著正相关关系,可溶性蛋白与L*值、PAL、PPO 呈显著正相关,说明可溶性糖能够直接促进叶色变红,可溶性蛋白可能间接影响叶片颜色,与姜琳[20]等对栎属的可溶性糖研究结果不一致,但是与宋鹏[21]等对卫矛属的研究一致,可溶性蛋白与姜琳[34]等研究一致,这可能是因为不同植物体内可溶性糖承担的功能不同。
3.4 叶色酶PAL、PPO、POD 活性的变化
花色素苷的合成需要酶的催化,而苯丙氨酸解氨酶(PAL)是花色素苷合成的关键酶之一。本研究中,从绿叶期到落叶前期PAL 活性不断升高,与a*值、花色素苷显著正相关,说明PAL 是叶片变红的直接原因之一,这与冯立娟等[22]的研究一致。关于花色素苷降解与多酚氧化酶(PPO)、过氧化物酶(POD)活性的关系存在争议。本研究中,从绿叶期到落叶前期PPO 活性不断升高,与a*值、花色素苷成正相关,这说明PPO 活性可能有利于狭叶白蜡花色素苷的合成与积累,能够直接影响叶片变红,这与卓启苗[23]等对欧洲卫矛(Euonymus europaeus)研究一致。但赵昶灵[24]等认为PPO 活性增大有利于花色苷在体内降解,宋鹏[25]等对大果卫矛(E.myrianthus)和欧洲卫矛叶片呈色机制研究表明PPO 在一定程度上会抑制花色素苷的合成,与上述结论一致。本研究中,POD 在落叶前期显著升高,与花色素苷显著正相关,说明POD 通过影响叶片内花色素苷的含量进而影响叶片颜色,与卓启苗[23]等的研究结论相反,但是与吴驭帆[25]等的研究一致。由此可知,PPO、POD 活性对于花色素苷的调控较为复杂,需要今后进一步探究。
3.5 营养元素含量的变化
Fe、Mn、Zn 等重金属离子往往对花色素苷有螯合作用,使其颜色发生改变。同时金属离子还与花色素苷稳定性有密切联系,但是在不同的植物中,同一种金属离子所起的作用可能不同。保持细胞内较高的K+含量可以增加植物的抗逆性,是机体正常活动所必须的;Ca2+是细胞壁的主要成分,对稳定细胞壁起重要作用;Mg2+是叶绿素的重要组成部分;铁多存在于叶绿体中,是叶绿素合成的必需元素;铁参与合作用中的电子传递,对光合作用有直接的影响;铁还是一些与呼吸作用相关光酶的组分,所以铁对植物的呼吸作用也有一定的影响;锰也是叶绿体结构的组成成分,锰还直接参与光合作用中的光合放氧过程;铜可影响植物体内生长素氧化酶活性,植物需求量较少;锌参与叶绿素的合成,对很多植物的根、茎生长有决定性作用。本研究中,从绿叶期到落叶前期,全钾、全锌含量不断减少,全钙、全铁、全锰、全铜含量不断增加,全镁含量无显著性变化。
3.6 色素含量及比例的变化
色素是植物叶片呈色的物质基础和根本原因,叶片中以叶绿素为主,类胡萝卜素和花色素苷含量较低时,叶片呈现绿色;当叶片中叶绿素大量降解,类胡萝卜素比例提高时,叶片呈现黄色;而叶片中叶绿素大量降解,花色素苷大量合成,花色素苷/叶绿素含量比值越大,叶片越红。卓启苗等[23]对欧洲卫矛的研究,楚爱香等[26]对火炬树(Rhus Typhina)的研究均表明花色素苷相对含量上升,显著高于叶绿素含量,直接导致了植物叶片变红。在本研究中,红紫叶期和落叶前期的叶绿素含量显著低于绿叶期,花色素苷/叶绿素含量的比值落叶前期显著高于绿叶期,类胡萝卜素3 个时期显著差异,落叶前期的花色素苷显著高于绿叶期和红紫叶期,这表明,叶绿素大量降解且合成受到抑制,花色素苷大量合成,类胡萝卜素比较稳定,花色素苷/叶绿色含量不断上升直接导致叶片变红。
3.7 叶色参数的变化
植物的叶色参数能够定量反应叶片的色泽,使人们更加直观、方便的观测到叶色变化情况。植物种类不同,影响叶色参数的因素也不同。对枫香的研究表明,a*值与叶绿素含量、类胡萝卜素含量极显著负相关,与花色素苷含量显著正相关。对不同种源黄连木研究发现,各个种源黄连木的叶色参数a*值均与花色素苷含量呈正相关关系,与叶绿素含量呈显著负相关关系,各个种源叶色参数L*值也与叶绿素含量间表现出显著或极显著的正相关性。卓启苗等[23]研究发现,影响欧洲卫矛的秋冬转色期叶片变红的主要因素时叶绿素、花色素苷和可溶性糖相对含量及PAL、PPO 活性,POD 活性对叶片变红无直接影响。本研究中,L*值与类胡萝卜素/叶绿素总量、花色素苷/叶绿素总量、GSH、ASA、ASA/DHA、GSSG、GS、GOGAT、NR、PAL、PPO、脯氨酸、可溶性糖、可溶性蛋白、全锰含量、全铜含量、全钙含量显著或极显著正相关,与叶绿素总量、DHA、GSA、DHAR、全锌含量显著负相关,这表明狭叶白蜡叶色的明亮度受色素含量、ASAGSH 循环、氮代谢、渗透调节物质、PAL、PPO 以及微量元素等多种因素影响。a*值与类胡萝卜素/叶绿素总量、花色素苷、花色素苷/叶绿素总量、PAL、PPO、ASA、ASA/DHA、GSH、GSSG、NR、GS、脯氨酸、可溶性糖、全锰含量、全铜含量、全钙含量显著或极显著正相关,与叶绿素总量、DHA、DHAR、GR、全钾含量、全锌含量显著或极显著负相关;这表明,PAL、PPO、渗透调节物质升高、氮代谢增强、ASA-GSH 循环增强、花色素苷合成、叶绿素降解以及K+、Cu2+增加有利于叶片变红,POD 与a*值无显著相关,但是却与花色素苷显著正相关,说明可间接影响叶片变红。b*值与叶绿素总量、类胡萝卜素、DHA、GSH/GSSG、DHAR、GR、全氮含量、全锌含量显著或极显著正相关,与花色素苷/类胡萝卜素显著负相关,说明调控b*值的影响因子较少,b*值主要受叶绿素、类胡萝卜素、全氮含量以及全锌含量调控。
本研究表明狭叶白蜡的叶片从绿叶期、落叶前期到落叶后期,叶片中的脯氨酸、可溶性糖含量、硝态氮、铵态氮、NR 活性等均发生变化,说明狭叶白蜡叶片在转色过程中的生理差异。本研究为阐明狭叶白蜡呈色的生理机制,为彩叶植物呈色机理的研究及狭叶白蜡的推广应用提供重要的理论依据。
