颅内未破裂动脉瘤Pipeline栓塞装置置入术后支架内狭窄的危险因素
2023-08-17葛慧剑桂思铭邓丁伟李佑祥
葛慧剑 桂思铭 邓丁伟 李佑祥
颅内动脉瘤破裂是导致蛛网膜下腔出血的主要原因,致残率、病死率较高[1]。在颅内动脉瘤的血管内治疗中,血流导向装置应用越来越多,具有重要的地位,其中Pipeline 栓塞装置(Pipeline embolization device,PED)是目前常用的血流导向装置。虽然PED 已在临床上广泛使用近十年,但其所带来的并发症,尤其是远期预后方面还未得到深入研究,常见的并发症包括神经功能障碍和脑出血,可导致严重的不良结局[2]。然而,其他方面的并发症,例如内支架狭窄(in-stent stenosis,ISS)等在其临床表现和病理方面得到的关注相对较少。ISS可能导致偏瘫、脑供血不足,甚至导致病人死亡。自PED 引入国内以来,仅有少数研究分析PED 置入术后ISS 情况[3]。本文探讨颅内未破裂动脉瘤(unruptured intracranial aneurysms,UIA)PED置入术后ISS的发生率、临床预后和危险因素,为临床提供参考。
1 资料与方法
1.1 病例选择标准 纳入标准:使用PED治疗的UIA,随访资料完整。排除标准:电子病历缺乏基线资料、动脉瘤特征、抗血小板治疗、操作细节和神经系统并发症等;颅内动脉瘤合并动静脉畸形;不能进行抗血小板聚集治疗或已经进行抗凝治疗的病人。
1.2 研究对象 2015 年9 月至2020 年10 月收治符合标准的UIA 共460 例,其中男152 例,女308 例;中位年龄52岁(IQR:44~60岁);体质指数中位数24.6 kg/m2(IQR:22.7~26.7 kg/m2)。合并糖尿病41 例、血脂异常189例、高血压病194例。既往有蛛网膜下腔出血史22 例、脑缺血性卒中史30 例、冠心病史34 例、吸烟史74例、饮酒史66例、药物过敏史56例。
1.3 治疗方法 术前至少口服阿司匹林(100 mg/d)和氯吡格雷(75 mg/d)5 d。手术在全麻下进行,将长鞘导管预置于颈内动脉或椎动脉合适节段,中间导管经长鞘导管超选至载瘤动脉近动脉瘤处。通过三维图像重建动脉瘤及载瘤动脉,根据测量结果选取合适的PED。在空白路图下,采用微导丝携Marksman微导管或Phenom-27微导管经中间导管超选至动脉瘤远端载瘤动脉的合适位置,撤出微导丝并将PED通过Marksman 微导管或Phenom-27 微导管输送和释放。释放后PED 存在缩短和位移的风险,或在血管造影中瘤颈部出现快速血流(射流征),则考虑弹簧圈辅助PED 治疗。当PED 无法完全贴合血管壁时,将进行微导丝按摩或球囊扩张。术后双重抗血小板治疗方案为:术后6 个月内口服阿司匹林(100 mg/d)和氯吡格雷(75 mg/d);术后6~12 个月口服阿司匹林(100 mg/d)。
1.4 随访方法 术后6 个月进行首次DSA 随访,术后12个月进行二次DSA随访。此外,还建议病人在此后每年进行1次影像学随访。
1.5 ISS的评估标准 动脉瘤形态参数由三名经验丰富的神经介入医生根据研究手动测量。根据治疗前后DSA 测量载瘤动脉直径、近端载瘤动脉直径和远端载瘤动脉直径(定义为在动脉瘤颈部,距颈部上游1.5倍载瘤动脉直径和距颈部下游1.5倍载瘤动脉直径的最小直径)。
ISS 是载瘤动脉内皮的过度生长超过支架壁的限制,DSA表现为载瘤动脉的直径减小,在造影剂充盈的血管腔和支架的金属网之间出现间隙。本文ISS 被定义为PED 内的管腔直径较术前缩窄超过50%,其中50%~74%为轻度,75%~99%为重度,100%为ISS 导致的载瘤动脉闭塞。根据O'Kelly-Marotta(OKM)分级标准评估动脉瘤闭塞程度。
1.6 统计学方法 使用R 软件(v4.1.1 版本)进行分析;正态分布定量资料以±s表示,采用t检验;非正态分布定量资料以中位数和四分位数间距(interquartile range,IQR)表示,使用Mann-Whitney U 检验;定性资料采用χ2检验或Fisher 精确概率法检验;使用多因素logistic 回归模型分析ISS 的危险因素;P<0.05为差异有统计学意义。
2 结果
2.1 ISS 的发生率 术后中位随访时间8 个月(IQR:5~16个月)。在随访过程中,66例(14.3%)出现ISS,其中17 例(3.7%)出现载瘤动脉闭塞。末次随访,8例ISS 有所恢复,31 例(47.0%)出现轻度ISS,10 例(15.2%)出现重度ISS,17 例(25.8%)出现载瘤动脉闭塞;3 例出现偏瘫,1 例单侧视野缺损,1 例死亡,其余61 例无症状;56 例(84.8%)颅内动脉瘤完全闭塞。
394 例(85.7%)未出现ISS,其中382 例(83.0%)颅内动脉瘤完全闭塞。
2.2 ISS 的危险因素 单因素分析显示,性别、年龄、动脉瘤部位、动脉瘤大小、载瘤动脉、治疗方法与ISS有关(P<0.05,表1)。多因素logistic 回归分析显示,年龄、后循环动脉瘤、球囊扩张术是UIA病人PED置入术后发生ISS的独立影响因素(P<0.05,表1),其中年龄越大,ISS风险越低;而后循环动脉瘤、球囊扩张术明显增加ISS风险。
3 讨论
本文UIA 病人PED 置入术后ISS 的发生率为14.3%,其中47.0%的ISS 为轻度,25.8%的ISS 逐渐发展为载瘤动脉闭塞。先前的研究显示PED置入术后ISS 的发生率差异较大,最低为1.1%,最高为29.3%[4]。由于这些研究的总病例数很少,并且缺乏对ISS病人的长期随访数据,因此很难对ISS的影响因素做进一步分析。我们将PED内的管腔直径较术前缩窄超过50%定义为ISS。载瘤动脉在PED 置入术后出现的轻度内膜增生可能是动脉瘤腔愈合过程中的一部分[5]。因此把ISS定义为能够观察到明显的血流动力学异常及明显的载瘤动脉缩窄是合理的。
本文多因素logistic 回归分析发现高龄是ISS 的保护因素,而球囊扩张和后循环动脉瘤是ISS的危险因素。Sweid 等[6]报道高龄与内皮再生能力降低有关,这可能是高龄病人PED 置入术后较低的ISS 发生率的原因之一,因为大脑低内皮化能力降低了神经细胞和血管平滑肌细胞的增殖和分化潜力。然而,由于低内皮化可延迟动脉瘤闭塞,因此PED治疗对老年人来说仍是一把双刃剑[7]。
接受过球囊扩张治疗的病人更易发生ISS,这种情况可能有两个主要原因:首先,这些病人的脑血管基础状况较差,颅内动脉可能存在局部狭窄或动脉粥样硬化,使微导管无法到达最佳着陆区域,如果不使用球囊扩张,将很难确保PED 贴附于血管壁以达到动脉瘤闭塞效果;其次,球囊扩张可能会对血管壁造成一定的机械损伤,导致血管局部炎症加剧,随后出现过度的内膜增生[6]。如果球囊扩张术不可避免,则需要进行长期的随访,并且根据血管造影随访的结果动态调整抗血小板药物的治疗方案,以免出现过度的血管内皮化而导致ISS。
Chalouhi 等[8]报道前循环(特别是颈内动脉)动脉瘤是PED 置入术后ISS 的危险因素(OR=3.1;P=0.03)。然而该研究中后循环动脉瘤较少,这可能是由于PED 最初的手术适应证不包括后循环动脉瘤。随着PED 疗效和安全性的增加,PED 的适应证得到了扩展。但是,后循环动脉瘤大多是夹层形态,常常伴有较高的载瘤动脉狭窄率[9]。我们发现后循环动脉瘤PED 置入术后ISS 的发生率高于前循环动脉瘤,其中1例死于ISS后基底动脉闭塞引起的并发症(图1)。此外,本文一些后循环动脉瘤体积较大,常囊括了部分载瘤动脉区域,并且动脉瘤腔内也有血栓形成;为了使PED充分覆盖动脉瘤,可能需要使用多个PED 进行重叠放置,且PED 有时会在不同直径的血管之间放置[10]。这些因素都增加了术后ISS 的风险。对于ISS病人,建议进行密切随访和长期抗血小板治疗。如果血管几乎完全闭塞并引起症状,可以采用血管成形术、支架再置入甚至动脉分流术缓解血管狭窄引发的问题。
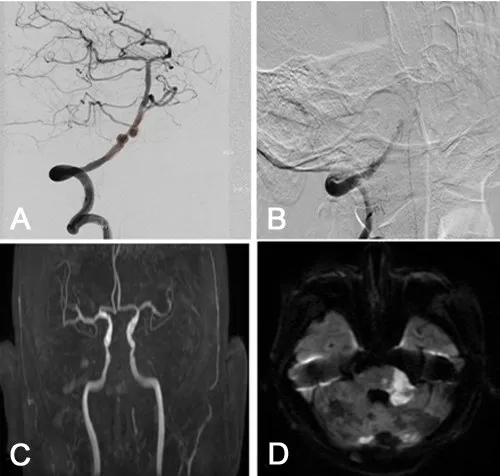
图1 颅内未破裂动脉瘤PED置入术后并发支架内狭窄的影像表现

图1 颅内未破裂动脉瘤Pipeline栓塞装置置入术后支架内狭窄的危险因素的logistic回归分析
总之,PED 置入术后ISS 是一种常见的并发症,后循环动脉瘤和球囊扩张后术治疗的病人更易发生ISS。
