氧化苦参碱通过下调miR-155-5p 对胃癌细胞的增殖、凋亡、迁移、侵袭作用
2023-08-17王斐斐李炜贺礼琴白昌儒董明清王娟毅
王斐斐,李炜,贺礼琴,白昌儒,董明清,王娟毅*
1.西安交通大学附属三二〇一医院 肿瘤内科,陕西 汉中 723000
2.空军军医大学 基础医学院,陕西 西安 710032
胃癌是我国发病率第5 位的肿瘤,也是导致肿瘤相关死亡的第3 大原因[1]。超过90%的胃癌患者在诊断时已出现远处转移[2]。放疗、化疗、靶向治疗是出现转移胃癌的主要治疗方法,但化疗药物特异性较低,且不良反应明显[3-4]。因此,寻找更为安全高效的治疗药物具有重要意义。
氧化苦参碱是从苦参干燥根、果实中提取的一种醌类生物碱,是苦参碱的主要有效成分,具有抗炎、抗肿瘤等多种药理作用[5-6]。研究表明,氧化苦参碱是一种天然抗癌药物,能够显著抑制癌细胞增殖、影响多种恶性肿瘤的发生和进展[6]。已证实,氧化苦参碱可对胃癌BGC-823 细胞及胃癌HGC-27细胞裸鼠移植瘤模型发挥抑制生长作用[7-8]。课题组组前期也报道了苦参碱可通过血管内皮生长因子-C(VEGF-C)/血管内皮生长因子受体3(VEGFR3)和核因子-κB(NF-κB)/Toll 样受体4(TLR4)信号通路保护大鼠的胃黏膜损伤[9]。最近研究表明,氧化苦参碱可以通过调节microRNA(miRNA)的表达来发挥其抗肿瘤作用[10-11]。miRNA 是内源性单链非编码RNA,与靶miRNA 的3 个非翻译区域结合,可以在转录后水平调节基因表达。研究表明,miR-155-5p 在肝癌、食管癌等消化系统肿瘤中高度表达,并且与预后不良相关[12-13]。然而,目前尚不清楚miR-155-5p 是否在胃癌中过度表达,以及氧化苦参碱是否可通过调节miR-155-5p 在胃癌中的表达以抑制肿瘤进展。基于此,本研究探讨了氧化苦参碱对胃癌细胞中miR-155-5p 表达、胃癌细胞生物学行为及miR-155-5p 靶基因对封闭蛋白1(Claudin 1)、半胱氨酸蛋白酶3(Caspase-3)和c-Myc 表达的影响,为胃癌治疗的新药物研发和新靶点的确立提供参考。
1 材料和方法
1.1 主要试剂和仪器
人胃癌细胞系SGC7901、MGC803 和正常胃黏膜GES-1、AGS 细胞系购自中国科学院上海细胞库。错义序列siRNA、miR-155-5p-模拟物和miR-155-5p-抑制剂由宝日医生物技术(北京)有限公司合成。RNA 分子序列如下:miR-155-5p 模拟物,5’-UUAAUGCUAAUCGUGAUAGGGGU-3’,miR-155-5p 抑制剂,5’-ACCCCUAUCACAUUAGCAUU AA-3’,错义序列 siRNA,5’-CCCUAUCACAAUUA GCAUUAAUU-3’。氧化苦参碱购自上海阿拉丁生化科技股份有限公司,货号A111285,纯度为分析标准品。
MTT 和0.1%结晶紫溶液染色购自北京索莱宝科技有限公司,胎牛血清购自美国Gibco 公司。Claudin 1 抗体(货号ab211737)、c-Myc 抗体(货号ab32072)、Cyclin D1 抗体(货号ab16663)、抗B 细胞淋巴瘤/白血病基因2(Bcl-2)抗体(货号ab203516)、抗胱天蛋白酶3(Caspase-3)抗体(货号ab184787)购自Abcam 公司。ECL 试剂盒和Annexin V-FITC/碘化丙啶(PI)凋亡检测试剂盒购自美国Becton Dickinson 公司。4%多聚甲醛购自广州硕谱生物科技有限公司。LipofectAMINE 2000 转染试剂、Trizol 试剂购自美国Invitrogen 公司,Transwell 小室、Matrigel 基质胶购自美国Corning公司。
Image-Pro Plus 数码医学图像分析系统购自北京麦克奥迪仪器仪表公司,CKX53 光学显微镜购自日本Olympus 公司,FACSCanto 流式细胞仪购自买美国BD 公司。
1.2 组织收集
收集2020 年1 月—2022 月12 月西安交通大学附属三二O 一医院进行外科手术切除的50 例胃癌组织标本和健康癌旁组织,包括36 例男性和14 例女性,所有患者术前均未接受放疗、化疗、靶向治疗或其他抗癌治疗。组织保存于液氮中备测。本研究经西安交通大学附属三二O 一医院医学伦理委员会批准(批号IRB20200017),患者均知情同意。
1.3 细胞培养、转染和分组
人胃癌细胞系SGC7901、MGC803 和正常胃黏膜上皮GES-1、AGS 细胞在含10%胎牛血清的RPMI 1640 完全养基中进行培养,每3 天更换1 次培养液,取对数生长期细胞进行后续实验。
将细胞分为空白组、转染错义序列siRNA 组、miR-155-5p 模拟物组、miR-155-5p 抑制剂组、氧化苦参碱组、氧化苦参碱+miR-155-5p 抑制物组。
1.4 qRT-PCR 法检测细胞系和组织中miR-155-5p水平
根据操作说明,使用TRIzol 法提取组织标本和细胞系的总RNA,使用反转录试剂盒生成cDNA,并以此为模板进行实时荧光定量PCR 检测靶基因的表达。使用靶基因Ct值法对基因相对表达进行定量。使用U6 作为内参分析miR-155-5p 的表达。miR-155-5p 引物序列为5’-TTAATGCTAATCGTGA TAGGGGT-3’,U6 引物序列为5’-CTCGCTTCGGC AGCACATATACT-3’。
分别用miR-155-5p 模拟物转染SGC7901、MGC803、GES-1、AGS 细胞,然后使用qRT-PCR筛选miR-155-5p 相对表达水平最高的细胞系进行后续实验。并用不同浓度(25、50、100、200 μmol/L)氧化苦参碱干预转染 miR-155-5p 模拟物的MGC803 细胞,在孵育24 h 后利用qRT-PCR 筛选出最佳氧化苦参碱干预浓度。
1.5 MTT 法测定检测miR-155-5p 和氧化苦参碱对胃癌细胞增殖的影响
根据LipofectAMINE 2000 转染试剂说明,分别将转染错义序列siRNA、miR-155-5p 模拟物、miR-155-5p 抑制剂转染MGC803 细胞。氧化苦参碱+miR-155-5p 模拟物组细胞为转染miR-155-5p 模拟物的MGC803 细胞与氧化苦参碱孵育24 h 后进行测定。将空白组、转染错义序列siRNA 组、miR-155-5p 模拟物组、miR-155-5p 抑制剂组、氧化苦参碱组、氧化苦参碱+miR-155-5p 抑制物组生长良好的细胞接种到96 孔板(3 000 个细胞/孔)中。将0.1 mg/mL MTT 试剂加入到培养基中继续培养4 h。之后向细胞中加入DMSO(150 μL/孔),摇震10 min后,使用酶标仪测量490 nm 处吸光度(A)值,并计算细胞抑制率。
1.6 细胞集落形成实验测定miR-155-5p 和氧化苦参碱对胃癌细胞增殖的影响
将空白组、错义序列组、miR-155-5p 模拟物组、miR-155-5p 抑制剂组、氧化苦参碱组、氧化苦参碱+miR-155-5p 抑制物组的细胞接种在100 mm 培养皿(2 000 个细胞/皿)中,给药同1.5 项下。每3天更换1 次培养基,并使细胞生长12 d 以形成菌落。细胞集落通过4%多聚甲醛固定,后用0.1%结晶紫溶液染色,计数细胞数>50 的集落。
1.7 流式细胞法检测miR-155-5p 和氧化苦参碱对胃癌细胞凋亡的影响
收集各组细胞并在4 ℃下使用PBS 漂洗2 遍。根据Annexin V-FITC/PI 凋亡试剂盒操作说明,将各组细胞悬浮在100 μL Annexin V 缓冲液中,并将加入5 μL Annexin V-FITC 和5 μL 碘化丙啶染色液到细胞悬液中。在室温下于黑暗中孵育20 min,然后使用FACSCanto 流式细胞仪分析细胞凋亡情况。
1.8 Transwell 实验检测miR-155-5p 和氧化苦参碱对胃癌细胞迁移和侵袭作用的影响
在8 μm 滤膜孔的Transwell 小室中测量细胞侵袭作用。侵袭作用检测:Transwell 过程按照操作说明进行,在包含Matrigel 基质胶的Transwell 上室添加200 μL 细胞,上室和下室中分别加入200 μL无血清培养基和600 μL 20% FBS 的培养基并在37 ℃下孵育24 h。用PBS 洗涤后,用4%多聚甲醛固定1 h,并用0.1%结晶紫溶液染色15 min。冲洗掉多余的染料,并在400倍的显微镜下随机选择5~10 个区域对细胞进行拍照。迁移实验时不添加Matrigel 基质胶。
1.9 蛋白质印迹法检测Claudin 1、c-Myc、cyclin D1、Bcl-2、Caspase-3 蛋白的表达
收集各组细胞,分别提取总蛋白质,并用BCA法测定蛋白水平。其中蛋白质样品(20 μg)通过8%SDS-PAGE 分离,后恒流转至PVDF 膜上。再在室温用5%脱脂牛奶封封闭条带3 h,之后分别加入Claudin 1 抗体(1∶1 000)、Caspase-3 抗体(1∶1 000)、Bcl-2 抗体(1∶1 000)、c-Myc 抗体(1∶1 000)和GAPDH(1∶1000)在4 ℃下孵育过夜,然后与辣根过氧化物酶偶联的二抗(1∶2 000)在室温下孵育1 h。以GAPDH 灰度值为内参,用Image J 软件对不同蛋白的相对表达量进行定量分析。
1.10 统计学分析
研究数据使用SPSS 22 软件进行统计分析。计量数据采用进行,多组间差异使用ANOVA方差分析进行,两两比较使用SNK 法。
2 结果
2.1 miR-155-5p 在胃癌组织和细胞中的表达情况
qRT-PCR 结果显示,与癌旁组织和胃黏膜细胞(GES-1 和AGS 细胞)相比,在胃癌组织和胃癌细胞系MGC803 中miR-155-5p 相对表达量显著升高(P<0.001),见图1A、B。由于MGC803 细胞中miR-155-5p 相对表达量最高,因此后续研究使用此细胞进行。不同浓度氧化苦参碱与转染miR-155-5p模拟物的MGC803 细胞培养24 h 后,miR-155-5p的表达随着氧化苦参碱剂量增加而降低(P<0.05、0.01、0.001),见图1C。经预实验,氧化苦参碱干预MGC803 细胞的最佳浓度为100 μmol/L,此浓度下细胞抑制率为(47.34±2.44)%。
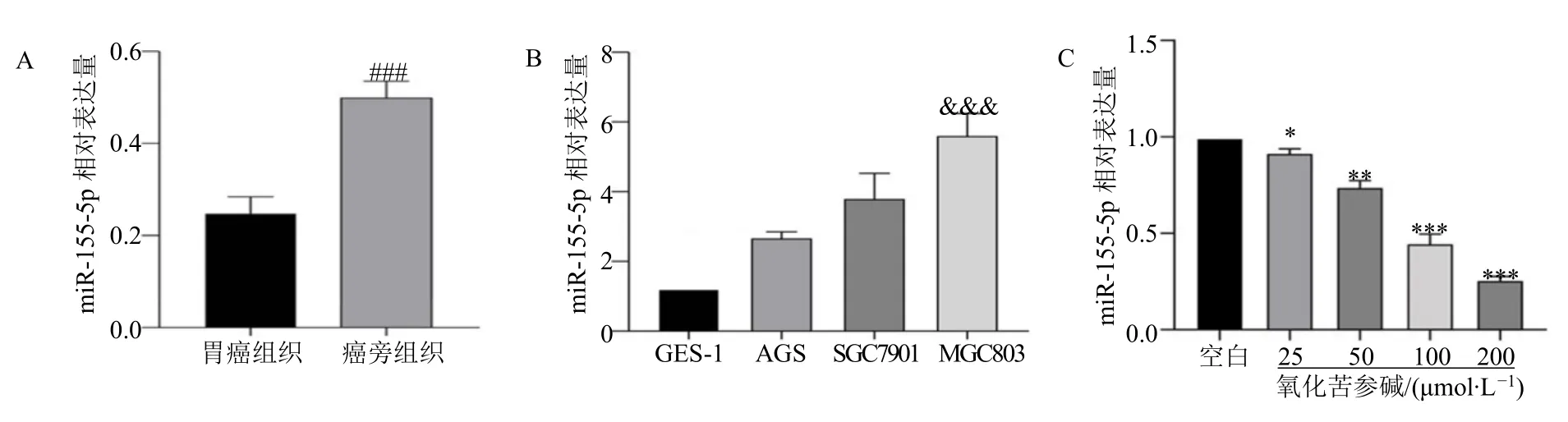
图1 miR-155-5p 在胃癌组织、癌旁组织和不同细胞系中的表达差异(,n =3)Fig.1 miR-155-5p Expression differences in gastric cancer tissues,paracancer tissues,and different cell lines (,n =3)
2.2 氧化苦参碱对胃癌细胞增殖的影响
MTT 实验表明,与空白组、转染错义序列siRNA 组相比,miR-155-5p 模拟物的转染后MGC803 细胞活力显著增加(P<0.05);而miR-155-5p 抑制剂组、氧化苦参碱组、氧化苦参碱+miR-155-5p 抑制剂组均可显著抑制胃癌细胞和转染miR-155-5p 模拟物细胞活力(P<0.01、0.001),见图2A。
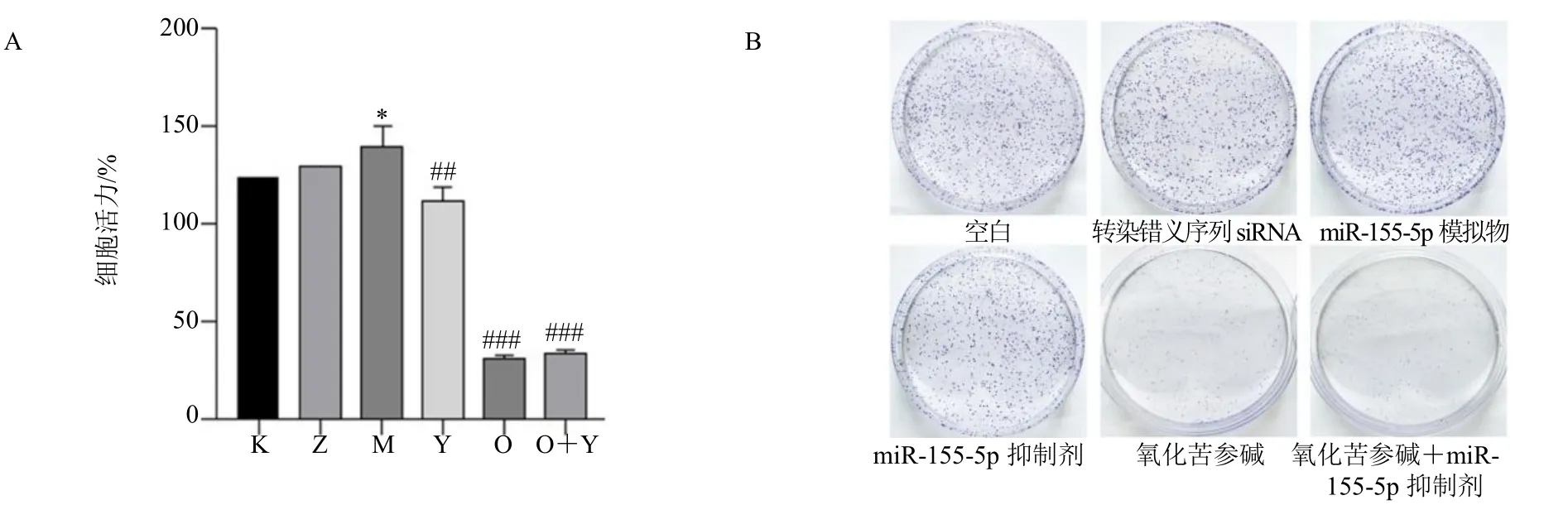
图2 氧化苦参碱对胃癌细胞增殖的影响Fig.2 Effect of oxymatrine on proliferation of gastric cancer cells
细胞集落形成实验中发现,miR-155-5p 模拟物转染后MGC803 细胞集落生成增加,而miR-155-5p抑制剂组、氧化苦参碱组、氧化苦参碱+miR-155-5p 抑制剂组处理后的胃癌细胞与miR-155-5p 模拟物的转染后MGC803 细胞相比,集落显著被抑制,见图2B。
2.3 氧化苦参碱对胃癌细胞凋亡的影响
流式细胞仪检测细胞凋亡结果显示,与转染错义序列siRNA 组相比,miR-155-5p 模拟组胃癌细胞凋亡率降低(P<0.01),而miR-155-5p 抑制剂组、氧化苦参碱组、氧化苦参碱+miR-155-5p 抑制剂组可显著增加胃癌细胞凋亡比例,同样可以增加转染miR-155-5p-模拟物的胃癌细胞凋亡(P<0.01、0.001),见图3。

图3 氧化苦参碱对胃癌细胞的凋亡作用Fig.3 Effect of oxymatrine on apoptosis of gastric cancer cells
2.4 氧化苦参碱对胃癌细胞迁移和侵袭的影响
Transwell 实验结果显示,与空白组、转染错义序列siRNA 组相比,miR-155-5p-模拟物组的细胞迁移和侵袭细胞数显著增加(P<0.001),而miR-155-5p 抑制剂组、氧化苦参碱组、氧化苦参碱+miR-155-5p 抑制剂组细胞迁移和侵袭细胞数量降低(P<0.001),见图4。
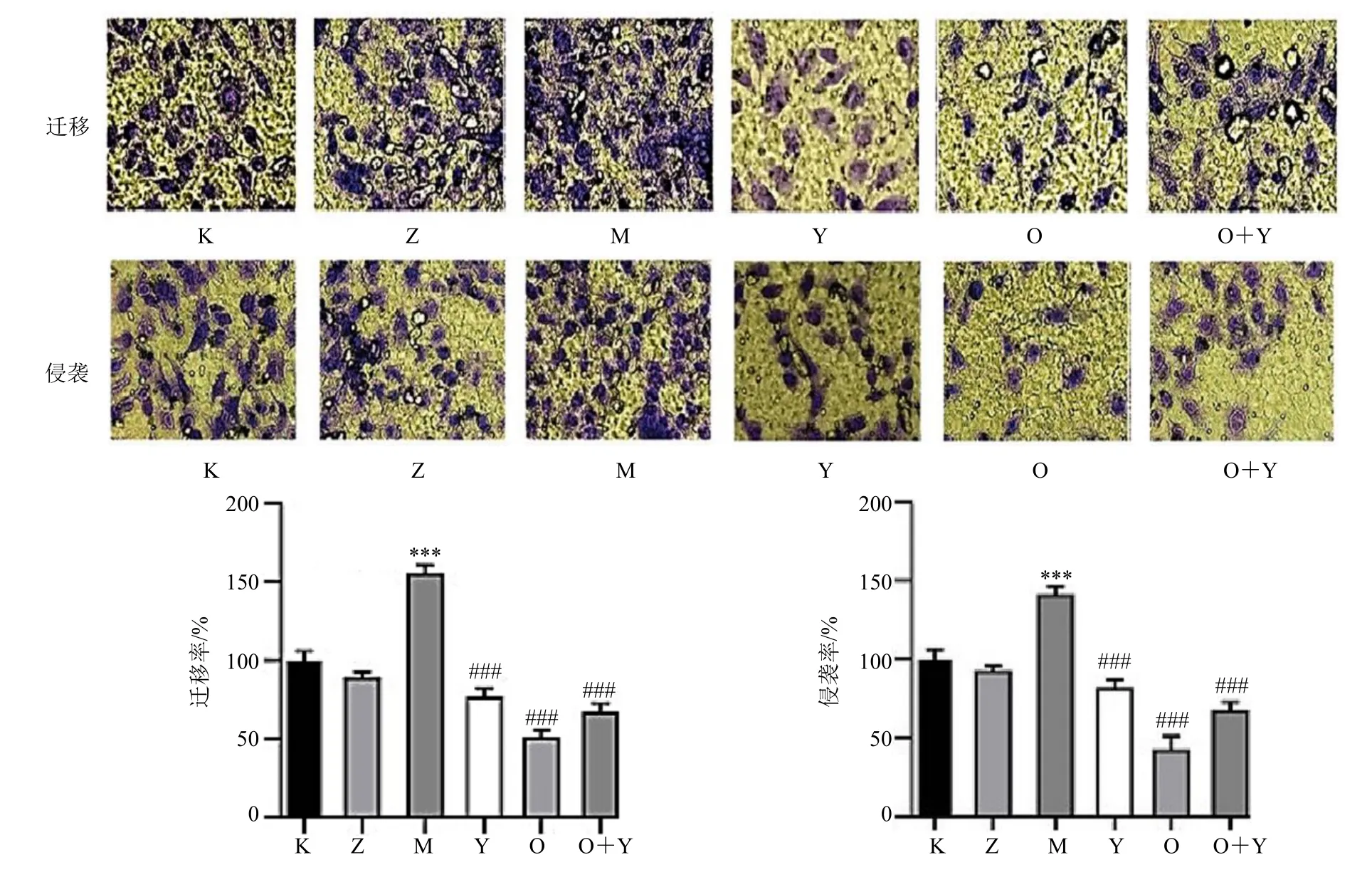
图4 Transwell 法检测氧化苦参碱对MGC803 细胞的迁移和侵袭的影响(×400)Fig.4 Effects of oxymatrine on migration and invasion of MGC803 cells by Transwell assay (×400)
2.5 氧化苦参碱对miR-155-5p 靶基因和细胞周期蛋白表达的影响
使用蛋白质印迹法检测分析显示,与空白组、错义序列组相比,miR-155-5p 模拟组的Claudin 1、c-Myc、Cyclin D1、Bcl-2 相对表达量增加,而Caspase-3 相对表达量降低(P<0.01、0.001)。miR-155-5p 抑制剂组、氧化苦参碱组和氧化苦参碱+miR-155-5p 模拟组的Claudin 1、c-Myc、Cyclin D1和Bcl-2 表达较miR-155-5p 模拟组下降,Caspase-3 表达增加(P<0.001),见图5。
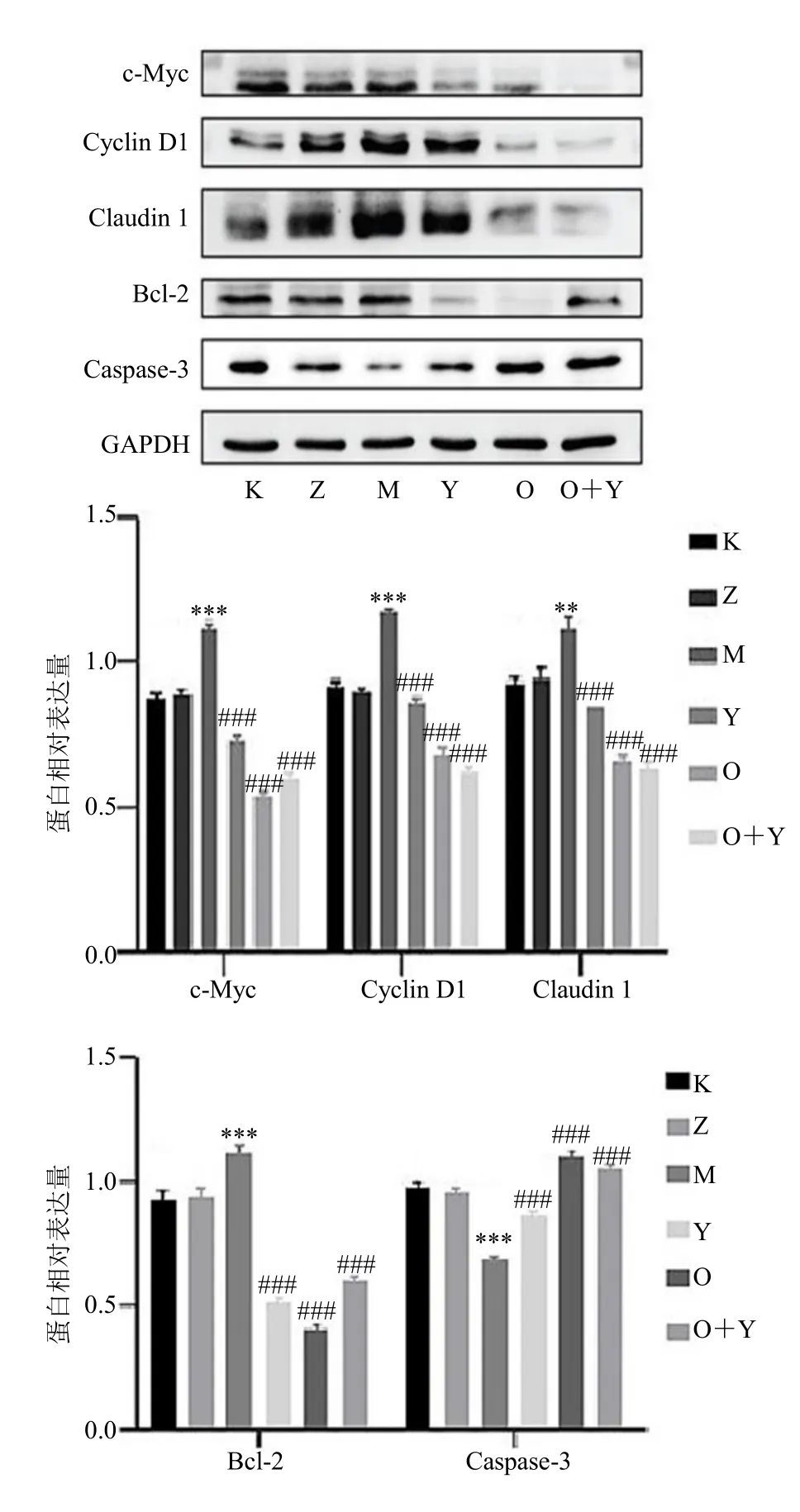
图5 氧化苦参碱对MGC803 细胞中miR-155-5p 靶基因蛋白的表达Fig.5 Expression of miR-155-5p target gene protein in MGC803 cells induced by oxymatrine
3 讨论
胃癌是一种发病机制相对复杂的恶性肿瘤,其中遗传因素涉及原癌基因激活、抑癌基因失活,以及相关信号通路的异常调节等多个方面[3]。对胃癌进展的机制研究有利于阐明其发病原因,并对开发更有效的新药以提高疗效具有重要意义。氧化苦参碱是一种多靶点抗肿瘤药物,越来越多的研究已经表明了其在不同肿瘤类型中的抗肿瘤作用[5,14-15]。目前已经在体内和体外研究中均证实了氧化苦参碱可抑制胃癌细胞生长、降低细胞的存活率、诱导胃癌细胞的凋亡[7-8]。近年来研究表明,苦参碱衍生物可在肝细胞癌中通过磷脂酰肌醇-3-羟激酶(PI3K)-蛋白激酶B(Akt)通路抑制细胞生长,促进细胞凋亡[16]。还可通过Wnt/β-连环蛋白(Wnt/βcatenin)信号通路增加肺癌细胞的放疗敏感性[17]。然而,氧化苦参碱能否直接抑制胃癌中的miR-155-5p 的表达仍未知。
人类已经发现了近3 000 种miRNA,根据推测miRNA 可能调节人类一半以上的基因表达。在过去的几十年里,miRNA 在癌症生物学中的作用得到了广泛的研究。一些miRNA 参与肿瘤细胞侵袭和转移,而一些miRNA 则与癌症患者的预后密切相关,因此miRNA 已经成为肿瘤诊断和干预靶点的研究热点[18]。本研究中探讨了氧化苦参碱通过调节胃癌中的miR-155-5p 表达水平,干预胃癌细胞的生物学行为作用。通过比较miR-155-5p 在胃癌组织和癌旁组织、胃癌细胞系和正常胃黏膜细胞系中表达可见,胃癌细胞中miR-155-5p 表达显著升高,这与既往研究类似[19]。本研究选用了胃癌细胞系中miR-155-5p 表达最高的MGC803 细胞进行了后续研究。
加速细胞周期进程是大多数实体瘤的共同特征。为了证明miR-155-5p 过表达可以加速细胞周期,本研究分析过表达或抑制miR-155-5p 表达对胃癌细胞影响可见,miR-155-5p 过表达可促进胃癌细胞增殖、迁移和侵袭,并抑制细胞凋亡。根据文献报道,miR-155-5p 可能在胃癌细胞中作为肿瘤启动子起作用[19]。而使用氧化苦参碱干预后发现,氧化苦参碱可降低胃癌细胞增殖、迁移和侵袭,并促进细胞凋亡。此外氧化苦参碱可以降低miR-155-5p 模拟物对胃癌细胞的恶性生物学行为。
参考相关文献后,本研究选择了miR-155-5p 3个候选靶基因,即Claudin 1、Caspase-3、c-Myc。Claudin 1 是细胞紧密连接的重要组成部分,在许多不同的肿瘤中异常表达。在肝细胞癌中,角蛋白8和角蛋白18 的缺失通过上调Claudin 2 表达促进HepG1 细胞的增殖、侵袭和转移[20]。c-Myc 作为转录因子,在控制细胞生长、活力、凋亡和细胞转化中起着重要的作用[21]。此外,细胞周期蛋白D1 在癌症发病机制中发挥关键作用,其上调表达驱动不受控制的细胞增殖[22]。在本研究结果中,与空白组相比,miR-155-5p 模拟物组中Claudin、cyclin D、c-Myc 的表达水平上调,表明miR-155-5p 在细胞周期的启动和进展中起重要作用。当c-Myc 表达受到抑制时,细胞生长受阻,细胞在细胞周期的G0/G1期积累,导致细胞凋亡加速。细胞凋亡是一个平衡细胞存活和死亡的稳态过程[23]。Caspase-3 的激活是细胞凋亡的关键过程,Caspase-3 活性增加被认为是细胞凋亡的标志物。Bcl-2 参与凋亡途径,在控制细胞凋亡和增强细胞存活率方面具有一定意义[23]。本研究表明,氧化苦参碱可通过miR-155-5p 调节可抑制c-Myc、Caspase-3、Bcl-2 表达促进细胞凋亡。
综上所述,本研究发现了胃癌细胞中miR-155-5p 中过度表达,氧化苦参碱可能通过miR-155-5p分子靶点发挥抗肿瘤作用。
利益冲突所有作者均声明不存在利益冲突
