亚精胺促进线粒体自噬缓解急性胰腺炎的分子机制研究
2023-08-17巴穆登阿布力克木吾拉音吴朝阳
巴穆登,阿布力克木·吾拉音,吴朝阳
新疆维吾尔自治区人民医院 急诊创伤外科,新疆 乌鲁木齐 830001
急性胰腺炎是一种胰腺炎性疾病,其发病率和死亡率都很高。急性胰腺炎的全球发病率为0.034%,并且在全球范围内呈上升趋势[1]。通常大多数患者表现为轻度急性胰腺炎,具有自限性,症状一般在1 周内消退;约有20%的患者将发展为中度或重度急性胰腺炎,伴有胰腺/胰周组织坏死和/或器官衰竭,此类患者死亡率高达20%~40%[1]。随着临床管理水平的不断提高,急性胰腺炎的全球总死亡率在持续下降,目前约为2%[1-2]。胆结石继发的胰腺导管阻塞为急性胰腺炎最常见的病因;其次为酒精;其他原因包括内镜逆行胰胆管造影和各种药物引发病理性细胞通路和细胞器功能障碍,上述病因均将导致急性胰腺炎的标志性事件胰腺腺泡细胞死亡,以及局部或全身炎症反应的发生[3]。肥胖、胆石症、高三酰甘油血症和糖尿病与急性胰腺炎独立相关[4]。
虽然急性胰腺炎的全球疾病负担沉重,但目前仍未有治疗或预防急性胰腺炎的有效药物[5]。急性胰腺炎的临床管理包括准确的诊断,适当的分诊和高质量的支持治疗,对并发症的监测和治疗,以及预防复发。在支持治疗中,最为有效的是急性胰腺炎发病后最初的12~24 h 积极的进行补液治疗;超出24 h,则临床意义不大。其次为急性胰腺炎发病24 h 后给予适当的进食和肠内营养治疗、内镜治疗、在急性胰腺炎发病4 周后才开始进行的广谱抗生素治疗,以及对积液和坏死的处理[4-5]。
巨自噬/自噬是一种进化上保守的途径,负责清除细胞溶质蛋白质聚集体、受损细胞器或入侵微生物。自噬的激活是机体应对外在(环境)和内在(代谢)压力,在进化上保守的适应机制,其失调会导致各种疾病状态,如神经退行性疾病、心血管疾病、传染性、自身免疫性疾病和癌症等[6-7]。在多项实验动物急性胰腺炎模型研究和急性胰腺炎患者的胰腺腺泡细胞中,能够观察到积聚有大量液泡,而这已被证明是与自噬功能异常相关的病理性液泡。由于自噬过程受损,这些液泡中含有未被正常降解的受损的长寿命蛋白质和其他损伤细胞器,并且这些病理性液泡将相互融合,在急性胰腺炎组织中呈现为空泡化的胰腺腺泡细胞[8-9]。特别是自噬功能异常后,胞质内过早激活的胰蛋白酶原未被及时降解,将进一步破坏胰腺腺泡细胞胞质细胞器,自噬泡内大量未降解脂质的积累还导致腺泡细胞脂质代谢异常,加剧腺泡细胞的炎症水平[10]。亚精胺是一种天然多胺,可激活细胞的保护性巨自噬/自噬[11-12]。外源性补充亚精胺可延长包括酵母、线虫、果蝇和小鼠在内的多个物种的寿命,并维持个体健康。在人类最近的流行病学数据表明,增加对富含亚精胺的食物的摄取能够降低与心血管疾病和癌症相关的总体死亡率[13]。亚精胺对自然衰老大鼠和D-半乳糖诱导的加速衰老模型具有明显的神经保护作用。亚精胺通过上调衰老大鼠脑组织的自噬和线粒体自噬水平,降低脑组织中的促氧化剂和氧化应激水平,减少神经炎症来对抗衰老引起的神经损伤[12]。在研究拟向急性胰腺炎小鼠模型腹膜内注射亚精胺治疗或腹膜内注射给予亚精胺+线粒体自噬抑制剂环孢菌素A 处理,通过测定模型小鼠胰腺炎缓解情况,评价亚精胺的疗效,并探索其作用机制。
1 材料与方法
1.1 材料
1.1.1实验动物 20 只6~7 周龄雄性C57BL/6J 小鼠,体质量18.0~20.0 g,购自新疆维吾尔自治区疾病预防控制中心(批号79011345)。饲养于恒温(22~25 ℃)、恒湿、具备12/12 h 光暗循环的标准SPF 级动物房。每4 只小鼠一个鼠笼。小鼠自由进食和饮水。在造模实验开始前,先对小鼠进行适应性饲养1 周。动物实验经新疆维吾尔自治区人民医院伦理委员会审核批准,审批号KY202205130129。
1.1.2试剂 末端脱氧核苷酸转移酶生物素-dUTP缺口末端标记(TUNEL)试剂盒(DAB 法)(货号T10245)购自南京博恩生物(中国)公司。小鼠血清白细胞介素-6(IL-6,货号ml063160)、肿瘤细胞坏死因子-α(TNF-α,货号ml002095)、白细胞介素-1β(IL-1β,货号ml037875)和超敏C 反应蛋白(CRP,货号ml038364)ELISA 试剂盒购自上海酶联生物(中国)公司。抗原修复液(货号R20911)购自上海源叶生物(中国)公司。山羊血清购自上海名劲生物(中国)公司。兔抗小鼠髓过氧化物酶(MPO)单抗(ab208670)、兔抗小鼠细胞质基质型LC3(LC-3Ⅰ)/Ⅱ多抗(ab128025)、兔抗小鼠泛素结合蛋白(p62)单抗(ab109012)、兔抗小鼠NOD 样受体热蛋白结构域相关蛋白3(NLRP3)单抗(ab263899)、兔抗小鼠pro-半胱氨酸天冬氨酸蛋白酶(Caspase-1)+p10+p12 单抗(ab179515)、兔抗小鼠IL-1β单抗(ab254360)、兔抗小鼠PTEN 诱导假定激酶1(PINK1)单抗(ab300623)、兔抗小鼠Parkin 多抗(ab73015)、山羊抗兔IgG H&L(HRP)二抗(ab6721)兔抗小鼠甘油醛-3-磷酸脱氢酶(GAPDH)单抗(Ab9485)均购自Abcam 公司。蛋白酶抑制剂(货号P2714)和磷酸酶抑制剂(货号P2850)、亚精胺(货号S2501)、环孢菌素A(货号Y0002292)购自Sigma-Aldrich(美国)公司。RIPA 裂解液(货号89900)和JC-1 染料(货号T3168)购自Thermo Fisher(美国)公司。组织线粒体提取试剂盒(货号C0010-50)购自北京普利莱生物(中国)公司。
1.1.3仪器 ECLIPSE Ni-E 光学显微镜购自Nikon(日本)公司。Infinite F50 荧光酶标仪购自Tecan(美国)公司。
1.2 方法
1.2.1急性胰腺炎小鼠模型构建 通过每小时向小鼠腹膜内注射1 次50 μg/kg 的蛙皮素(蛙皮素溶于无菌生理盐水中),连续注射10 次,构建急性胰腺炎小鼠模型。在末次注射结束后24 h,眼眶静脉丛采集小鼠外周静脉血,通过ELISA 测定血清胰蛋白酶水平,以及细胞因子IL-6、TNF-α、IL-1β、CRP的水平判定造模成功的情况。
1.2.2分组和处理 动物实验分组为对照组、模型组、亚精胺组、亚精胺+环孢菌素A 组,每组5 只。模型组小鼠按照1.2.1 项下急性胰腺炎小鼠模型构建的方法注射蛙皮素建模;对照组按照同模型组的处理方式注射等体积无菌生理盐水;亚精胺组在模型小鼠连续10 次注射蛙皮素结束后,立即腹膜内注射100 mmol 的亚精胺(溶于200 µL PBS 中)[13];亚精胺+环孢菌素A 组在模型小鼠给予亚精胺治疗的同时,腹膜内注射10 mg/kg 的环孢菌素A[14]。
1.2.3苏木精–伊红(HE)染色 采用CO2窒息法安乐死小鼠后,迅速取小鼠胰腺组织,然后将其于4 ℃在4%甲醛中固定48 h[15]。然后对固定好的组织进行石蜡包埋和切片,切片厚度为4 μm。随后使用HE 染色试剂盒对切片进行HE 染色。在Nikon光学显微镜下,以200 倍放大观察组织切片中10 个不同的视野,以评估胰腺组织损伤的严重程度。
1.2.4TUNEL 染色 使用TUNEL 试剂盒进行染色确定胰腺腺泡细胞凋亡的情况。具体实验操作步骤遵循试剂盒的说明书进行。在Nikon 光学显微镜下对完成TUNEL 染色的切片进行观察和拍照。使用Image-Pro Plus v6.0 对图像进行分析,将具有深棕色细胞核的腺泡细胞计数为TUNEL 阳性细胞。
1.2.5ELISA 法检测炎性因子水平 从小鼠眼眶静脉丛采集血液样本,将血样加入至肝素抗凝管中,轻轻混匀后,保存于4 ℃冰箱,并于24 h 内进行ELISA 测定。使用ELISA 试剂盒对血清IL-6、TNF-α、IL-1β、CRP 的水平进行测定,具体的测定步骤按照试剂盒的说明书进行。
1.2.6免疫组织化学染色(IHC)事先制备好胰腺组织切片,方法如前1.2.3 项下所述。将切片完全浸没入抗原修复液中,使用微波炉高火加热至沸腾,然后继续加热10 min;再从微波炉取出,将抗原修复液自然冷却至室温。取出切片,向切片滴加3%的双氧水,室温下避光封闭30 min;再向切片上滴加含4%山羊血清的封闭缓冲液,室温下封闭切片1 h;然后向切片滴加髓过氧化物酶(MPO)一抗工作液(稀释度为1∶250),4 ℃下共同孵育过夜;次日向切片滴加山羊抗兔IgG H&L(HRP)二抗工作液(稀释度为1∶500),室温下共同孵育1 h。再向切片滴加生物素底物,室温下共同孵育30 min;向切片滴加DAB 显色液,室温下避光显色5~10 min。然后在Nikon 光学显微镜下镜检、观察和拍照。
1.2.7Western blotting 法检测相关蛋白表达 使用添加有蛋白酶抑制剂和磷酸酶抑制剂的RIPA 裂解液裂解胰腺组织。使用含5%脱脂奶粉的TBS 溶液,在室温下封闭PVDF 膜1 h。向PVDF 膜上滴加一抗工作液,并在4 ℃条件下使膜与一抗工作液共同孵育过夜。次日,向PVDF 膜上滴加二抗工作液,并在室温下使膜与二抗工作液共同孵育1 h。向PVDF 膜上滴加ECL 超敏化学发光底物,对目的条带进行显影。使用Image J v1.8.0 对目的条带LC-3Ⅰ、LC-3Ⅱ、p62、NLRP3、Caspase-1、cleaved-Caspase-1、IL-1β、PINK1、Parkin 和GAPDH 的灰度值进行定量分析。
1.2.8线粒体膜电势测定 使用组织线粒体提取试剂盒从胰腺组织中提取线粒体。使用染料JC-1 测定线粒体膜电位的水平。具体方法为将组织用PBS冲洗去除残余血液,然后在冰冷的线粒体裂解试剂中将胰腺组织匀浆。随后将匀浆液以1 000 ×g,在4 ℃条件下离心5 min。弃沉淀,收集含有线粒体的上清液,再以3 500 ×g在4 ℃条件下离心10 min。再次弃沉淀,收集纯化好的含有线粒体的上清液,置于冰上备用。向此纯化好的含有线粒体的上清液中加入JC-1 染色液。将上述混合液以每孔200 μL的体积加入至96 孔板中。每组样品设置5 个复孔,分别对应每个分组中的5 只小鼠。同时制备标准曲线孔。使用荧光酶标仪对每孔的荧光强度进行测定,根据标准曲线对样品孔中膜电位进行定量。
1.2.9统计学分析 定量数据以5 次独立样本测定结果的表示。使用GraphPad Prism v6.0 软件对计量数据进行统计学分析。多组间差异的比较采用单因素方差分析(one-way ANOVA)。
2 结果
2.1 亚精胺对急性胰腺炎小鼠胰腺组织损伤程度的影响
如图1 染色结果所示,与对照组胰腺组织相比,模型组胰腺组织呈现出炎症表型,表现为胰腺组织中浸润了大量中性粒细胞(图中红色箭头所示),腺泡细胞肿胀和坏死;亚精胺组胰腺组织的炎症程度大大减弱,表现为几乎不存在中性粒细胞的大量浸润,腺泡细胞肿胀程度明显减弱,基本无腺泡细胞坏死;亚精胺+环孢菌素A 组胰腺组织的炎症程度呈严重状态,表现为存在大量中性粒细胞浸润(图中红色箭头所示),腺泡细胞严重肿胀。

图1 HE 染色观察亚精胺对急性胰腺炎小鼠胰腺组织的影响(×200)Fig.1 Effect of spermidine on pancreatic tissue of mice with acute pancreatitis observed by HE staining(×200)
如图2 TUNEL 染色结果所示,与对照组胰腺组织相比,模型组胰腺组织TUNEL 染色阳性细胞数明显增多,胰腺组织中浸润大量中性粒细胞(图中红色箭头所示)。与模型组相比,亚精胺组胰腺组织TUNEL 染色阳性细胞数明显减少,胰腺组织中仅浸润少量中性粒细胞(图中红色箭头所示)。与亚精胺组相比,亚精胺+环孢菌素A 组胰腺组织TUNEL 染色阳性细胞数明显增多,胰腺组织中存在中性粒细胞大量浸润(图中红色箭头所示)。

图2 TUNEL 染色观察亚精胺对急性胰腺炎小鼠胰腺组织的影响(×200)Fig.2 Effect of spermidine on pancreatic tissue of mice with acute pancreatitis was observed by TUNEL staining (×200)
2.2 亚精胺对急性胰腺炎小鼠血清炎性因子和胰腺组织MPO 水平的影响
如图3 血清ELISA 结果显示,与对照组相比,模型组小鼠血清IL-6、TNF-α、IL-1β、CRP 的水平明显升高(P<0.05)。与模型组相比,亚精胺组小鼠血清IL-6、TNF-α、IL-1β、CRP 的水平明显降低(P<0.05)。与亚精胺组相比,亚精胺+环孢菌素A组血清IL-6、TNF-α、IL-1β、CRP 的水平明显升高(P<0.05)。
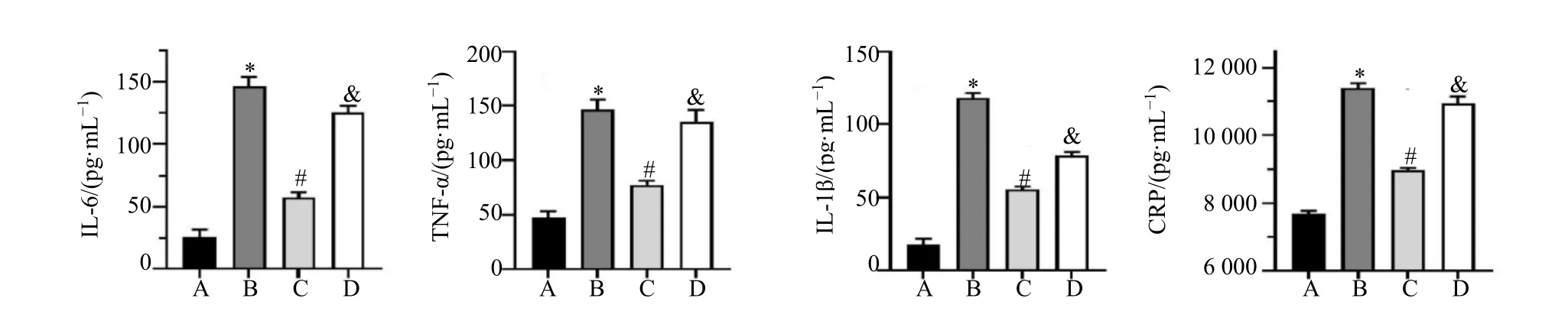
图3 ELISA 法测定亚精胺对急性胰腺炎小鼠血清炎性因子水平的影响(,n =5)Fig.3 Effect of spermidine on serum inflammatory factors in mice with acute pancreatitis was determined by ELISA (,n =5)
如图4 IHC 染色结果所示,与对照组相比,模型组MPO IHC 阳性染色细胞数明显增多。与模型组相比,亚精胺组MPO IHC 阳性染色细胞数明显降低。与亚精胺组相比,亚精胺+环孢菌素A 组MPO IHC 阳性染色细胞数明显增多。
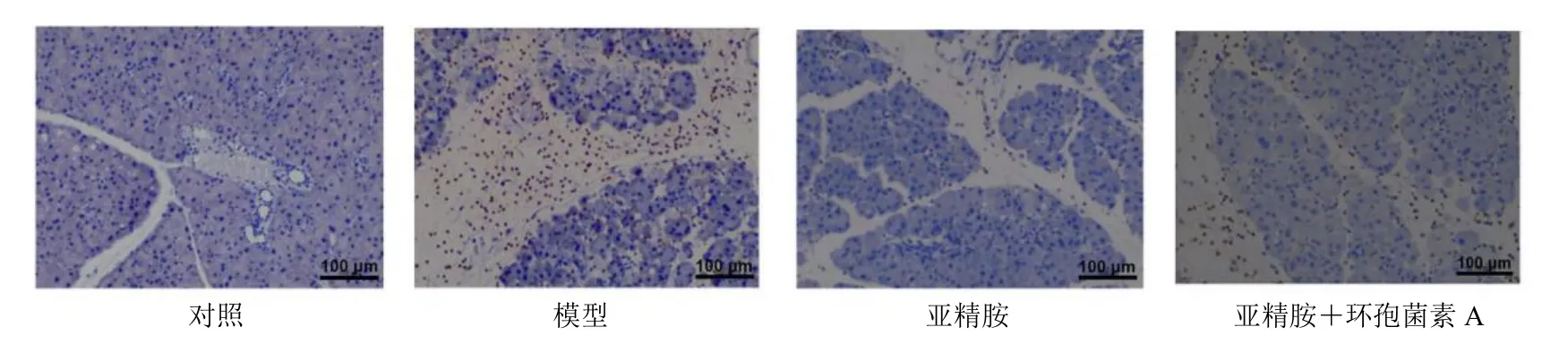
图4 IHC 检测亚精胺对急性胰腺炎小鼠胰腺组织MPO 的影响(×200)Fig.4 Effect of spermidine on MPO in pancreatic tissue of mice with acute pancreatitis detected by IHC (×200)
2.3 亚精胺对急性胰腺炎小鼠胰腺组织的巨自噬水平
如图5 所示,与对照组相比,模型组胰腺组织中巨自噬标志物LC-3Ⅰ/Ⅱ值明显增高,p62 表达水平明显降低(P<0.05)。与模型组相比,亚精胺组胰腺组织中LC-3Ⅰ/Ⅱ值明显增高,p62 的表达水平明显降低(P<0.05)。与亚精胺组相比,亚精胺+环孢菌素A 组胰腺组织中LC-3Ⅰ/Ⅱ值明显降低,p62 的表达水平明显增高(P<0.05)。

图5 亚精胺对急性胰腺炎小鼠胰腺组织相关蛋白的影响(,n =5)Fig.5 Effects of spermidine on pancreatic tissue-related proteins in mice with acute pancreatitis (,n =5)
与对照组相比,模型组胰腺组织中炎症小体标志物NLRP3、IL-1β、cleaved-Caspase-1 的表达水平明显增高(P<0.05)。与模型组相比,亚精胺组胰腺组织中NLRP3、IL-1β、cleaved-Caspase-1 的表达水平明显降低(P<0.05)。与亚精胺组相比,亚精胺+环孢菌素A 组胰腺组织中NLRP3、IL-1β、cleaved-Caspase-1 的表达水平明显增高(P<0.05)。Caspase-1 的表达水平在各组间没有明显差异。
2.4 亚精胺对小鼠胰腺组织的线粒体自噬水平的影响
如图6A 线粒体膜电势水平结果所示,与对照组相比,模型组小鼠线粒体跨膜电位明显降低(P<0.05);与模型组相比,亚精胺组线粒体跨膜电位明显升高(P<0.05);与亚精胺组相比,亚精胺+环孢菌素A 组线粒体跨膜电位明显降低(P<0.05)。如图6B、C 结果所示,与对照组相比,模型组胰腺组织中PINK1 和p-Parkin 表达水平明显升高(P<0.05);与模型组相比,亚精胺组胰腺组织中PINK1和p-Parkin 的表达水平明显升高(P<0.05);与亚精胺组相比,亚精胺+环孢菌素A 组胰腺组织中PINK1 和p-Parkin 的表达水平明显降低(P<0.05)。Parkin 的表达水平在各组间没有明显差异。

图6 亚精胺对急性胰腺炎小鼠胰腺组织线粒体自噬水平的影响(,n =5)Fig.6 Effect of spermidine on mitochondrial autophagy in pancreatic tissue of mice with acute pancreatitis (,n =5)
3 讨论
急性胰腺炎发病机制的核心细胞事件为病理性胞质内钙信号增强,线粒体功能障碍,腺泡细胞和巨噬细胞内胰蛋白酶原过早激活,内质网应激,未折叠蛋白反应(UPR)受损和自噬受损[4,11,16-17]。腺泡细胞中Ca2+浓度的病理性升高是急性胰腺炎的中心事件,它介导促细胞死亡和促炎途径,如胰蛋白酶原的过早激活、内质网应激和线粒体功能障碍[18]。细胞质内Ca2+超载导致线粒体通透性转换孔在高电导状态下打开,这一过程导致生成ATP 所必需的线粒体膜电势丧失,引起ATP 合成停滞[18-19]。而ATP 的耗竭又将导致ATP–依赖性细胞保护机制,如自噬和UPR 功能受损;以及引起ATP–依赖性光面内质网Ca2+通道(SERCAs)和质膜Ca2+通道(PMCA)的功能被破坏,使得细胞无法清除过多的胞质Ca2+而使有毒的高浓度的Ca2+永久存在于胞质内。继发于细胞内Ca2+超载,线粒体功能障碍将最终导致腺泡细胞坏死。本次研究中也显示,与对照组相比,模型组腺泡细胞内的线粒体膜电势水平明显降低,表明线粒体功能明显受损。已有研究证明,在急性胰腺炎和重症急性胰腺炎小鼠模型中,线粒体功能均受损。PINK1 和PARK2 基因敲除小鼠对重症急性胰腺炎的发作更敏感[20]。许多学者认为,提高线粒体自噬水平,及时、有序的清除局部受损的线粒体和坏死腺泡细胞,将损伤局限在小范围内,防止继发性损伤和炎症反应的扩大,对防止急性胰腺炎的恶化十分关键。线粒体自噬属于巨自噬,涉及选择性靶向和吞噬线粒体,通过溶酶体降解去除受损线粒体。该途径的激活是因线粒体受损的程度超出了其他质量控制方法能够解决的能力,或者在细胞需要去除线粒体以用于代谢或发育等目的的情况下[21]。因受损的线粒体不仅缺乏制造ATP 和其他生物活性物质的能力,而且还会释放更高水平的活性氧自由基(ROS)。这又会成为反馈信号,进一步增强ROS 的积累,激活NLRP3炎症小体,并使细胞对蛋白质和DNA 的氧化损伤敏感。同时,缺陷线粒体的积累还将通过释放前–死亡分子导致细胞死亡[22]。因此,在线粒体损伤的情况下,线粒体自噬去除故障线粒体,可将胞内线粒体种群维持在最佳状态[21]。亚精胺是一种小分子细胞巨自噬/线粒体自噬诱导剂。亚精胺通过诱导自噬,吞噬和更新衰老和受损神经元,提高实验动物和人类个体的认知能力,在阿尔兹海默症和帕金森病中起到保护功效[23-25]。亚精胺通过诱导自噬和抑制内质网应激导致的小鼠肺泡细胞死亡缓解博来霉素诱导的肺纤维化[26]。但亚精胺是否能够用于缓解急性胰腺炎尚未有明确报道。在本次研究中,给予急性胰腺炎小鼠模型以亚精胺治疗,或给予急性胰腺炎小鼠模型以亚精胺+线粒体自噬抑制剂环孢菌素A 处理,结果显示,给予急性胰腺炎小鼠模型以亚精胺治疗,与模型组相比,亚精胺组腺泡细胞内线粒体膜电势水平明显升高。使用Western blotting 法针对线粒体自噬相关蛋白表达水平的检测也表明,与对照组相比,模型组PINK1 和p-Parkin的表达水平明显增强;与模型组相比,亚精胺组PINK1 和p-Parkin 的表达水平进一步上调。这表明当急性胰腺炎发生后,线粒体自噬被激活,而亚精胺处理能够进一步增强这种线粒体自噬的水平。与此同时,与模型组相比,亚精胺组腺泡细胞内巨自噬水平明显上调,表现为LC-3Ⅰ/Ⅱ的水平进一步增强,p62 的表达水平进一步降低。腺泡细胞内NLRP3 炎症小体的水平明显降低,表现为与模型组相比,亚精胺组腺泡细胞中NLRP3、IL-1β、cleaved-Caspase-1 的表达水平均明显降低;小鼠全身性炎症水平明显下调,表现为与模型组相比,亚精胺组小鼠血清IL-6、TNF-α、IL-1β、CRP 的水平均明显降低;小鼠胰腺组织MPO 阳性细胞数量明显减少。与模型组相比,HE 染色显示亚精胺组胰腺组织的炎症程度大大减弱,几乎不存在中性粒细胞的大量浸润,腺泡细胞肿胀程度明显减弱;TUNEL 染色显示亚精胺组胰腺组织TUNEL 染色阳性细胞数明显减少。而使用环孢菌素A 抑制线粒体自噬后,亚精胺缓解急性胰腺炎小鼠胰腺组织损伤的功效被大大阻断。表现为与亚精胺组相比,亚精胺+环孢菌素A 组上述检测指标均发生逆转。
PINK1/Parkin 驱动的线粒体自噬是最具特征的线粒体自噬经典途径[27]。在健康线粒体中,PINK1被导入线粒体内膜,在那里它暴露于线粒体蛋白酶髓磷脂蛋白0(MPP)和早老素相关菱形样蛋白(PARL)并被其切割降解。当线粒体膜电势丧失,线粒体去极化,或错误折叠的线粒体蛋白积累后,PINK1 向内膜的导入被阻止。因此PINK1 被稳定在线粒体外膜表面,然后通过其激酶活性,将p-Parkin 和线粒体外膜表面数种泛素化蛋白因子[28]。然后,p-Parkin 被募集到这些线粒体和泛素化途径中的多种表面蛋白上,这些蛋白中的一些作为自噬受体的信号,而另一些则是蛋白酶体的作用靶点,随后参与降解损伤线粒体,而这些都是线粒体自噬过程必不可少的成分[29]。该途径还包含1个放大环,其中p-Parkin 促进其被进一步的募集和磷酸化,导致更多的p-Parkin 被泛素化和依次在线粒体外膜表面的积累,建立降解信号[30-31]。本次研究中结果也明确显示,使用环孢菌素A 阻断线粒体自噬后,PINK1 和p-Parkin 的水平明显降低,说明其介导的线粒体自噬过程被显著抑制,亚精胺的功效被抵消。综上所述,亚精胺可能通过促进线粒体自噬来发挥保护急性胰腺炎小鼠胰腺组织功效的。
利益冲突所有作者均声明不存在利益冲突
