脂肪干细胞外泌体抑制TGF-β1促进糖尿病创面愈合的研究
2023-08-15宋培军梁秋周丹莲周涛徐静
宋培军 梁秋 周丹莲 周涛 徐静
【摘 要】目的 检测脂肪干细胞外泌体(ADSC-Exos)对糖尿病创面愈合、瘢痕形成的影响,并以TGF-β1信号为靶点,探讨ADSC-Exos发挥作用的分子机制。方法 分离培养脂肪干细胞,收集外泌体进行鉴定。并在糖尿病大鼠创面多点注射外泌体,通过计算创面面积、组织学染色以及Western Blot检测,评估外泌体对创面愈合、TGF-β1信号通路的影响。结果 获取的ADSC-Exos符合典型的外泌体特征;ADSC-Exos可提高创面愈合率和血管化、抑制瘢痕,并抑制TGF-β1信号通路。结论 ADSC-Exos促进了大鼠糖尿病创面愈合,在创伤后期可抑制关键纤维化信号TGF-β1,减少瘢痕形成。
【关键词】脂肪干细胞;外泌体;糖尿病创面;成纤维细胞
中图分类号:R587.1 文献标识码:A 文章编号:1004-4949(2023)13-0048-05
Study on Adipose-derived Stem Cell Exosomes Inhibiting TGF-β1 to Promote Diabetic Wound Healing
SONG Pei-jun1, LIANG Qiu1,2, ZHOU Dan-lian1,2, ZHOU Tao2, XU Jing1
(1.Department of Plastic Surgery and Burns, the First Affiliated Hospital of Bengbu Medical College, Bengbu 233000, Anhui, China; 2.Key Laboratory of Tissue Transplantation in Anhui Province, Bengbu Medical College, Bengbu 233000, Anhui, China)
【Abstract】Objective To detect the effect of adipose-derived stem cell exosomes (ADSC-Exos) on diabetic wound healing and scar formation, and to explore the molecular mechanism of ADSC-Exos with TGF-β1 signal as the target. Methods Adipose-derived stem cells were isolated and cultured, and exosomes were collected for identification. Exosomes were injected into the wounds of diabetic rats, the effects of exosomes on wound healing and TGF-β1 signaling pathway were evaluated by calculating wound area, histological staining and Western Blot detection. Results The obtained ADSC-Exos conformed to the typical characteristics of exosomes; ADSC-Exos could improve wound healing rate and vascularization, inhibit scar formation, and inhibit TGF-β1 signaling pathway. Conclusion ADSC-Exos promotes wound healing in diabetic rats, inhibits the key fibrosis signal TGF-β1 and reduces scar formation in the later stage of trauma.
【Key words】Adipose-derived stem cell; Exosomes; Diabetic wounds; Fibroblasts
基金項目:1.蚌埠医学院自然科学研究重点项目(编号:2021byzd044);2.2022年省级大学生创新创业训练计划项目(编号:12110110447)
糖尿病(diabetic wounds,DM)创面具有迁延不愈、高致残率等特点,给患者带来极大的痛苦及沉重的经济负担。持续高血糖环境易导致微血管病变、慢性炎症反应、高氧化应激反应、神经病变等病理过程,导致治疗效果并不理想[1]。脂肪干细胞(adipose-derived stem cells,ADSCs),具有较强的增殖和多向分化能力,在再生医学领域有着极高的应用价值[2]。与其他干细胞相比,ADSCs储量丰富、易获取、创伤小、适宜自体移植,成为临床上用于治疗难愈性创面、组织重建、神经修复等疾病的优先选择之一[3]。外泌体是细胞从内部释放到外部的膜状囊泡,具有磷脂双层结构,直径范围约为40~160 nm,其携带有多种蛋白质、脂质、核酸,可在细胞间传递信息,调节各种细胞功能及生物学过程[4]。与细胞相比,外泌体具有更小的分子结构,易于转运;生物相容性强,无成瘤风险,安全性高;且可体外大量制备。因此,利用脂肪干细胞的外泌体(ADSC-Exos)来修复缺损组织,富有良好的应用前景[5]。TGF-β1是组织损伤后愈合过程的关键调控因子,但慢性损伤、严重创伤或感染却会引起的TGF-β1的过度激活,导致生理性修复转向病理性修复,造成纤维化和胶原组织的过度沉积,损害器官的正常功能[6]。本研究通过体外实验和体内实验观察ADSC-Exos处理后真皮成纤维细胞增殖、迁移,以及糖尿病大鼠创面愈合情况,并以TGF-β1为靶点,探讨ADSC-Exos促糖尿病伤口愈合的机制。
1 材料与方法
1.1 实验动物及主要试剂 实验动物:8周龄雄性SD大鼠20只,体重(280±20)g,孕鼠1只,由山东省实验动物中心提供。动物实验方案经蚌埠医学院第一附属医院动物伦理委员会审核批准(伦理编号:伦动科批字〔2022〕第289号)。主要试剂:DMEM/F12培养基(BiosharP)、胎牛血清(Lonsera)、Ⅰ型胶原酶(Solarbio)、链脲佐菌素(Yeasen)、外泌体专用无血清培养基(Umibio)、抗体TGF-β1、α-SMA、COL Ⅰ、CD31、Vimentin、P53(Affinity)。
1.2 ADSCs分离培养 将SD大鼠用10%水合氯醛麻醉后颈椎脱臼法处死,分离出腹股沟下脂肪,剪成1 mm大小的颗粒,加入等体积0.2%Ⅰ型胶原酶37 ℃消化1~2 h。1000 xg,10 min,4 ℃离心去上清,重悬沉淀,再次离心,重悬后培养在T25培养瓶中,每3 d换液1次,细胞密度达到80%~90%时进行细胞传代,取第3代细胞用于实验。
1.3 ADSC-Exo分离提取及鉴定 取三代脂肪干细胞,无血清培养基培养48 h后收集细胞上清,进行梯度离心:300 xg,10 min,4 ℃,取上清;3000 xg,10 min,4 ℃,取上清;10 000 xg,30 min,4 ℃,取上清。经0.22 μm滤嘴过滤后进行超速离心,100 000 xg,70 min,4 ℃,弃上清液,PBS重悬沉淀,再次100 000 xg,70 min,4 ℃,弃上清液,用适量PBS重悬沉淀,放入-80 ℃冰箱保存。通过透射电镜观察形态和大小;Western Blot检测外泌体表面标志物;纳米颗粒跟踪分析粒径分布。
1.4 动物实验
1.4.1糖尿病大鼠造模及分组 8周龄雄性SD大鼠12只,给予高脂肪饲料喂养4周,第5周在腹膜内注射链脲佐菌素(35 mg/kg)。注射1周后监测大鼠空腹血糖水平,空腹血糖>11.1 mmol/L定义为糖尿病大鼠造模成功。将12只糖尿病大鼠随机分成两组:糖尿病对照组、糖尿病ADSC-Exos组,每组6只;另取6只健康大鼠作为健康对照组。大鼠麻醉后背部剃毛,在背部正中线两侧,距两耳连线中点6 cm处,制作两个直径10 mm大小的圆形全层皮肤缺损的创面,用外科缝线将内径12 mm大小的塑胶圆环固定在创面上3 d,减少皮肤皱缩的影响。糖尿病ADSC-Exos组分别在0、3、6、9点方向及基底注射0.2 ml ADSC-Exos(100 μg/ml),空白对照组和糖尿病对照组注射同等量PBS,凡士林纱布覆盖创面,医用纱布包扎固定。观察创面愈合情况并拍照,以Image J软件测量创面面积。
1.4.2组织学染色 第14天处死所有大鼠,每组随机选取6个创面皮肤,用4%多聚甲醛固定24 h后经乙醇梯度脱水、石蜡包埋,制作成4 μm厚石蜡切片。分别行H&E染色、Masson染色,TGF-β1、CD31免疫组化染色。
1.4.3 Western Blot实验检测相关蛋白 使用RIPA裂解液从第14天切取下的皮肤中提取总蛋白,并用BCA试剂盒测定浓度,按照相同的浓度上样、电泳、转膜,5%脱脂牛奶室温封闭2 h,与一抗(稀释比例1∶1000)在4 ℃孵育过夜,TBST洗膜,加入二抗(稀释比例1∶5000)室温摇床孵育2 h后在化学发光成像系统曝光显影。
1.5 统计学方法 采用GraphPad Prism 9.0 软件对数据进行统计学分析。计量资料以(x-±s)表示,多组间比较采用单因素方差分析(ANOVA);P<0.05表示差异有统计学意义,P<0.01表示統计学意义显著;P<0.001表示统计学意义极显著。
2 结果
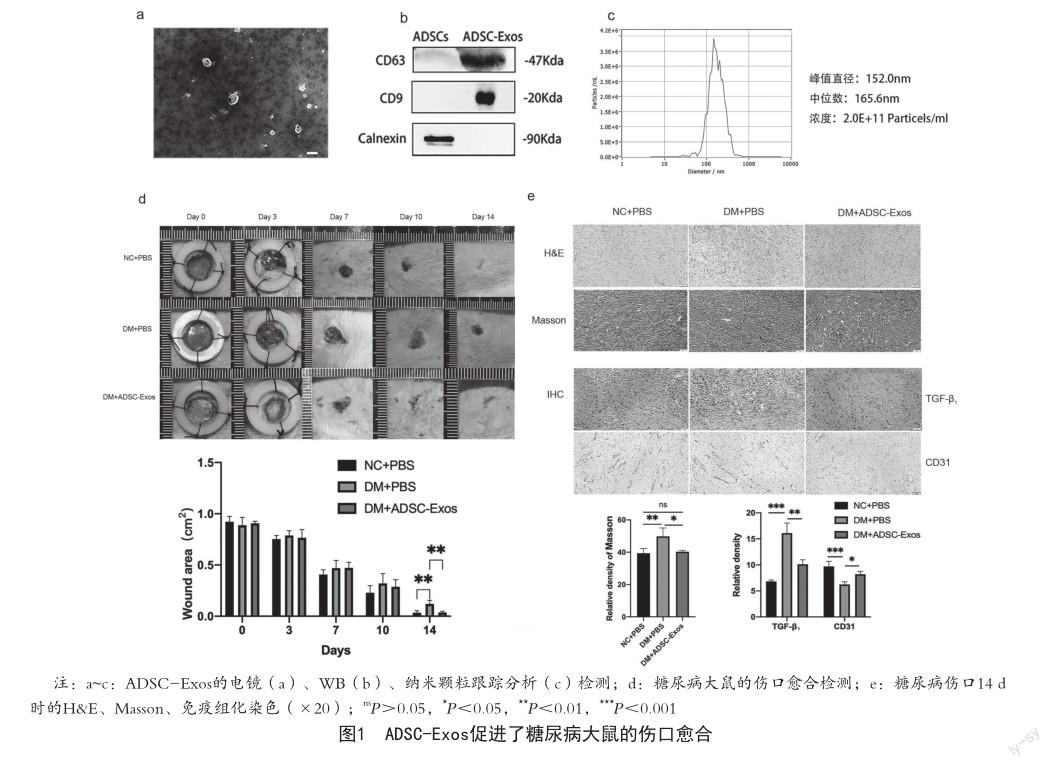
2.1 ADSC-Exos促进了大鼠糖尿病创面的愈合 取P3代ADSCs,通过梯度离心得到ADSC-Exos,在透射显微镜下可见:外泌体呈圆形或椭圆形,茶托状形态,符合外泌体典型的磷脂双层结构的特征(图1a)。Western Blot实验结果显示:本试验提取的ADSC-Exos高度表达外泌体marker蛋白CD9、CD63;且不表达内质网的marker蛋白Calnexin(图1b)。纳米颗粒跟踪分析检测结果显示:ADSC-Exos的峰值直径为152.0 nm;中位数为165.6 nm;浓度为2.0 E+11 Particels/ml(图1c),符合典型的外泌体特征,可以用于后续实验。体内试验发现:健康对照组(NC+PBS)大鼠的创面愈合率显著高于糖尿病对照组(DM+PBS)(P<0.01);ADSC-Exos治疗组创面愈合率显著高于糖尿病组(P<0.01)(图1d)。14 d时伤口处皮肤的H&E染色结果显示:与健康对照组相比,两个糖尿病组的新生血管较少,胶原组织排列紊乱,炎性细胞增多;但与糖尿病对照组(DM+PBS)相比,ADSC-Exos治疗组的新生血管增多,胶原排列较整齐,炎性细胞减少。同时,Masson染色结果显示:健康对照组的胶原纤维沉积较少,平行排列;糖尿病对照组的胶原纤维沉积增加,排列紊乱;ADSC- Exos治疗组的胶原纤维沉积较糖尿病对照组显著减少(P<0.01)(图1e)。免疫组化染色结果显示:在伤口愈合的后期(14 d)糖尿病显著诱导了纤维化标志基因TGF-β1的表达(P<0.001),同时极显著减少了血管内皮细胞标志分子CD31的表达(P<0.001);而经ADSC-Exos治疗,可以极显著“挽救”糖尿病诱导的纤维化基因上调(P<0.001);与糖尿病对照组相比,ADSC-Exos治疗组中内皮细胞标志分子CD31上调(P<0.05)(图1e)。
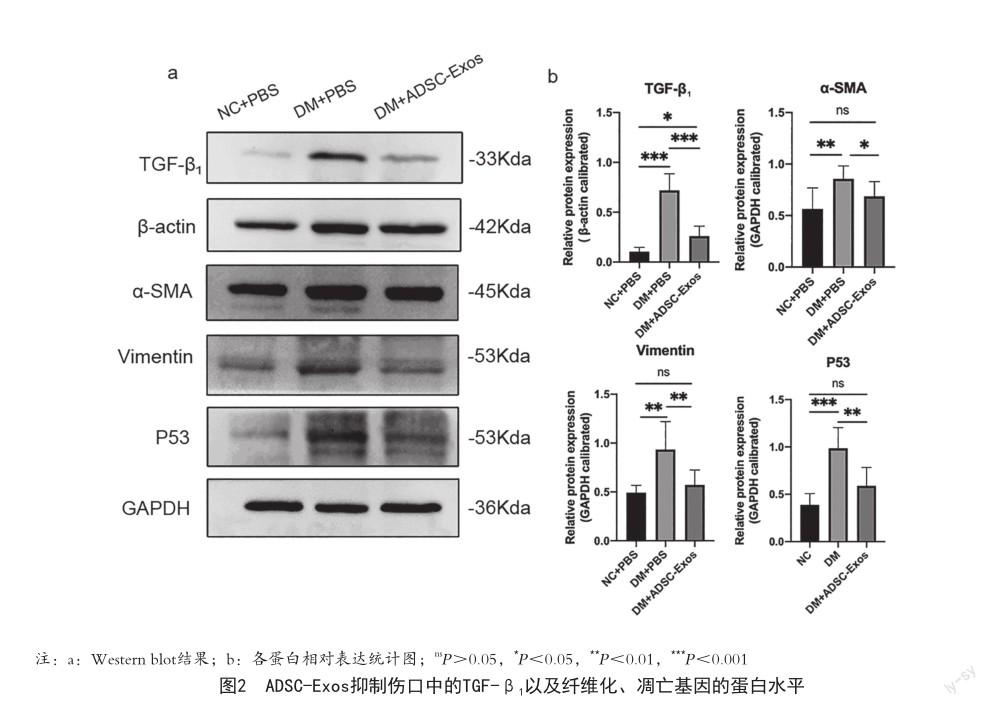
2.2 ADSC-Exos抑制了创伤后期皮肤中的TGF-β1信号通路 在创面修复后期,高水平的TGF-β1是引起纤维化导致瘢痕的关键。为探究ADSC-Exos促进创伤愈合,减少瘢痕的分子机制,本研究通过WB检测14 d创口处皮肤的TGF-β1信号通路中关键蛋白表达,结果显示:糖尿病创口后期皮肤中TGF-β1及其下游α-SMA高表达,并且纤维化标志基因Vimentin、以及凋亡相关蛋白P53表达上调;而ADSC-Exos治疗能抑制后期创口中的TGF-β1通路、成纤维标志基因和凋亡相关基因的表达(图2)。

3 讨论
糖尿病创面是临床常见的疾病,其中糖尿病足部溃疡最有代表性,据统计,糖尿病患者一生中发生足部溃疡的风险高达34%,其中约20%的足溃疡患者需要截肢[7]。伤口愈合是一个动态复杂的过程,分为时间重叠的止血期、炎症期、增殖期、重构期,在这4个时期出现问题均会影响伤口愈合。据报道[8],糖尿病创面的促炎细胞因子增加,血管内皮细胞减少,上皮细胞增殖和迁移能力受损,细胞外基质(ECM)重构紊乱。因此本研究假设,从抗炎、促血管化、增强上皮细胞功能、调整ECM重构等几个方面对创面采取干预措施,促进糖尿病创面的愈合。有研究报道[9],ADSC-Exos能改善胰岛素敏感性,推动M2巨噬细胞极化,减少炎症,减弱瘢痕成纤维细胞的增殖能力,减少纤维化[10],还可以促进脂肪移植物的血管生成[11]。

本研究从大鼠脂肪组织中分离出脂肪干细胞,在体外扩增后用超速离心法分离出外泌体,并通过透射电镜、纳米颗粒追踪、蛋白印记实验鉴定,证明该方法可以获取较纯的外泌体。通过创面的拍照观察、HE染色、Masson染色、免疫组化染色发现,ADSC-Exos可以促进糖尿病创面愈合,减少炎症浸润,促进新生血管形成。这些结果表明ADSC-Exos可以通过抗炎、增强成纤维细胞增殖和迁移能力、促血管化促进糖尿病创面愈合。既往研究表明[12],TGF-β1的异常高表达可以导致各种纤维化,包括肝脏、心脏、肺部纤维化和病理性瘢痕。病理性瘢痕形成的过程涉及胶原蛋白过度沉积,细胞外基质重塑过程失调,有胶原纤维排列紊乱、肌成纤维细胞增多,血管生成减少等特点。有研究表明[13-15],TGF-β1刺激的成纤维细胞,α-SMA、Ⅰ型胶原蛋白的表达水平以剂量依赖方式上调,本研究假设,调控TGF-β1信号通路,可以抑制胶原蛋白过度表达,减少瘢痕形成。为了进一步探讨ADSC-Exos影响创面纤维化的机制,本研究过蛋白印记实验检测了纤维化相关蛋白,结果显示,ADSC-Exos可以下调糖尿病创面组织的TGF-β1表达量,减少肌成纤维细胞标志物α-SMA、Vimentin的表达和减少胶原蛋白过度沉积,这说明ADSC-Exos在创伤后期可以抑制纤维化TGF-β1信号通路,从而减少瘢痕的形成。但ADSC-Exos调控TGF-β1的具体分子机制还需要进一步的研究。
综上所述,ADSC-Exos可以促进糖尿病创面愈合,加速血管新生,减少瘢痕,该功能可能是通过TGF-β1信号发挥作用,从而可为糖尿病创面的治疗提供证据。
参考文献
[1] Cho NH,Shaw JE,Karuranga S,et al.IDF Diabetes Atlas:Global estimates of diabetes prevalence for 2017 and projections for 2045[J].Diabetes Res Clin Pract,2018,138:271-281.
[2] Challapalli RS,Dwyer RM,McInerney N,et al.Effect of Breast Cancer and Adjuvant Therapy on AdiposeDerived Stromal Cells:Implications for the Role of ADSCs in Regenerative Strategies for Breast Reconstruction[J].Stem Cell Rev Rep,2021,17(2):523-538.
[3] 姜文彬,陳雳风,孙家明.脂肪干细胞来源外泌体在皮肤创面修复中的作用机制[J].组织工程与重建外科,2021,17(4):352-357.
[4] Kalluri R,LeBleu VS.The biology,function,and biomedical applica-tions of exosomes[J].Science,2020,367(6478):e6977.
[5] 陈凤娇,吕佳荟,左朝艳,等.外泌体在伤口愈合中的作用[J].中国细胞生物学学报,2022,44(6):1174-1183.
[6] Lodyga M,Hinz B.TGF-β1 - A truly transforming growth factor in fibrosis and immunity[J].Semin Cell Dev Biol,2020,101:123-139.
[7] McDermott K,Fang M,Boulton AJM,et al.Etiology,Epidemiology,and Disparities in the Burden of Diabetic Foot Ulcers[J].Diabetes Care,2023,46(1):209-221.
[8] 朱信霖,廖万清,张超,等.糖尿病足溃疡发病机制及治疗[J].中国皮肤性病学杂志,2023,37(4):367-372.
[9] Zhao H,Shang Q,Pan Z,et al.Exosomes From Adipose-Derived Stem Cells Attenuate Adipose Inflammation and Obesity Through Polarizing M2 Macrophages and Beiging in White Adipose Tissue[J].Diabetes,2018,67(2):235-247.
[10] 林正杰,江诗海,梁堂钊,等.脂肪干细胞源性外泌体对瘢痕成纤维细胞生物学活性的影响[J].新医学,2022,53(9):655-659.
[11] 陈珂欣,熊佳超,李小龙,等.脂肪干细胞外泌体通过VEGF/AKT通路促进脂肪移植物的血管生成[J].中国美容整形外科杂志,2021,32(12):718-722.
[12] Budi EH,Schaub JR,Decaris M,et al.TGF-β as a driver of fibrosis:Physiological roles and therapeutic opportunities[J]. J Pathol,2021,254(4):358-373.
[13] Wang Y,Lu M,Xiong L,et al.DrP1-mediated mitochondrial fission promotes renal fibroblast activation and fibrogenesis[J].Cell Death Dis,2020,11(1):29.
[14] AndugulaPati SB,Gourishetti K,Tirunavalli SK,et al.Biochanin-A ameliorates Pulmonary fibrosis by suppressing the TGF-β mediated EMT,myofibroblasts differentiation and collagen deposition in in vitro and in vivo systems[J].Phytomedicine Int J Phytother Phytopharm,2020,78:153298.
[15] Liu J,Li F,Liu B,et al.Adipose-derived mesenchymal stem cell exosomes inhibit transforming growth factor-β1-induced collagen synthesis in oral mucosal fibroblasts[J]. Exp Ther Med,2021,22(6):1419.
編辑 扶田
