线粒体移植改善缺血再灌注损伤的作用及机制*
2023-08-14牛其芳阮寒尽毛明惠韩正学
朱 琳 牛其芳 阮寒尽 毛明惠 韩正学
(首都医科大学附属北京口腔医院口腔颌面-头颈肿瘤科,北京 100050)
缺血再灌注损伤(ischemia-reperfusion injury,I/RI)指血流中断随之恢复血供后,组织器官出现的不同程度的功能障碍。主要的损伤机制为:当细胞缺血和血流再灌注时,大量活性氧(reactive oxygen species,ROS)生成,线粒体内膜上的电子传递链受损,导致ATP 依赖的离子交换通道功能障碍。 同时线粒体膜通透性转换孔(mitochondrial permeability transition pore,mPTP)开放,钙积累后水大量进入线粒体,造成线粒体肿胀等病理过程[1-3],最终启动细胞死亡程序,包括自噬、细胞凋亡和坏死[4]。另外,线粒体损伤相关分子模式(damage-associated molecular pattern,DAMPs),如线粒体DNA(mtDNA)损伤并释放到膜外,会招募炎症细胞从而激活自身免疫反应[5-6]。因此,在缺血和再灌注过程中,线粒体功能障碍都是导致细胞损伤的主要原因之一(图1)。
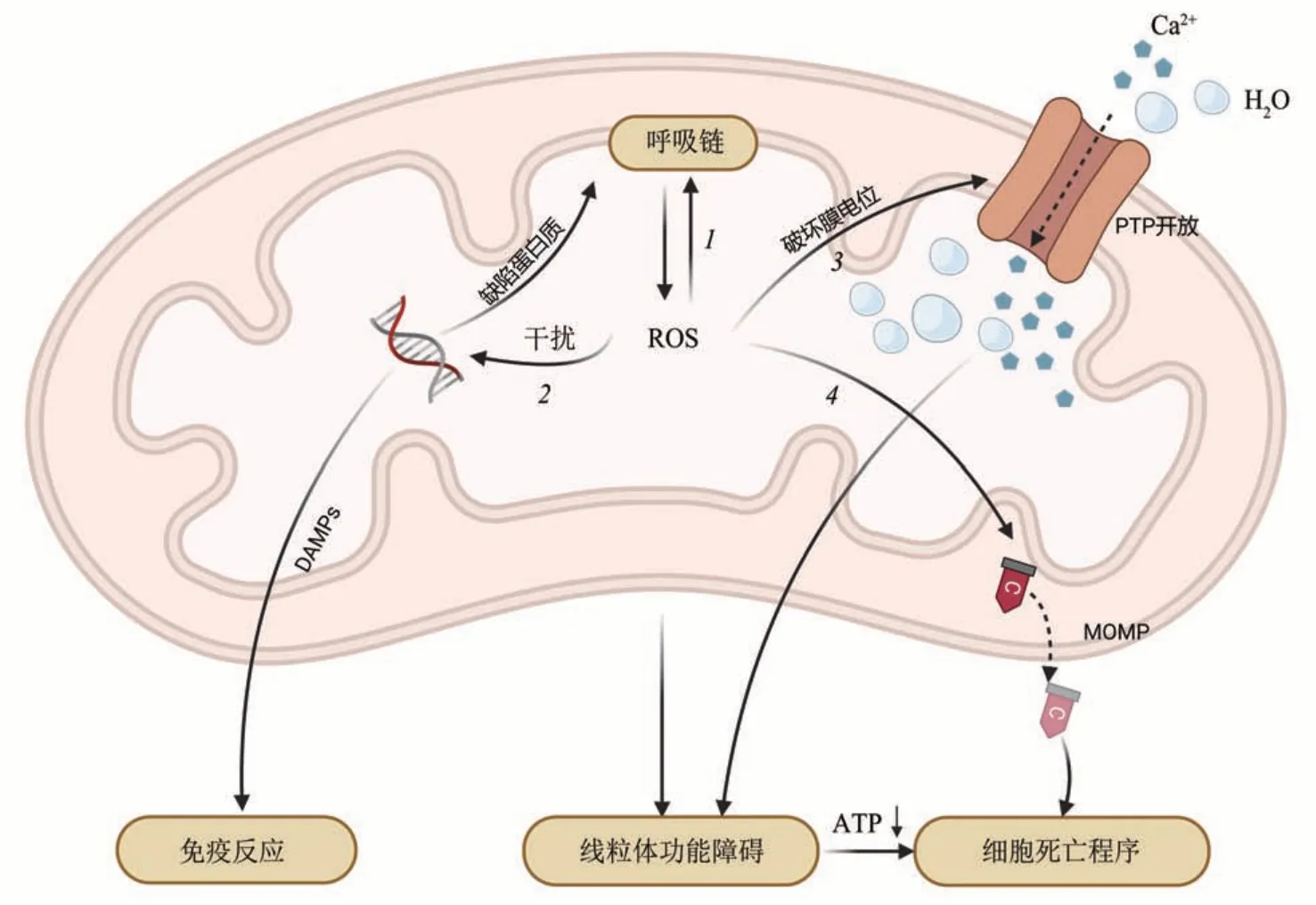
Fig. 1 Mechanism of mitochondrial injury during ischemia-reperfusion图1 缺血再灌注时线粒体损伤机制
线粒体移植(mitochondrial transplantation,MT),即将具有呼吸功能的健康线粒体移植至受损组织内,帮助细胞恢复功能,是一种新型干预手段。以往,药物靶向治疗,如添加抗氧化剂、清除钙离子等能减轻线粒体功能障碍,但由于时间窗较短,需在氧化损伤和能量耗竭达最大程度前施加干预,临床效果有限[7-8]。近来,多项研究证实了MT 在治疗I/RI 中的作用,这被认为是一种具有应用前景的治疗方法[9]。本文总结了MT的基本程序和在多种器官I/RI治疗中的有益作用,希望对I/RI疾病的治疗产生新的启发。
1 线粒体移植技术
线粒体转移早在1980 年就被提出,有学者将分离出的具有氯霉素耐药性的线粒体与缺乏耐药性的细胞共孵育,发现线粒体成功融入细胞,且产生耐药性[10]。还有临床试验将健康供体的mtDNA转移到受损的卵母细胞中,受精卵由于含有父母亲的核DNA及供体的mtDNA,成功避免了后代线粒体遗传疾病的发生[8,11]。随后,Rustom 等[12-13]发现了一种叫隧道纳米管(tunneling nanotubes,TNTs)的细胞沟通方式,表明细胞器可通过TNTs 在细胞间传递,Hayakawa等[14]发现线粒体可以从星形胶质细胞释放并转移到损伤的神经元细胞中,从而改善受损的神经功能。以上等多项研究表明,线粒体可通过外源形式或细胞间传递进入细胞内发挥作用。在此背景下,线粒体移植技术应运而生,近年来有许多学者进行了一系列相关研究(图2)。
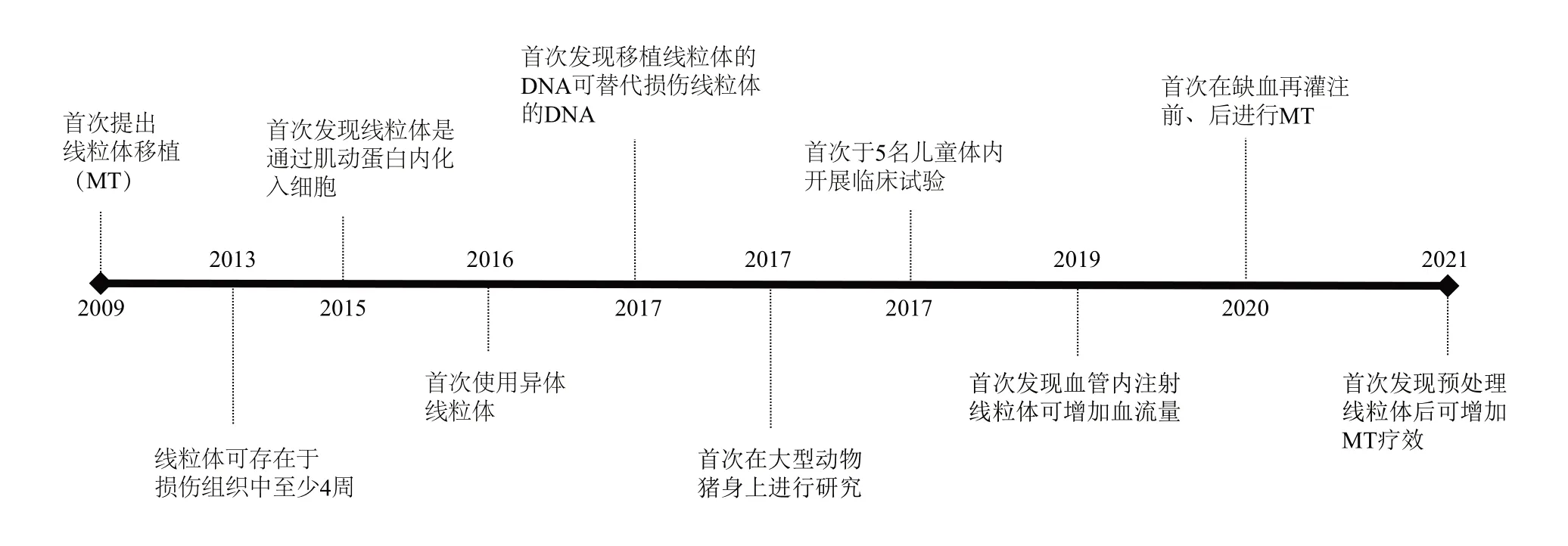
Fig. 2 The development points of MT图2 线粒体移植研究重要节点
1.1 线粒体的来源
移植所需的线粒体分为自体和异体来源。自体线粒体一般分离自机体的非缺血组织,在符合伦理和微创的原则下,多取自手术时所必须分离的组织,如开胸手术中所剥离的胸大肌[15-17]。有研究表明,同样湿重的不同组织能分离出的线粒体数量不同(肝脏>骨骼肌>心脏)[15],不同组织来源的线粒体或亚群也能提供相似的器官保护作用[18]。异体线粒体可来源于多种组织,如人心脏成纤维细胞、人脐带间充质干细胞等[19-21],最新的一项研究发现,人诱导多能干细胞衍生心肌细胞分泌的细胞外囊泡可携带线粒体[22]。此外,Nakamura 等[23]从冷冻胎盘组织中提取线粒体,所含的抗氧化蛋白较骨骼肌来源的线粒体似乎更多,这为以无创方式分离线粒体提供了更多可能。
1.2 线粒体分离和质量控制
线粒体分离方法有差速离心法、过滤法和试剂盒法。Hogeboom 等[24]在1948 年提出差速离心法分离线粒体,有学者以此分离出了完整的活性线粒体, 整个过程在1~2 h 内完成[25]。 随后,Masuzawa 等[15,18]将分离出的活性线粒体移植到缺血心肌中,改善了心功能。由于缺血器官功能的恢复与血液的尽早灌注密切相关,因此,这种分离线粒体的方法在时间上具有一定的局限性[26-27]。为了使MT 能在临床急症治疗中使用,McCully 团队[28]开发了一种基于差异过滤的线粒体提取方法(图3)。该方法将提取时间缩短至30 min内,从而线粒体不会因长时间的体外暴露而降低活性,并且仅需0.18 g 的新鲜组织即可获得约2×1010个高纯度的、完整的活性线粒体。而且通过在10~40 μm的装置中过滤,还避免了多次离心可能导致的线粒体结构破坏。另外,在最新的几项研究中使用了成品试剂盒分离线粒体[29-30]。线粒体的质量对于保证MT的效果十分重要,无活性线粒体、线粒体蛋白质和mtDNA等不会对I/RI起到保护作用[18],其他成分及碎片也可能导致假性免疫反应,所以应保证线粒体纯度尽量高,以及提取过程应全程无菌,并对提取的线粒体活性、功能、纯度等进行检测[31-32]。
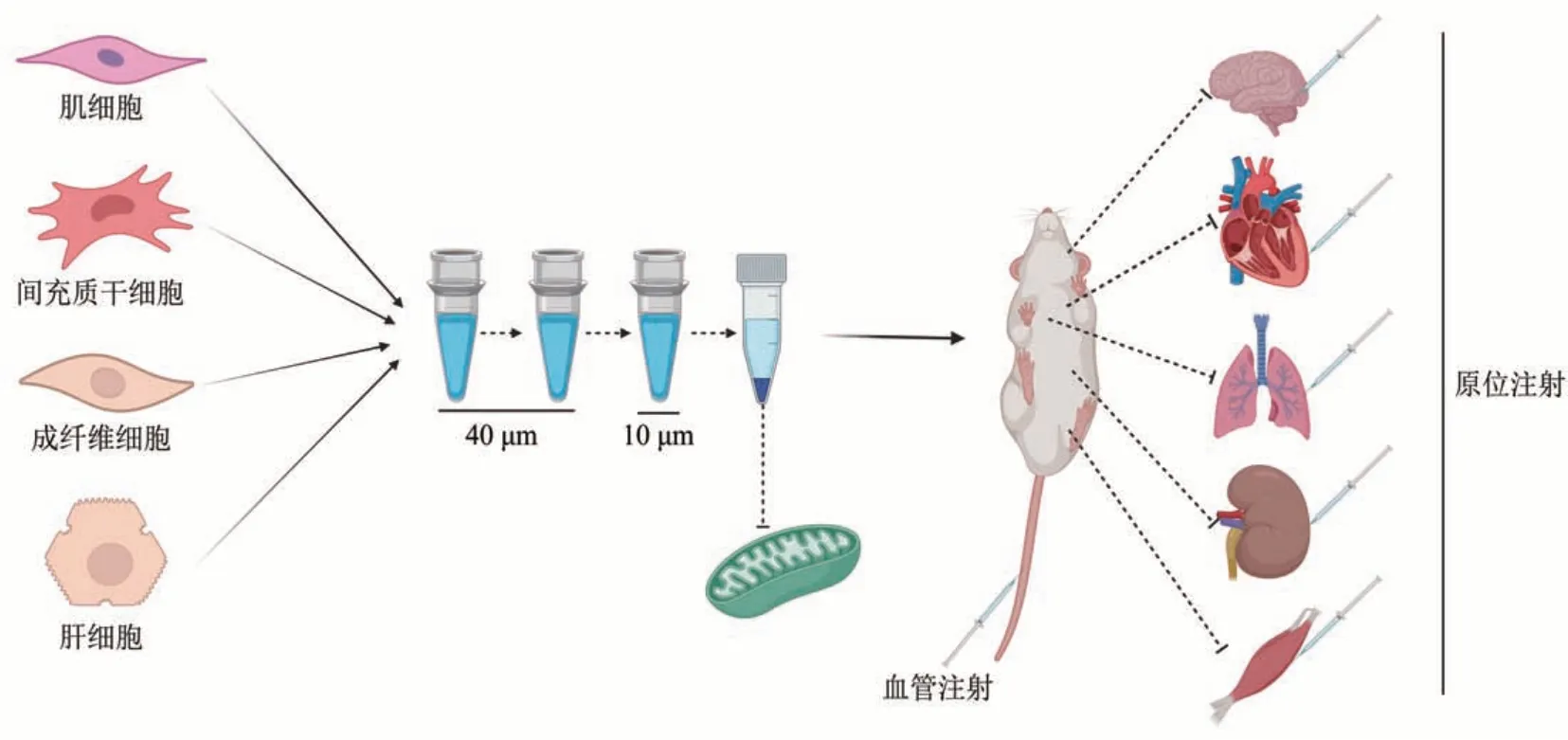
Fig. 3 Simplified diagram of MT procedure图3 线粒体移植程序简化图
1.3 线粒体移植的方法
MT的方法主要包括原位注射和血管注射。在动物I/RI 模型中,既可将线粒体原位注射到心肌、侧脑室等缺血损伤部位[15,18,21,33],也可以通过冠状动脉、肾动脉及股动静脉注射将线粒体移植至心、肾、脑[16-17,19-20,23,34-37]。有研究对比后发现,两种方法的效果无明显差异[19]。其中,血管注射线粒体更微创,可避免直接注射对组织的损伤,能使线粒体在缺血区均匀、广泛分布[19]。并且Shin等[17]发现,经冠脉注射线粒体能明显增加冠状动脉血流量,效果甚至好于某些冠状动脉血管扩张药,机制可能是通过内向钾离子通道参与的ATP介导的血管舒张,这是经原位注射未观察到的现象。然而,血管注射的线粒体在到达目的区域前,可能分布于其他非目标组织器官[23],甚至呈广泛性分布[38]。另外,在线粒体提取过程中,溶液中的溶质凝集或杂质颗粒的大小一旦超过冠状动脉微血管直径(5~10 μm),栓塞风险将急剧上升[39]。因此,血管内注射线粒体存在微血管栓塞风险。在不确定MT是否会对正常器官造成损害或引起机体免疫反应前,线粒体的精准分布尤为重要。已有研究表明线粒体可通过微量注射、磁有丝分裂和光学镊子等方法转移,可能提高线粒体的摄取率及分布精准性,并调节线粒体的数量与质量,从而避免这类不确定风险[40-41]。相反,原位注射线粒体只定位在给药部位附近,相对血管注射将更加安全[19](图3)。
1.4 线粒体移植的时间窗
线粒体的移植时机分为缺血前、再灌注即刻和再灌注后。大部分研究的移植时机为再灌注开始即刻,作用机制可能是供给损伤细胞能量、清除炎症因子和激活线粒体蛋白信号通路等[15,17-19,36-37]。有研究发现急性心肌梗死时,梗死面积可以通过再灌注开始时的干预而减小[42],这与再灌注开始时行MT改善心功能的结果类似[39]。Guariento等[16]研究表明,缺血前行MT 可以提供预防性心肌保护。因此,在器官移植、长时间外科手术等情况下,缺血前注射线粒体可能会更好地减轻组织I/RI。此外,Blitzer 等[35]发现再灌注20 min 后行MT 也能得到相似的结果,并在猪心脏I/RI模型上得到成功验证,这可能有助于降低心脏手术的并发症发生率。I/RI的病理生理机制是复杂的,在初始阶段(<2 h)以氧化应激、细胞因子激活和线粒体通透性转换(mitochondrial permeability transition,MPT)为特征[43-44]。而晚期阶段(>6 h)涉及中性粒细胞激活、黏附分子上调和微循环损伤等[45]。同时,Huang等[20]发现移植线粒体的内化率低于6%。以上可能是MT缺乏长期效应的原因。因此,目前的研究焦点主要是器官急性I/RI,MT 是否对器官慢性I/RI产生积极作用值得进一步研究。
1.5 线粒体移植的安全性
MT是否会引起机体免疫反应至关重要。部分研究认为MT不会引起免疫反应,因为自体和异体MT后未发现与炎症或免疫反应相关的细胞因子上调,如IL-1、IL-4、IL-6、MIP-1α 和MIP-2β 等,并且在移植了1×1010的高浓度线粒体后,也未检测到线粒体抗原的升高[15,46]。另外,Ramirez-Barbieri等[47]进一步研究发现,单次或连续注射同种异体线粒体后,没有直接或间接、急性或慢性的免疫反应。但也有研究认为,非自体细胞治疗会触发机体的免疫应答[48],移植的外源性线粒体可能通过DAMPs或其他信使分子引起免疫反应[49]。然而,有学者提出一个有趣的假设,即MT后线粒体作为DAMPs,形成保护性的免疫应答,释放大量细胞因子,刺激局部再生反应,产生I/RI的器官保护作用,但这需要进一步的实验验证[50]。并且,McCully 等[51]对5 名儿童进行了MT,也未报道相关并发症。综上,目前的观点认为自体或异体MT不会引起免疫反应,但是后期需要大样本研究,以确定MT应用于临床前的生物安全性。
2 线粒体移植改善器官缺血再灌注损伤
2.1 心脏缺血再灌注损伤
心肌细胞的正常收缩功能需在有氧条件下由线粒体产生能量来维持。由于各种原因导致的冠状动脉血流减少或停止会引起急性心肌缺血,缺血后60 min 便可出现细胞不可逆死亡[52],而血液再灌注则会继续加重损伤。心脏的能量供应缺乏,心肌细胞功能障碍,收缩能力降低,轻者表现为心功能不全,重者则出现心力衰竭等严重后果。
溶栓或经皮冠状动脉介入治疗是目前治疗急性心梗最有效的方案[42],但是都未能解决能量供应不足的问题。此外,可通过药物治疗减轻心脏能量需求[22]。近年来也有许多靶向线粒体药物治疗I/RI 后导致的心力衰竭,但是疗效并不理想[53]。由于MT能够直接补充健康线粒体,在心脏I/RI中有着极大的治疗潜力,众多研究表明MT能显著缩小心梗面积,降低心肌肌酸激酶、肌钙蛋白,提高心脏射血分数和收缩功能,从而提供心肌保护作用。
2009 年McCully 等[18]首次在兔体内证明MT能减轻心脏I/RI,并发现移植的线粒体存在于细胞间隙中。但有学者在随后的研究中却提出不同的结论,即线粒体是在移植后2~8 h 通过内吞作用进入心肌细胞,并能够维持至少4 周[15,18]。随后,Pacak 等[54]通过使用特异性通路阻滞剂证明,线粒体是通过肌动蛋白依赖的内吞作用进入心肌细胞,而隧道纳米管、网格蛋白依赖的胞吞作用和大胞饮作用不参与线粒体内吞过程。进入细胞的线粒体在内溶酶体系统依次传递的过程中逃逸,并有效地与心肌细胞线粒体融合[55](图4)。
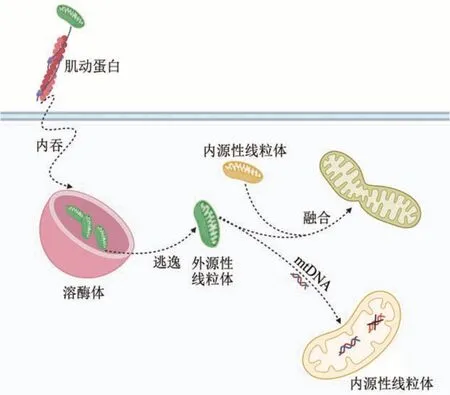
Fig. 4 Diagram of exogenous mitochondria entering myocardial cell图4 外源性线粒体进入心肌细胞示意图
有学者就MT后线粒体的作用位点发表了不同意见。首先,细胞外的高Ca2+环境会使mPTP不可逆开放[56],线粒体在未进入细胞前就已经严重损伤[50]。但有研究表明线粒体可在1.8 mmol/L 的高Ca2+溶液中保持功能完整性[57],最新的一项研究也发现每毫升血液中含有20~370 万个具有呼吸功能的线粒体[58]。其次,假设线粒体能够存活,还必须穿透血管内膜和细胞膜进入细胞,并且保持完整性和活性。就此,McCully 团队[59]研究表示,线粒体是通过肌动蛋白依赖的内吞作用进入细胞,并移植标记了铁复合物的线粒体,4周后在心脏中仍能发现这类复合物,但是有学者认为此数据并不足以表明移植线粒体的完整性。至此,移植的线粒体如何发挥心脏保护作用的机制仍较为模糊。
MT虽然在大小鼠模型中已被证明能改善心脏I/RI,但啮齿类动物在生理、免疫和代谢方面与人类的相似度较低。有学者在大型动物猪体内进行了研究,发现MT 也能改善猪心脏I/RI,这为MT 能在人体应用提供更具相关性和有效性的数据[46]。2017 年,McCully 团队[51]首次进行了人体试验,对5名因心脏手术后的I/RI相关心肌功能障碍而需要持续体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)支持的严重先天性心脏病儿童进行了自体MT,结果发现其中4 名儿童心室功能改善并在平均第4 天时脱离了ECMO 支持,且5名患者均未出现与MT相关的短期不良并发症,这也为MT 临床转化提供了一项珍贵的经验。综上,各型动物实验及人体试验的证据均支持了MT对心肌I/RI的可行性。
2.2 肾缺血再灌注损伤
肾脏长期处于高压、高容量和高营养负荷状态,其中占肾皮质90%的近曲小管上皮细胞完全依赖氧化磷酸化产生ATP,为重吸收提供动力[60-62],所以其在耗氧量和线粒体数量方面仅次于心脏。肾脏血液供应不足时会引起急性肾损伤(acute kidney injury,AKI),有研究表示住院病人中AKI的患病率可高达21.6%,其也是慢性肾病和终末期肾病的独立危险因素[63-65]。肾小管上皮细胞损坏是AKI的主要原因,I/RI时线粒体功能障碍最终导致了肾小管细胞死亡,因此是AKI 发病的重要因素[66-67]。现有的AKI 治疗方案一般为迅速补液及肾脏替代疗法等,但如何减少肾小管上皮细胞的损伤及再生肾小管上皮对恢复肾功能至关重要。
AKI的治疗需要清除受损线粒体或通过生物发生补充线粒体[68]。Doulamis 等[36-37]研究发现,MT能显著增加AKI猪的肾小球滤过率和尿量,降低血清肌酐和尿素氮,对AKI有明显的改善作用。线粒体被摄取进入肾脏的机制被认为与心肌细胞摄取外源性线粒体相同。另外,Bruno 等[69]发现间充质干细胞(mesenchymal stem cells,MSCs)能通过旁分泌作用在AKI时发挥抗凋亡和再生潜能,所以MSCs还可能通过微囊泡将线粒体传递给受损细胞发挥作用。MT 可以在肾移植等治疗时应用,但肾细胞如何抵抗I/RI引起的不利微环境的作用机制尚待进一步研究。
2.3 脑缺血再灌注损伤
脑是机体对缺氧最为敏感的器官,当脑血管病变、全身循环障碍或外伤等导致脑供血不足时,机体会在极短时间内出现临床症状,称为急性缺血性卒中。在中枢神经系统中,神经元的正常功能高度依赖于线粒体的完整性和活性[70],当脑缺氧时,神经元细胞的线粒体功能障碍,诱导星形胶质细胞增生及胶质纤维酸性蛋白的过度分泌,导致瘢痕的形成,这被认为是阻碍神经损伤后再生的关键因素[71-72]。研究发现星形胶质细胞可以释放线粒体并转移到受损神经元中促进神经保护和修复[73-74]。因此有学者推测通过补充外源性线粒体能恢复受损神经元细胞的功能,并进行了相关研究。
脑卒中患者最突出的症状是运动功能受损。有研究证明,MT除了显著降低脑细胞凋亡和减少肥大的星形胶质细胞外,还恢复了大鼠的旋肌功能和握力,神经系统功能也根据移植线粒体的浓度呈依赖性恢复[20,33]。MT保护神经系统的机制可能是作为ATP 源或ROS 清除剂,保护细胞免受自由基损伤,并且线粒体可能通过细胞因子诱导的TNTs 传递给受损细胞,使用纳米通道阻滞剂可消除治疗效果[21,75]。总而言之,移植的线粒体进入梗死周围区神经元单位中,增加ATP含量,显著减轻神经元细胞的氧化应激和凋亡,减少星形胶质细胞增生和小胶质细胞活化,促进缺血后的神经发生,改善了神经功能。此外,创伤也是造成脑I/RI 的原因之一。有学者在鼠脑创伤模型中发现MT能通过抑制紧密连接蛋白破坏来减轻血脑屏障损伤和脑水肿,并证明MT能增加血管内皮细胞再生[76-77]。以上关于MT在脑I/RI动物模型中所显露出的良好治疗效果,为提高脑I/RI患者的预后提供了新的可能。
2.4 其他
MT 在肝、肺和骨骼肌的I/RI 治疗作用也有报道。在肝移植和肝切除手术时,急性肝缺血损伤的发生概率很高,线粒体也会因此受到损伤。有学者将从健康大鼠肝脏分离的线粒体经脾输送到肝I/RI大鼠中,发现血清丙氨酸氨基转移酶减少以及肝细胞坏死减轻,还检测到移植到肝脏的线粒体在4 h后仍保持完整的膜电位[78]。此外,有学者将褪黑素处理的线粒体注射到急性肝损伤鼠的体内,减轻了细胞氧化应激、炎症、凋亡等[79]。这是因为褪黑素作为自由基的清除者,通过寡肽转运体进入线粒体,在线粒体钙胁迫期间,对MPT 具有稳定作用[80-81]。先前也有学者发现经维持线粒体稳态的乙醛脱氢酶2(ALD2)激活剂处理后的线粒体行MT,较未处理的效果更佳[30]。因此,线粒体可通过特殊处理后再移植到受损细胞内,提高MT 的疗效。
肺的急性缺血导致的呼吸窘迫综合征是一种非常凶险的情况,儿童患者的死亡率甚至高达75%[82]。Moskowitzova 等[83]发现MT 可以增加I/RI肺的顺应性和气容量,并且能明显减少肺间质水肿和细胞凋亡。这也提示在肺移植、心肺复苏和肺栓塞等多种临床情况下,MT可降低发病率和死亡率。
急性肢体缺血(acute limb ischemia,ALI)表现为骨骼肌活力和肢体功能的丧失,目前的治疗办法为增加侧支血管生成,但失去活力的肌肉床无法维持新生血管生成,有一定局限性[84]。骨骼肌I/RI会导致线粒体抗氧化系统受损,而适度的氧化应激又是线粒体生物发生所必要的,这些共同结果导致骨骼肌蛋白质和脂质代谢受损,形成恶性循环[85],因此解决线粒体功能障碍是ALI 治疗的关键环节。Orfany 等[86]将异体线粒体注射到ALI 小鼠的后肢,发现后肢运动功能明显改善,初步证明了MT在改善骨骼肌活力和功能方面的有效性。
3 总结、问题和展望
缺血再灌注损伤可导致严重的组织器官功能障碍,其中线粒体功能障碍已经被证实是缺血再灌注损伤的关键因素。因此出现了一种全新的干预方法——线粒体移植,旨在通过替换损伤线粒体和增加健康线粒体,挽救细胞状态。目前已在动物的心、脑、肾等器官缺血再灌注损伤模型中发现线粒体移植可以改善细胞氧化应激、钙超载以及炎症反应,减少细胞凋亡和坏死,从而改善器官的功能,并通过少量人体临床试验初步验证了MT的安全性和有效性。
但是线粒体移植技术处于初始发展阶段,仍有局限性和缺点,需要进一步探讨:a. 线粒体移植的规范化程序(如移植剂量、移植方式、时间窗等);b. 如何保证提取线粒体的活性和纯度;c. 线粒体预处理技术;d. 线粒体摄取率与分布精准性;e. 线粒体移植后是否会产生免疫反应;f. 线粒体摄取与器官保护作用的确切机制。随着线粒体提取技术的发展,目前线粒体的分离和移植已可以快速地完成,但对于人体行线粒体移植的安全性仍存在疑问。若能解决以上的问题,线粒体移植技术有望在器官缺血再灌注损伤的预防和治疗上发挥其独特的优势并得到广泛应用。
