灰毡毛忍冬与忍冬HQT2基因的克隆及表达分析
2023-08-14刘湘丹,陈勋,龙雨青,王志辉,刘笑蓉,王朝晖,童巧珍,周日宝
刘湘丹,陈勋,龙雨青,王志辉,刘笑蓉,王朝晖,童巧珍,周日宝








〔摘要〕 目的 分别克隆灰毡毛忍冬与忍冬HQT2基因全長序列,并进行生物信息学和表达量分析,以揭示HQT2在灰毡毛忍冬与忍冬绿原酸生物合成中的可能功能。方法 多糖多酚试剂盒法分别提取灰毡毛忍冬与忍冬花总RNA,通过RT-PCR和RACE技术克隆HQT2基因的全长cDNA序列,运用相关软件对该基因序列进行生物信息学分析;利用实时荧光定量PCR技术(qRT-PCR)分别测定灰毡毛忍冬与忍冬茎、叶及不同花期花中相关基因的相对表达量;采用HPLC 测定绿原酸含量并结合表达量做相关性分析。结果 克隆得到LmHQT2(MH196564)和LjHQT2(MK294639),其开放阅读框长度均为1 296 bp,编码431个氨基酸,生物信息学分析预测为亲水性蛋白,可能定位于细胞质中,属于氯霉素乙酰转移酶样结构域超家族;qRT-PCR结果显示,HQT2基因具有组织特异性,在灰毡毛忍冬与忍冬茎、叶及不同花期花器官中表达存在差异;绿原酸含量与基因相对表达量之间呈现一定的相关性。结论 本研究成功克隆了灰毡毛忍冬与忍冬HQT2基因并探索其在不同器官中的表达模式,推测HQT2基因在灰毡毛忍冬与忍冬的绿原酸生物合成途径中发挥不同功能,为进一步研究该基因的功能及探究灰毡毛忍冬和忍冬绿原酸生物合成调节机制提供了研究基础。
〔关键词〕 灰毡毛忍冬;忍冬;HQT2;基因克隆;生物信息学分析;表达分析
〔中图分类号〕R282.2 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.07.010
Cloning and expressions of HQT2 genes in Lonicera macranthoides
Hand.-Mazz. and Lonicera japonica Thunb.
LIU Xiangdan1,2,3, CHEN Xun4, LONG Yuqing1, WANG Zhihui1,2, LIU Xiaorong1,2,
WANG Zhaohui1,2, TONG Qiaozhen1,2,3, ZHOU Ribao1,2,3*
1. School of Pharmacy, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Key Laboratory for the Germplasm Resources and Standardized Planting of Hunan's Bulk Authentic Medicinal Materials, Changsha, Hunan 410208, China; 3. Hunan Provincial Key Laboratory of Chinese Medicinal Modernization, Changsha, Hunan 410208, China;
4. Nanhua Hospital of University of South China, Hengyang, Hunan 421002, China
〔Abstract〕 Objective To reveal the possible functions of HQT2 gene in the chlorogenic acid biosynthesis of Lonicera macranthoides Hand.-Mazz. (L. macranthoides) and Lonicera japonica Thunb. (L. japonica) by cloning the full-length sequences of HQT2 genes from L. macranthoides and L. japonica respectively for bioinformatics and expression analysis. Methods The total RNAs of L. macranthoides and L. japonica were extracted respectively using Biospin Polysaccharide Polyphenol Plant Total RNA Extraction Kit. The full-length cDNA sequences of HQT2 genes were cloned by RT-PCR and RACE, and bioinformatics analysis was performed on them with relevant softwares. Real-time fluorescence quantitative PRC(qRT-PCR) was used to determine the relative expression levels of the genes in the stems and leaves, as well as the flowers at different flowering stages of L. macranthoides and L. japonica respectively. The content of chlorogenic acid was determined by HPLC and the correlation between it and the relative expression level of HQT2 gene was analyzed. Results The full-length cDNA sequences of LmHQT2 gene (MH196564) and LjHQT2 gene (MK294639) were cloned successfully, each of which contained a 1296 bp open reading frame (ORF) and encoded 431 amino acids. Bioinformatics predictive analysis indicated that the proteins encoded by the two genes were hydrophili, possibly located in the cytoplasm, belonging to the chloramphenicol acetyltransferase-like domain superfamily. qRT-PCR showed that HQT2 gene was tissue-specific, and its expression levels were different in the stems and leaves, as well as the floral organs at different flowering stages of L. macranthoides and L. japonica. There was a certain correlation between chlorogenic acid content and the relative expression level of this gene. Conclusion This study cloned HQT2 genes of L. macranthoides and L. japonica successfully and analyzed their expressions in the different plant organs. It is speculated that HQT2 gene plays different functions in the chlorogenic acid biosynthesis pathways of L. macranthoides and L. japonica, which provided a research basis for further study of the function of this gene and the regulation mechanism of chlorogenic acid biosynthesis in L. macranthoides and L. japonica.
〔Keywords〕 Lonicera macranthoides Hand.-Mazz.; Lonicera japonica Thunb.; HQT2; gene cloning; bioinformatics analysis; expression analysis
灰氈毛忍冬Lonicera macranthoides Hand.-Mazz.和忍冬Lonicera japonica Thunb.均来源于为忍冬科(Caprifoliaceae)忍冬属(Lonicera Linn.)植物,其干燥花蕾或带初开的花分别作为山银花和金银花入药,在2005版《中华人民共和国药典》开始分列,均具有清热解毒、疏散风热功效[1]。绿原酸是灰毡毛忍冬和忍冬共有活性成分之一,现代研究表明其具抗氧化、抗高血压、抗菌、抗肿瘤、抗辐射、降血糖、降血脂、抗炎、补肾、保肝等多种药理作用[2],其为金银花、山银花清热解毒的潜在功效标志物[3]。医药、化工和食品等领域对绿原酸均有广泛需求[4],其应用前景广泛。研究发现灰毡毛忍冬花蕾中的绿原酸含量较忍冬花蕾明显高[5],进行两者绿原酸生源合成途径关键基因比较研究,探究两者绿原酸含量差异分子机制具有重要意义。
绿原酸是由咖啡酸的1位羧基和奎尼酸的3 位羟基缩合成酯的天然产物[4],是重要的植物苯丙素类次生代谢产物之一,最初由L-苯丙氨酸在苯丙氨酸解氨酶(phenylalnine ammonialyase)生成反式肉桂酸,然后在肉桂酸-4羟化酶(cinnamate 4-hydroxylase)和4-香豆酸连接酶(4-coumarate CoA ligase)作用下生成对-香豆酰辅酶A,最后在羟基肉桂酰辅酶A奎尼酸羟基肉桂酰转移酶(hydroxycinnamoyl-CoA quinate hydroxycinnamoyl transferase)作用下生成绿原酸[6]。目前,有研究者对烟草[7-8]、番茄[7]、咖啡[9]、朝鲜蓟[10-11]、忍冬[12]、灰毡毛忍冬[13]、白花虎眼万年青[14]、番薯[15]等植物进行HQT基因克隆、生物信息学以及表达模式分析的相关研究,从而证明HQT与绿原酸合成有直接关系[16]。
课题组前期构建了灰毡毛忍冬转录组,通过分析挖掘到注释为HQT的片段(Unigene9130),与NCBI中已收录的忍冬与灰毡毛忍冬的HQT序列不同。因此,本研究以灰毡毛忍冬与忍冬花为材料,根据转录组数据中Unigene9130序列设计引物,利用RT-PCR和RACE技术,克隆两者中HQT基因的全长cDNA序列,并进行生物信息学分析,运用qRT-PCR和HPLC技术进行表达模式与绿原酸含量的相关性分析,为进一步通过分子水平探究两者绿原酸含量差异提供实验依据,同时也为完善绿原酸生物合成途径和调节机制研究奠定基础。
1 材料
1.1 药材来源
采收种于湖南中医药大学药植园的灰毡毛忍冬与忍冬的当年生新鲜茎、叶及不同花期花样品(见图1),用装有液氮的泡沫盒运回实验室,经湖南中医药大学周日宝教授鉴定为灰毡毛忍冬与忍冬的茎、叶、花,保存于-80 ℃超低温冰箱。
1.2 试剂
多糖多酚植物总RNA提取试剂盒(Biospin, BSC65S1,杭州博日科技有限公司);反转录试剂盒(RevertAid First Strand cDNA Synthesis Kit, K1622, Thermo);快速琼脂糖凝胶DNA回收试剂盒、CW2302、2×Taq MasterMix(Dye)、CW0682、2×Pfu MasterMix(Dye)、CW0682(康为世纪生物科技有限公司);pEASY■-T1Cloning Vector,CT101、pEASY■-Blunt Cloning Vector,CB101、TranStart■ Green qPCR SuperMix UDG,AQ111(北京全式金生物科技有限公司);RACE试剂盒(SMARTer■ RACE5'/3'Kit,634858,Clontech)。引物序列见表1,由上海生工生物工程股份有限公司合成,引物浓度均为10 μmol/L。
2 方法
2.1 HQT2基因的克隆
2.1.1 总RNA提取和cDNA合成 取适量灰毡毛忍冬与忍冬白蕾期花,按照多糖多酚植物总RNA提取试剂盒说明书提取总RNA[17],用1.5%琼脂糖凝胶电泳检测RNA的完整性,核酸蛋白分析仪检测RNA的纯度。将质量较好的RNA,参照RevertAid First Strand cDNA Synthesis Kit说明书,逆转录合成cDNA的第一链。
2.1.2 HQT2基因核心片段扩增 根据本课题组前期转录组测序结果,选取注释为HQT的序列(Unigene9130),应用Primer Premier 5.0设计特异性引物HQT2-F和HQT2-R(见表1),以逆转录得到的cDNA为模板进行PCR扩增。PCR反应体系25 μL:ddH2O 9.5 μL,2×Taq MasterMix(Dye)12.5 μL,cDNA 1 μL,HQT2-F和HQT2-R各1 μL。PCR反应条件:94 ℃预变性2 min;94 ℃ 变性30 s,60 ℃退火30 s,72 ℃延伸1 min,循环35次;72 ℃终延伸10 min,4 ℃保存。PCR产物用琼脂糖凝胶电泳进行检测,切下目的条带,快速琼脂糖凝胶DNA回收试剂盒进行回收,以pEASY■-T1 Cloning Vector为载体,与目的基因连接,转化至Trans1-T1感受态细胞中,通过含有20 mg/L的X-gal(5-溴-4-氯-3-吲哚β-D-半乳糖苷)、500 mmol/L的IPTG(异丙基-β-D-硫代半乳糖苷)、100 mg/L的Amp(氨苄西林)的LB固体培养基进行蓝白斑筛选,挑选白斑进行菌落PCR,将阳性克隆接种于含有Amp的LB液体培养基中过夜培养,委托铂尚生物技术有限公司对菌液进行测序。
2.1.3 HQT2基因3'和5'端RACE扩增 根据“2.1.2”项核心片段测序结果,设计RACE特异性引物(见表1),按Clontech公司SMARTer■ RACE5'/3'Kit试剂盒说明书,获得5'和3'-RACE-Ready cDNA,用Tricine-EDTA Buffer稀释。
灰毡毛忍冬HQT2 PCR反应体系50 μL:PCR-Grade H2O 15.5 μL,2×SeqAmp Buffer 25 μL,SeqAmp DNA Polymerase 1.0 μL,5'或3'-RACE-Ready cDNA 2.5 μL,10×UPM 5 μL,5'或3'引物1 μL。PCR反应条件:94 ℃ 30 s,72 ℃ 2 min,5个循环;94 ℃ 30 s,70 ℃ 30 s,72 ℃ 2 min,5个循环;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 2 min,3'端25个循环,5'端30个循环。
忍冬HQT2第1次PCR反应体系50 μL:PCR-Grade H2O 15.5 μL,2×SeqAmp Buffer 25 μL,SeqAmp DNA Polymerase 1.0 μL,5'或3'-RACE-Ready cDNA 2.5 μL,10×UPM 5 μl,5'或3'外引物1 μL。PCR反应条件:94 ℃ 30 s,72 ℃ 2 min,5个循环;94 ℃ 30 s,70 ℃ 30 s,72 ℃ 2 min,5个循环;94 ℃ 30 s,68 ℃ 30 s,72 ℃ 2 min,35个循环。第2次巢式PCR,取第1次PCR产物1 μL,加入24 μL Tricine-EDTA Buffer稀释后作为模板,反应体系50 μL:PCR-Grade H2O 17 μL,2×SeqAmp Buffer 25 μL,SeqAmp DNA Polymerase 1 μL,第1次PCR产物稀释液5 μL,UPS 1 μL,5'或3'内引物1 μL。反应条件:94 ℃ 30 s,68 ℃ 30 s,72 ℃ 2 min,25个循环。
扩增目的条带回收和测序等过程同“2.1.2”项,其中载体使用pEASY■-Blunt Cloning Vector。
2.1.4 HQT2基因cDNA全长序列验证 利用ContingExpress对3'端和5'端进行序列拼接,得到HQT2基因的cDNA全长,根据拼接全长设计cDNA全长验证引物V-HQT2-F和V-HQT2-R(见表1),以“2.1.1”项下cDNA为模板进行全长验证。反应体系25 μL:ddH2O 9.5 μL,2×Pfu MasterMix(Dye)12.5 μL,cDNA 1 μL,V-HQT2-F和V-HQT2-R各1 μL。PCR反应条件:94 ℃预变性2 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸3 min,循环35次;72 ℃终延伸5 min,4 ℃保存。扩增目的条带回收和测序等过程同“2.1.2”项,其中载体使用pEASY■-Blunt Cloning Vector。
2.2 生物信息学分析
采用NCBI在线软件“ORF finder”查找HQT2的开放阅读框(https://www.ncbi.nlm.nih.gov/orffinder/),通过在线软件ProtParam(https://web.expasy.org/protparam/)预测蛋白质结构,分析目的基因编码蛋白质的氨基酸组成、蛋白质相对分子质量、理论等电点及稳定性等参数;采用ProtScale软件(http://web.expasy.org/protscale/)测定蛋白质亲水性/疏水性;WOLFPSORT(http://www.genscript.com/wolf-psort.html)在线预测蛋白质亚细胞定位情况;TMHMM 2.0(http://www.cbs.dtu.dk/services/TMHMM/)进行蛋白质跨膜结构分析;SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽;InterProScan(http://www.ebi.ac.uk/interpro/search/sequence-search)分析蛋白质结构域;SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(https://www.swissmodel.expasy.org/)软件分别预测蛋白质的二级结构和三级结构;通过NCBI的蛋白质序列数据库进行BLAST,筛选出同源性较高的物种,利用DNAMAN软件进行氨基酸多重序列比对,MEGA 7软件构建系统进化树。
2.3 HQT2基因的組织表达水平分析
根据HQT2基因全长序列,设计qRT-PCR的特异性引物Q-HQT2-R和Q-HQT2-F(见表1),以18S rRNA做为内参基因[18-19]。按照“2.1.1”项方法提取灰毡毛忍冬与忍冬茎、叶和5个不同花期花的总RNA,将RNA定量后,反转录成cDNA,进行实时荧光定量分析。反应体系20 μL:TranStart■ Green qPCR SuperMix UDG 10 μL,cDNA 1 μL,Q-HQT2-R和Q-HQT2-F各0.4 μL,ddH2O 8.2 μL。反应条件:50 ℃2 min,94 ℃ 10 min;94 ℃ 5 s,55 ℃ 15 s,72 ℃ 10 s,40个循环,做熔解曲线分析,每个样品重复3次,实验在Bio-Rad CFX96上进行,采用2-ΔΔCT计算基因的相对表达量。
2.4 灰毡毛忍冬和忍冬茎、叶及不同花期花绿原酸含量测定
利用Agilent Technologies 1260 Infinity高效液相仪,采用Supersil ODS-B色谱柱(4.6 mm×250 mm,5 μm),参照2020年版《中华人民共和国药典》山银花项下绿原酸含量测定方法[1],对灰毡毛忍冬和忍冬茎、叶及不同花期花样品进行HPLC分析。
3 结果
3.1 HQT2基因全长获得
3.1.1 总RNA的提取 灰毡毛忍冬和忍冬花的总RNA琼脂糖凝胶电泳见图2,可见28S和18S条带明显,其中28S处的亮度是18S的两倍,说明RNA完整性较好,A260/280值为1.8~2.0,A260/230值>2.0,RNA质量符合后续实验要求。
3.1.2 HQT2核心片段扩增 通过转录组Unigene序列设计引物,利用RT-PCR均扩增得到目标条带,大约为790 bp,见图3;经过回收、纯化、克隆、测序后,获得灰毡毛忍冬和忍冬该片段序列均为792 bp,通过DNAMAN比对,与转录组测序结果基本一致。
3.1.3 HQT2基因全長cDNA的获得 根据核心片段序列设计RACE特异性引物,分别进行5'端和3'端扩增。灰毡毛忍冬3'端在953 bp左右出现一条亮带,5'端在836 bp左右出现一条亮带。忍冬3'端在953 bp左右出现一条亮带,5'端在1 068 bp左右出现一条亮带。将亮带切下回收,转化至载体上,挑选阳性克隆测序,将3'端、5'端和核心片段序列进行拼接,两者HQT2基因cDNA全长序列均为1 651 bp。设计全长验证引物,以“2.1.1”项下的cDNA为模板进行PCR扩增,在1 600 bp左右有明显单一亮带,将亮带回收、纯化、克隆、测序,测序结果与拼接全长序列一致,说明成功克隆出HQT2基因的cDNA全长。灰毡毛忍冬HQT2相关结果见图4,忍冬HQT2相关结果见图5。
3.2 HQT2基因生物信息学分析
3.2.1 HQT2蛋白理化特性 灰毡毛忍冬与忍冬HQT2基因全长均为1651 bp,3'端非编码区236 bp,带有30 bp的ployA尾,5'端非编码区119 bp,中间具有完整的开放阅读框1 296 bp,该序列编码氨基酸431个,将其上传至NCBI数据库分别命名为LmHQT2和LjHQT2,GenBank登录号分别为MH196564和MK294639。两者编码氨基酸比对见图6。
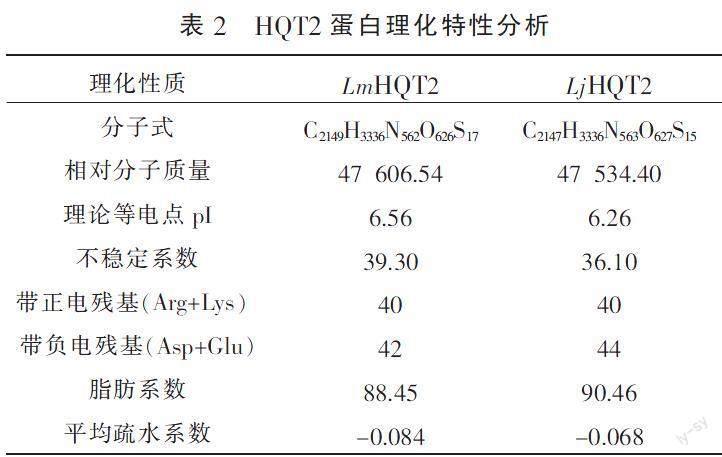
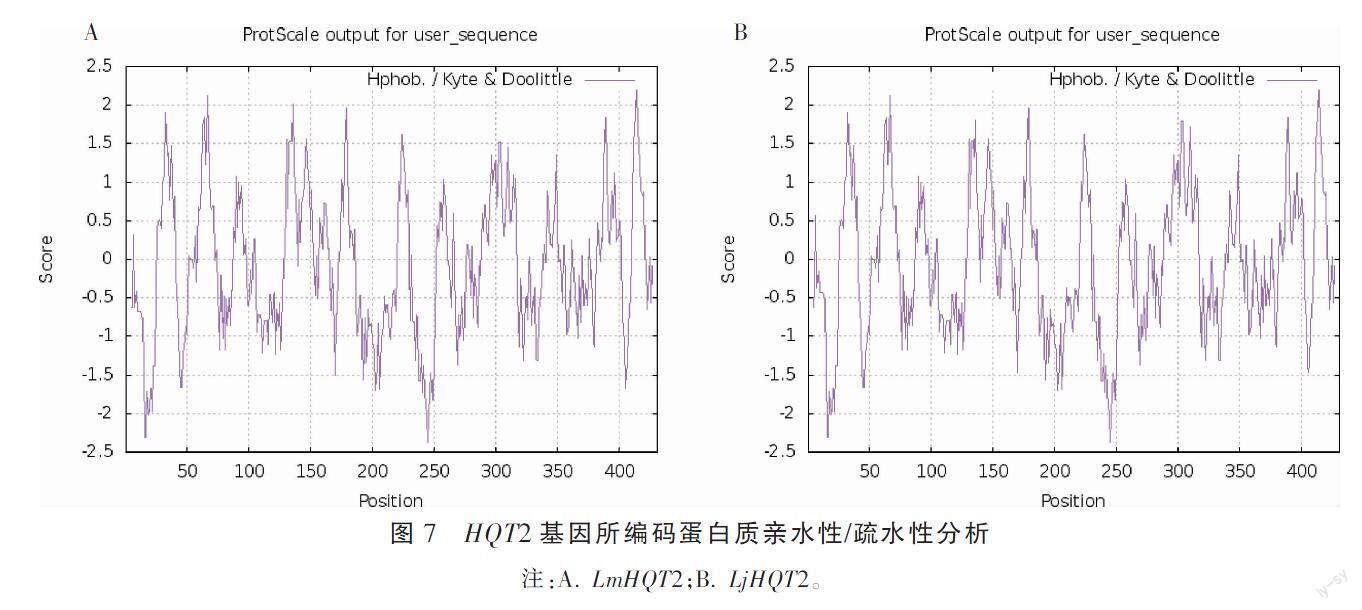
利用ExPASyProtParam在线软件对灰毡毛忍冬与忍冬HQT2基因编码蛋白的理化性质进行预测分析,结果见表2,两者的蛋白理化性质差异不大,不稳定系数均<40,预测两者为稳定蛋白;两者的平均疏水系数<0,且通过ProtScale进行蛋白质亲水性/疏水性分析(图7),预测其为亲水性蛋白质。WOLF PSORT 预测HQT2蛋白可能定位于细胞质中。运用在线软件TMHMM分析,发现该基因编码的氨基酸1-431全部在膜外,不具有跨膜区域。SignalP 4.1 Server进行信号肽预测分析,发现HQT2不具有信号肽序列,推测其不是分泌蛋白。
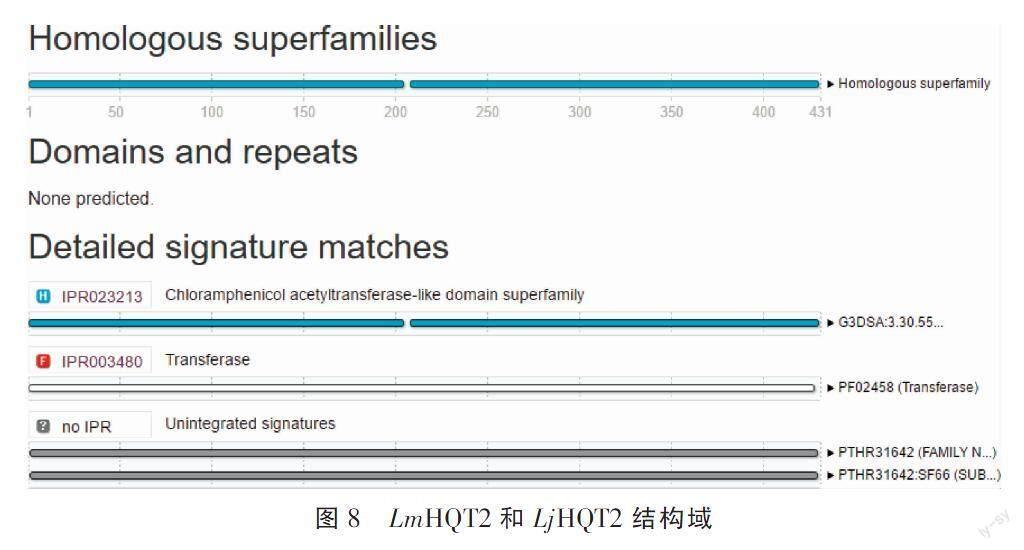
3.2.2 HQT2蛋白结构域和二级、三级结构 应用InterPro对LmHQT2和LjHQT2蛋白结构域进行预测,结果见图8。其同源超家族为氯霉素乙酰转移酶样结构域超家族(chloramphenicol acetyltransferase-like domain superfamily,注释为3.30.559.10,位点1-205 aa和209-431 aa),家族属于转移酶(transferase,注释PF02458,位点1-428 aa)。
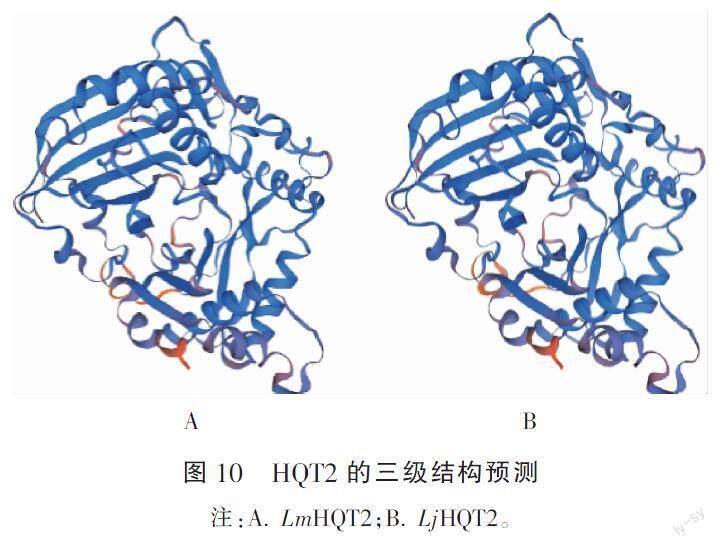
利用SOPMA软件对HQT2蛋白的二级结构进行预测,结果见表3和图9;两者的二级结构元件相差不大,其中α-螺旋和随机卷曲为该蛋白二级结构的主要元件。运用SWISS-MODEL建模工具在线预测HQT2蛋白的三级结构,如图10所示,用于建立三级结构模型的氨基酸残基为1-429位,以[5kjt.1.A] 蛋白为模板,相似度达60%,描述为shikimate O-hydroxycinnamoyltransferase。
3.2.3 HQT2氨基酸序列同源性比对和系统进化树分析 应用NCBI中的BlastP在线软件,对LmHQT2氨基酸序列进行同源性搜索,用DNAMAN进行比对,其与LjHQT2同源性最高,达98.14%,与桔梗Platycodon grandiflorus(AEM63676.1)、烟草Nicotiana tabacum(NP_001312079.1)、番茄Solanum lycopersicum(NP_001234850.2)、野胡萝卜Daucus carota subsp. carota(ANO53925.1)、番薯Ipomoea bat?鄄atas(BAJ14794.1)同源性分别为:74.04%、68.71%、67.81%、63.43%、61.72%。运用DNAMAN对LmHQT2及LjHQT2和上述植物HQT2蛋白进行多序列比对,结果如图11。文献研究发现以上烟草、番茄和番薯的HQT基因被证实在绿原酸的合成中发挥重要作用[7-8,15],因以上物种HQT基因都具有PLN02663羟基肉桂酰辅酶A结构域,故具有相似的功能。从图11编码蛋白结构比对来看,N端差异较大,这可能与N端多为物种特异性信号肽有关。
为研究HQT2氨基酸序列与其他植物的进化关系,在NCBI的BlastP选取与其氨基酸相似的11条氨基酸序列,运用MEGA7构建NJ进化树,结果见图12。系统进化树主要分为3个大的分支,灰毡毛忍冬(MH196564)与忍冬(MK294639)、毛白杨(AFZ78609.1)、番薯(BAJ14794.1)、中粒咖啡(ABO77957.1)、野胡萝卜(ANO53925.1)、矮牵牛(AVA30527.1)聚为一个大类,与同科同属的忍冬亲缘关系最近。
3.3 HQT2基因组织特异性表达
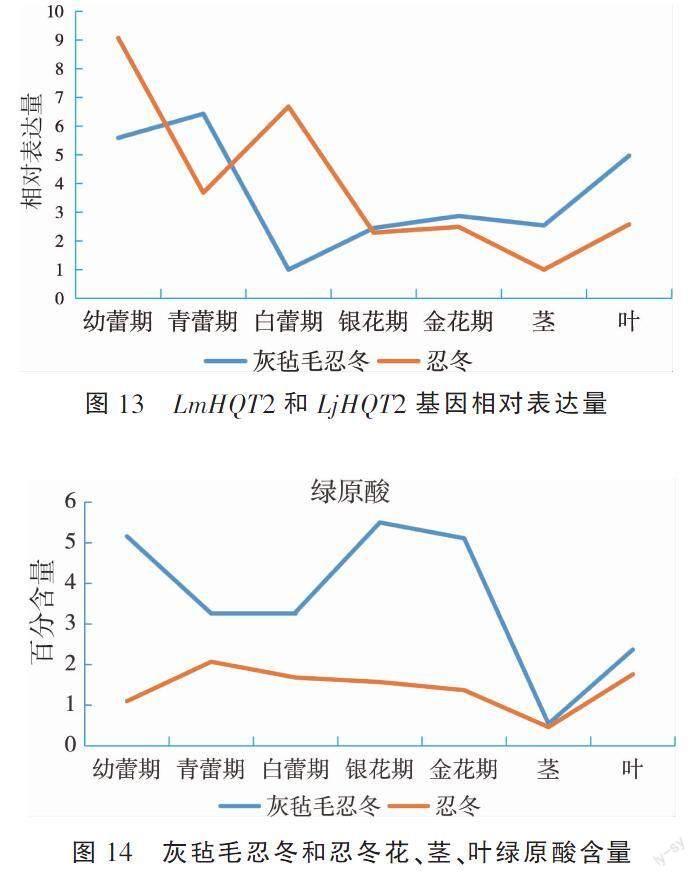
灰毡毛忍冬和忍冬茎、叶、花样品表达量结果见图13。灰毡毛忍冬不同花期花样品中青蕾期相对表达量最高,幼蕾期次之,与其他花期存在显著差异(P<0.01),白蕾期最低。不同器官中,以白蕾期花为参照,相对表达量为叶>茎>白蕾期,其中在叶的相对表达量最高,是茎的1.96倍,是白蕾期的4.97倍。
忍冬不同花期花样品中幼蕾期相对表达量最高,白蕾期次之,与其他花期表达量存在显著差异(P<0.01),银花期最低。不同器官中,以白蕾期花为参照,相对表达量为白蕾期>叶>茎,其在白蕾期的相对表达量最高,是叶的2.59倍,是茎的6.68倍。
由图13可见,HQT2基因在忍冬与灰毡毛忍冬的不同花期和不同器官中,具有不同的相对表达量与变化规律。不同花期中,灰毡毛忍冬的幼蕾期与青蕾期相对表达量较高,而忍冬为幼蕾期与白蕾期较高,两者的银花期与金花期相对量差异较小;不同器官中,两者的花茎叶相对表达均有差异,但茎与叶走势一致。
3.4 灰毡毛忍冬、忍冬茎、叶及不同花期花的绿原酸含量
灰毡毛忍冬和忍冬茎、叶及不同花期花樣品绿原酸含量结果见图14。灰毡毛忍冬中绿原酸含量各个花期、茎和叶均高于忍冬。灰毡毛忍冬和忍冬茎中绿原酸含量均为最低,银花期是灰毡毛忍冬绿原酸含量最高期,而青蕾期是忍冬绿原酸含量最高期。绿原酸含量的总体趋势为灰毡毛忍冬中先降后升再降,忍冬中则表现为先升后降。
4 讨论
绿原酸为忍冬与灰毡毛忍冬共有活性成分之一。HQT为绿原酸生物合成途径中最后一步的关键酶,能催化咖啡酰辅酶A和奎尼酸进行酯交换生成绿原酸[18]。
本研究成功克隆灰毡毛忍冬与忍冬HQT2基因,并分别命名为LmHQT2和LjHQT2;两者基因全长均为1 651 bp,有22个碱基位点存在差异,具有完整的开放阅读框1296 bp,氨基酸431个,有8个氨基酸位点存在差异;预测其为亲水性蛋白,不是分泌蛋白,可能定位于细胞质中。该蛋白质结构域从第1位到第431位氨基酸结束,预测属于转移酶超家族。两者的二级结构中元件相差不大,α螺旋和随机卷曲为该蛋白二级结构的主要元件,三级结构基本一致。同源性对比,两者氨基酸相似度达98.14%,系统进化树分析两者的亲缘关系最近。
文献研究表明,灰毡毛忍冬花较忍冬花中绿原酸含量高[19-20],两品种不同花期花中绿原酸含量存在差异。为探究两品种不同花期花的绿原酸含量与HQT2表达量相关性,本研究运用qRT-PCR对不同花期花进行表达模式分析,发现HQT2在两者的不同花期花中表达量均存在差异,在灰毡毛忍冬中呈现先低再高后再低的趋势,忍冬中先高后低再高再低的趋势。同时文献研究表明灰毡毛忍冬与忍冬的不同器官绿原酸含量也存在差异[21-22],本研究对比了HQT2在不同器官中相对表达量,灰毡毛忍冬为叶>茎>白蕾期花,忍冬为白蕾期花>叶>茎,说明该基因在不同物种不同部位基因的表达量具有组织特异性。
结合分析灰毡毛忍冬和忍冬不同花期花及茎、叶绿原酸含量结果可知,灰毡毛忍冬和忍冬绿原酸含量和基因表达模式有一定的相关性。忍冬前三个花期中HQT2的相对表达量与绿原酸含量呈相反趋势,而在后两个花期和茎、叶呈相似趋势,而灰毡毛忍冬中并不存在显著相关性,仅在茎和叶中有相同趋势,这表明HQT2在忍冬和灰毡毛忍冬中参与绿原酸的合成中发挥的功能可能不一致。
NIGGEWEG等[7]在烟草中分离了HQT的cDNA,在番茄中HQT超表达可导致叶片中绿原酸含量增加85%,而HQT沉默则导致叶片中绿原酸含量降低98%。CL?魪等[23]研究也发现,HQT基因过表达的番茄叶绿原酸含量提高,是野生型的2.5倍,基因沉默的番茄叶绿原酸含量降低。SONNANTE等[11]发现朝鲜蓟中HQT1、HQT2与绿原酸的合成显著相关。PENG[12]与张静茹[24]等从忍冬中克隆HQT1基因,将HQT1基因转入Rosetta(DE3)大肠埃希菌与忍冬愈伤组织中,过表达后绿原酸的含量明显提高。CHEN等[25]克隆了灰毡毛忍冬HQT1基因的CDS序列,构建超表达体系,转基因植株叶中的绿原酸含量提高了大约60%。上述研究表明,HQT在不同物种绿原酸生物合成中均起了关键的作用。笔者比较了LmHQT1[25]与本研究克隆的LmHQT2氨基酸序列,两者相似度达79%,蛋白理化特性与结构相似度高;同时利用BlastP进行其他植物HQT与LmHQT2/LjHQT2比对,其相似度较高,可预测本研究克隆得到的HQT2基因可能为灰毡毛忍冬/忍冬HQT中的一员。后期项目组将构建HQT2基因的灰毡毛忍冬与忍冬过表达载体,进行HQT2基因功能验证,为灰毡毛忍冬和忍冬次生代谢产物绿原酸积累的分子调控机制提供依据。
本研究为灰毡毛忍冬和忍冬HQT2基因的功能预测奠定了基础,丰富了NCBI中HQT基因序列,同时对完善灰毡毛忍冬和忍冬绿原酸生物合成和调节机制具有重要意义。
参考文献
[1] 国家药典委员会. 中华人民共和国药典: 一部[M]. 北京: 中国医药科技出版社, 2020: 32, 230.
[2] 张浩超, 郝宝燕, 孙皓熠, 等. 绿原酸研究进展[J]. 食品与药品, 2017, 19(3): 222-227.
[3] 彭 莎, 霍晓乾, 霍梦琪, 等. 基于系统中药学的金银花清热解毒功效标志物研究[J]. 中国中药杂志, 2020, 45(14): 3275-3281.
[4] 王玲娜, 姚佳欢, 马超美. 绿原酸的研究进展[J]. 食品与生物技术学报, 2017, 36(11): 1121-1130.
[5] 周日宝, 童巧珍. 灰毡毛忍冬与正品金银花的绿原酸含量比较[J]. 中药材, 2003, 26(6): 399-400.
[6] YUAN Y, WANG Z Y, JIANG C, et al. Exploiting genes and functional diversity of chlorogenic acid and luteolin biosyntheses in Lonicera japonica and their substitutes[J]. Gene, 2014, 534(2): 408-416.
[7] NIGGEWEG R, MICHAEL A J, MARTIN C. Engineering plants with increased levels of the antioxidant chlorogenic acid[J]. Nature Biotechnology, 2004, 22(6): 746-754.
[8] CARDENAS C L, COSTA M A, LASKAR D D, et al. RNA imodulation of chlorogenic acid and lignin deposition in Nicotiana tabacum and insufficient compensatory metabolic cross-talk[J]. Journal of Natural Products, 2021, 84(3): 694-706.
[9] LEPELLEY M, CHEMINADE G, TREMILLON N, et al. Chlorogenic acid synthesis in coffee: An analysis of CGA content and real-time RT-PCR expression of HCT, HQT, C3H1, and CCoAOMT1 genes during grain development in C. canephora[J]. Plant Science, 2007, 172(5): 978-996.
[10] COMINO C, HEHN A, MOGLIA A, et al. The isolation and mapping of a novel hydroxycinnamoyltransferase in the globe artichoke chlorogenic acid pathway[J]. BMC Plant Biology, 2009, 9: 30.
[11] SONNANTE G, D'AMORE R, BLANCO E, et al. Novel hydroxycinnamoyl-coenzyme A quinate transferase genes from artichoke are involved in the synthesis of chlorogenic acid[J]. Plant Physiology, 2010, 153(3): 1224-1238.
[12] PENG X X, LI W D, WANG W Q, et al. Cloning and characterization of a cDNA coding a hydroxycinnamoyl-CoA quinate hydroxycinnamoyl transferase involved in chlorogenic acid biosynthesis in Lonicera japonica[J]. Planta Medica, 2010, 76(16): 1921-1926.
[13] 陳泽雄. 灰毡毛忍冬(Lonicera macranthoides Hand.-Mazz)中绿原酸生物合成途径及调控技术研究[D]. 重庆: 重庆大学, 2016.
[14] 姜福星, 廖宇嘉, 吴 生, 等. 白花虎眼万年青绿原酸合成酶基因QtHQT的克隆及表达分析[J]. 分子植物育种, 2016, 14(12): 3325-3333.
[15] XU J, ZHU J H, LIN Y H, et al. Comparative transcriptome and weighted correlation network analyses reveal candidate genes involved in chlorogenic acid biosynthesis in sweet potato[J]. Scientific Reports, 2022, 12(1): 2770.
[16] 何 柳, 陈士林. 植物中绿原酸合成途径研究进展[J]. 药物生物技术, 2013, 20(5): 463-466.
[17] 刘湘丹, 徐玉琴, 王 珊, 等. 适用于基因全长克隆的灰毡毛忍冬不同器官总RNA提取方法筛选[J]. 湖南中医药大学学报, 2015, 35(12): 60-63.
[18] 杨银菊, 陈爱国, 刘光亮, 等. 烟草绿原酸生物合成途径关键酶基因的研究进展[J]. 现代农业科技, 2018(13): 5-8, 10.
[19] 李隆云, 张 应, 马 鹏, 等. 山银花(灰毡毛忍冬)适宜采收期研究[J]. 中国中药杂志, 2014, 39(16): 3060-3064.
[20] 杨欣欣, 包永睿, 王 帅, 等. 不同采收期金银花药材质量评价研究[J]. 时珍国医国药, 2015, 26(6): 1466-1468.
[21] 邓玲姣, 周晓舟, 黄素梅, 等. 忻城县金银花及其茎、叶中绿原酸含量测定[J]. 广西农学报, 2007, 22(5): 34-36.
[22] 吴飞燕, 卿志星, 曾建国. HPLC测定灰毡毛忍冬不同部位中绿原酸和木犀草苷的含量[J]. 中国现代中药, 2014, 16(8): 614-617.
[23] CL?魪 C, HILL L M, NIGGEWEG R, et al. Modulation of chlorogenic acid biosynthesis in Solanum lycopersicum; consequences for phenolic accumulation and UV-tolerance[J]. Phytochemistry, 2008, 69(11): 2149-2156.
[24] 张静茹, 吴敏琳, 李卫东, 等. 金银花HQT基因在真核植物细胞中对绿原酸生物合成的调控[J]. 中草药, 2016, 47(20): 3683-3687.
[25] CHEN Z X, LIU G H, LIU Y Q, et al. Overexpression of the LmHQT1 gene increases chlorogenic acid production in Lonicera macranthoides Hand-Mazz[J]. Acta Physiologiae Plantarum, 2017, 39(1): 27.
(本文编辑 苏 维)
