化学酶法对硫酸软骨素类多糖的定量分析
2023-08-14陈婷婷李文静杨桂霞周贤轩石春红
陈婷婷, 李文静, 杨桂霞, 周贤轩, 石春红
(合肥工业大学 食品与生物工程学院,安徽 合肥 230601)
硫酸软骨素(chondroitin sulfate,CS)是一类广泛存在于动物结缔组织中的酸性糖胺聚糖类大分子多糖,在生物体内多以蛋白聚糖侧链形式存在[1-2]。硫酸软骨素及软骨素的碳链骨架由葡糖醛酸(GlcA)和N-乙酰半乳糖胺(GalNAc)以β-1,3和β-1,4糖苷键(4-GlcA-β-1,3-GalNAc-β-1)交替连接而成的重复二糖单元组成,一般有二糖单元20~100个[3-4]。软骨素经硫酸化后得到硫酸软骨素,根据其硫酸化位点的不同,可以将硫酸软骨素分为以下不同类型[5]:硫酸化发生在GalNAc的C-4位、GalNAc的C-6位羟基上的分别是硫酸软骨素A、硫酸软骨素C;硫酸软骨素E的GalNAc的C-4位和C-6位羟基均发生硫酸化;硫酸软骨素B一般称为硫酸皮肤素(DS),其结构是硫酸软骨素A中GlcA被艾杜糖醛酸取代[6]。硫酸软骨素因其结构多样性而具有各种不同功能[7],硫酸软骨素及其低分子量衍生物在治疗风湿病、骨质疏松症、关节炎、腰间盘突出等方面具有重要作用[8-10]。
硫酸软骨素裂解酶(ChSase)可以将硫酸软骨素、透明质酸等糖胺聚糖裂解为不饱和二糖及寡糖[11],主要存在于微生物中。根据其作用底物的不同可以分为ChSase ABC、ChSase AC、ChSase B、ChSase C等类型。其中:ChSase ABC可以降解硫酸软骨素A、硫酸软骨素B、硫酸软骨素C及透明质酸;ChSase AC可将软骨素、硫酸软骨素A、硫酸软骨素C及透明质酸降解为不饱和二糖和寡糖[12];ChSase B可以降解硫酸软骨素B和透明质酸;ChSase C严格作用于硫酸软骨素C和透明质酸。本研究使用的裂解酶AsChnAC酶解机制同ChSase AC,是一种硫酸软骨素AC外切酶[13]。
本研究提供了一种复杂培养液中软骨素类多糖质量浓度的定量检测方法,通过多糖酶解与蒽酮-硫酸法相结合,测定软骨素类多糖质量[14],测定过程如图1所示。
首先通过超滤去除培养基中小分子杂质,再用相应的裂解酶将多糖分解为不饱和二糖或寡糖,这些低分子量糖可经超滤截留住大分子杂质,最后结合蒽酮-硫酸法测定糖质量浓度。
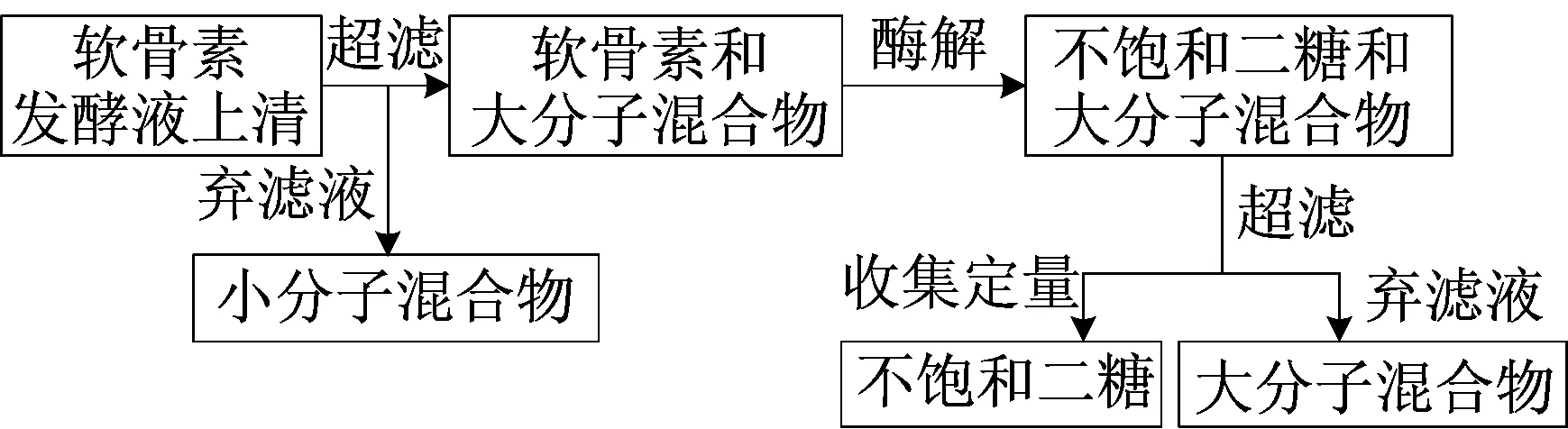
图1 化学酶法定量示意图
1 材料与方法
1.1 实验材料
1.1.1 菌株
大肠杆菌 BL21、大肠杆菌K4ΔkfoE、大肠杆菌EcNΔkfiA∶∶Kan、大肠杆菌EcN、大肠杆菌BL21/pET28a(+)-AsChnAC,均由本实验室保存。
1.1.2 材料与试剂
硫酸软骨素C、异丙基-β-D-硫代半乳糖苷(IPTG)、三羟甲基氨基甲烷(Tris)、氯化钠、咪唑、苯甲基磺酰氟(PMSF)、蒽酮、浓硫酸、重水(D2O)、Bradford试剂、40%丙烯酰胺、十二烷基硫酸钠(SDS)、过硫酸铵(APS)、TEMED、超滤管、透析袋等。
1.2 实验方法
1.2.1 诱导纯化硫酸软骨素裂解酶AsChnAC
将携带表达硫酸软骨素裂解酶AsChnAC质粒的大肠杆菌BL21/pET28a(+)-AsChnAC单克隆过夜培养并转移到2 L新鲜LB培养液中,37 ℃振荡培养至A600>0.6。加400 μL 1 mol/L IPTG于22 ℃过夜诱导。诱导后的菌液在转速6 000 r/min下4 ℃离心20 min,收集菌体。用BufferA(25 mmol/L Tris,500 mmol/L NaCl,30 mmol/L咪唑)重悬菌体。向上述溶液加100 mmol/L PMSF后超声破碎,破碎的细胞液于12 000 r/min、4 ℃离心20 min,收集上清液。上清液以1 mL/min的流速通过Ni-NTA柱,用BufferA(25 mmol/L Tris,500 mmol/L NaCl,30 mmol/L咪唑)洗杂,BufferB(25 mmol/L Tris,500 mmol/L NaCl,250 mmol/L咪唑)洗脱。在25 mmol/L Tris、500 mmol/L NaCl溶液中透析,收集蛋白组分。纯化后的蛋白进行SDS-PAGE电泳,并使用Bradford法测其蛋白质量浓度[15]。
1.2.2 蒽酮-硫酸法
样品与蒽酮反应试剂(含0.1%蒽酮和80%浓硫酸)以体积比1∶3混匀,每种样品设置3个平行组,将混合液于100 ℃水浴15 min、冰浴15 min,测定620 nm处吸光度值。
1.2.3 硫酸软骨素C标准曲线的绘制
称取硫酸软骨素C溶于ddH2O,配制成20 mg/mL的母液,将硫酸软骨素C稀释至0.1、0.2、0.4、0.6、0.8、2.0 mg/mL,每个质量浓度梯度设置3个平行组,蒽酮-硫酸法测620 nm处吸光度值,OriginPro绘制标准曲线,计算线性回归方程。
1.2.4 AsChnAC裂解硫酸软骨素C定量分析
将30 mg/ml 硫酸软骨素C(溶于20 mmol/L Tris-HCl,pH值为7.0)与0.2 mg/mL AsChnAC等体积混合,在37 ℃下分别水浴反应10、30、50、90、720、960 min,100 ℃煮沸3 min,13 000g离心2 min,收集上清液。取400 μL上清液加入0.5 mL 10 kDa超滤管,14 000g离心30 min,收集过滤液。倒置超滤管,1 000g离心2 min,收集浓缩液。蒽酮-硫酸法测硫酸软骨素C质量。
1.2.5 核磁共振氢谱分析
称取20 mg 硫酸软骨素C溶于500 μL D2O,将待测样品装入0.5 mm核磁管进行核磁共振氢谱(proton nuclear magnetic resonance,1H NMR)检测。分别称取20 mg硫酸软骨素C溶于1mL LB培养液和1 mL BL21菌液上清,干燥完全后,溶于500 μL D2O,将待测样品装入0.5 mm核磁管进行1H NMR检测。
1.2.6 质谱分析
将20 mg/mL 硫酸软骨素C与0.2 mg/mL AsChnAC等体积混合,37 ℃水浴反应16 h。反应液于100 ℃煮沸3 min,13 000g离心2 min,收集上清。上清用透析膜(MWCO 1 kDa)在去离子水中透析4 h。将上述样品进行质谱分析。
1.2.7 硫酸软骨素C和软骨素质量浓度测定
分别挑取大肠杆菌K4ΔkfoE、大肠杆菌EcN、大肠杆菌EcNΔkfiA∶∶Kan单克隆于3 mL M9C中,37 ℃振荡过夜。分别将上述菌液按1%的量转接至50 mL M9C中,37 ℃振荡培养约20 h。菌液于12 000 r/min离心10 min收集上清。称取硫酸软骨素C溶于EcNΔkfiA∶∶Kan菌液上清中配制成1 mg/mL的溶液。分别取3 mL上述硫酸软骨素C溶液、K4ΔkfoE菌液上清、EcN菌液上清、EcNΔkfiA∶∶Kan菌液上清与300 μL 200 mmol/L Tris-HCl(pH值为7.0)溶液混匀。混匀后分别用0.22 μm滤器过滤,以去除残余菌体。取上述过滤后的溶液加入10 kDa 0.5 mL超滤管,一次400 μL,14 000g离心30 min后弃滤液,重复此过程直至3 mL溶液加完。加400 μL 20 mmol/L Tris-HCl,14 000g离心20 min,重复2次,去除培养液中小分子杂质。向超滤管加150 μL 20 mmol/L Tris-HCl(pH值为7.0),冲洗膜两侧,倒置超滤管,1 000g离心2 min,再加20 mmol/L Tris-HCl(pH值为7.0)定容至200 μL。加300 μL 2 mg/mL AsChnAC于定容后的溶液中,37 ℃水浴反应16 h后,100 ℃煮3 min,13 000g离心2 min,收集上清。将上清加入10 kDa 0.5 mL超滤管,14 000g离心30 min,得到过滤液。过滤液干燥完全,加100 μL ddH2O重悬,重悬液用蒽酮-硫酸法测其多糖质量浓度。
1.2.8 样品损失率及软骨素质量浓度的计算
以硫酸软骨素C溶液计算样品损失率,公式如下:
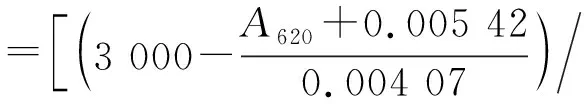
软骨素质量浓度计算公式为:
2 结果与分析
2.1 1H NMR结果分析
将硫酸软骨素C进行1H NMR检测,结果如图2所示。

图2 硫酸软骨素C的1H NMR分析
从图2可以看出,图谱无杂峰,且CS—C共有7个特征峰,其中化学位移在1.99×10-6处是硫酸软骨素C中N-乙酰基甲基的特征峰,通常可以用来粗略定量该糖质量。LB培养液中硫酸软骨素C的核磁共振图谱和大肠杆菌 BL21培养液中硫酸软骨素C的核磁共振图谱与硫酸软骨素C标准品的图谱对比,发现复杂培养基中的硫酸软骨素C的核磁共振图谱有较多杂峰,特别是N-乙酰基甲基的特征峰信号受到严重干扰,说明其中复杂成分干扰了NMR对硫酸软骨素C的定量分析。因此,1H NMR法不能用于测定复杂培养基LB培养液中的硫酸软骨素C质量浓度。
2.2 硫酸软骨素裂解酶的诱导表达与纯化
将表达得到的蛋白收集纯化,进行SDS-PAGE电泳,AsChnAC酶蛋白SDS-PAGE分析结果如图3所示,图3中:泳道1为Protein Marker;泳道2为AsChnAC蛋白。
由图3可知,纯化后得到较单一的目的蛋白,纯化后收集的AsChnAC蛋白用Bradford法测得,其质量浓度为2 mg/mL。

图3 AsChnAC酶蛋白SDS-PAGE电泳图
2.3 硫酸软骨素C标准曲线绘制
浓硫酸将多糖水解为单糖,与蒽酮反应生成深绿色复合物,在620 nm处有最大吸光度值,吸光度值与糖质量存在明显线性关系。以硫酸软骨素C质量为横坐标,吸光度值为纵坐标,绘制标准曲线。硫酸软骨素C的标准曲线如图4所示。
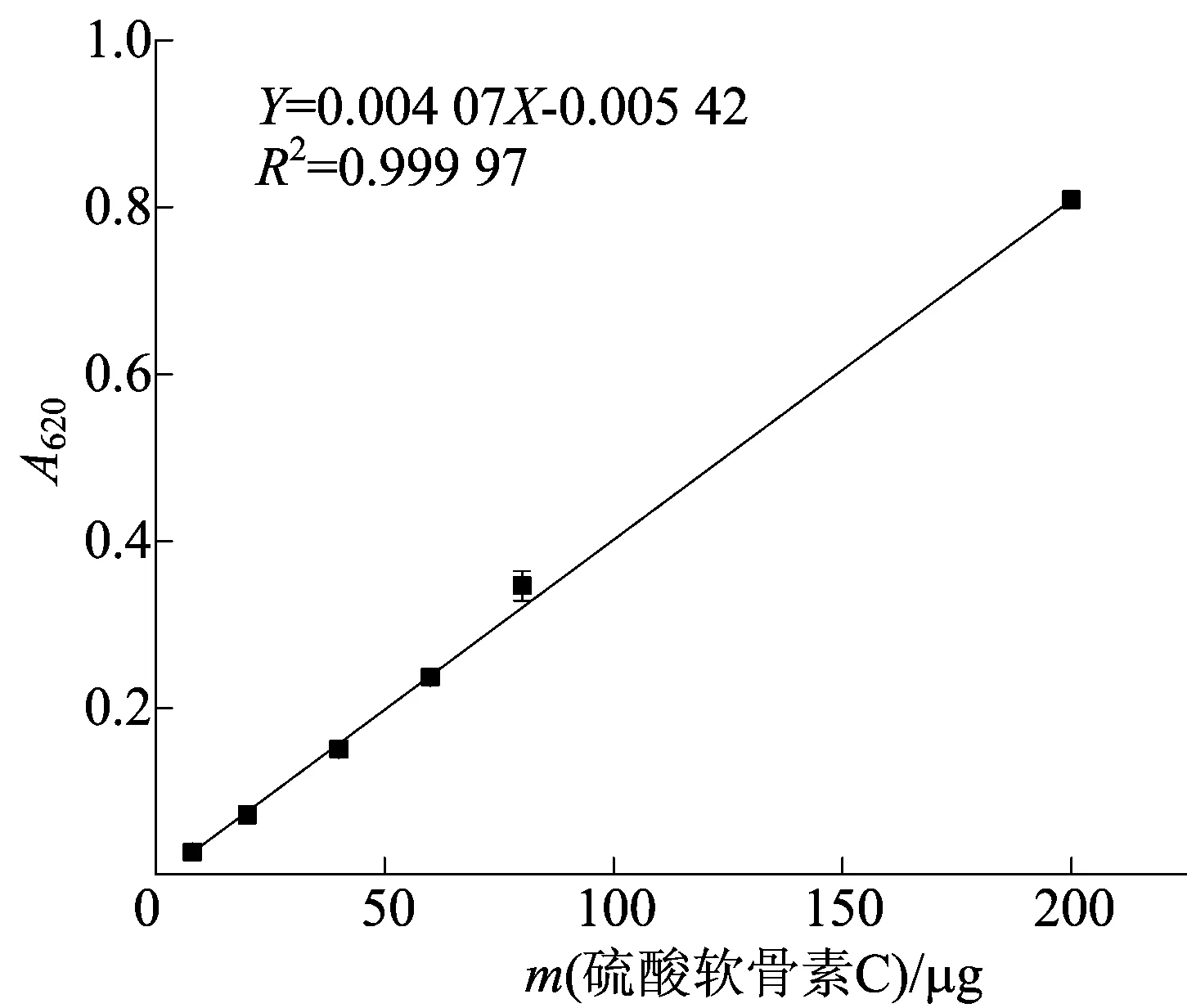
图4 硫酸软骨素C标准曲线
由图4可知,在所测质量浓度范围内,硫酸软骨素C质量与吸光度值呈正相关。
2.4 硫酸软骨素C裂解的定量分析
硫酸软骨素C在不同消化时间点超滤收集的寡糖质量如图5a所示。由图5a可知,硫酸软骨素C与AsChnAC裂解酶等体积混合,于37 ℃水浴反应不同时间,酶解液上清经超滤得到的过滤液用蒽酮-硫酸法定量。硫酸软骨素C在被AsChnAC分解90 min后寡糖质量不再明显增加。
倒置超滤管得到未被分解的硫酸软骨素C,未分解的硫酸软骨素C质量占总硫酸软骨素C质量的比例与时间呈负相关,如图5b所示。由图5b可知,随时间的增加,未分解的硫酸软骨素C质量占总硫酸软骨素C质量的比例逐渐下降,表明硫酸软骨素C被AsChnAC裂解为寡糖。在酶解960 min后,酶解率可达96.5%。

图5 不同消化时间硫酸软骨素C定量分析
2.5 硫酸软骨素C和软骨素质量浓度分析
硫酸软骨素C经AsChnAC酶解后的质谱分析如图6所示。由图6可知,所得实测二糖的m/z值为457.7、480.1,符合预期二糖的m/z值(458.07和480.04)。质谱分析结果显示,高分子硫酸软骨素被酶切成了二糖,其他寡糖成分极少,在质谱分析中没有明显信号。
通过AsChnAC酶解法和蒽酮-硫酸法,测定了复杂培养基中的硫酸软骨素C质量浓度以及EcN、K4ΔkfoE菌株上清液中未纯化的软骨素质量浓度。大肠杆菌EcNΔkfiA∶∶Kan为敲除了kfiA基因的EcN菌株,为本实验室保存。由于kfiA基因的敲除,该菌株无法合成荚膜多糖,因此可以作为阴性对照。以硫酸软骨素C标准品溶液作为外标,反映了待测样品的损失率,根据损失率算出软骨素类多糖的质量浓度如图7所示。
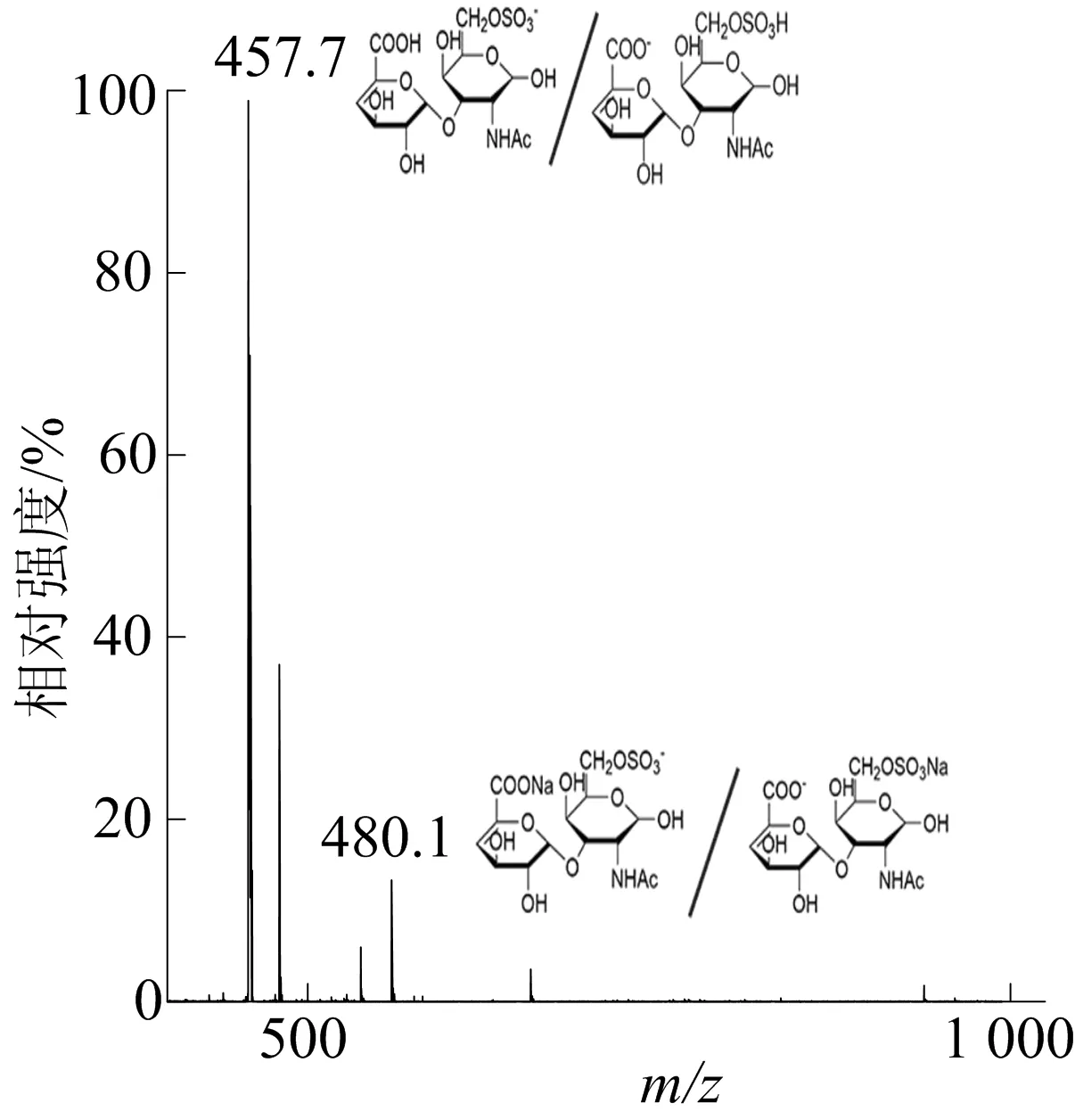
图6 硫酸软骨素C酶解后质谱分析
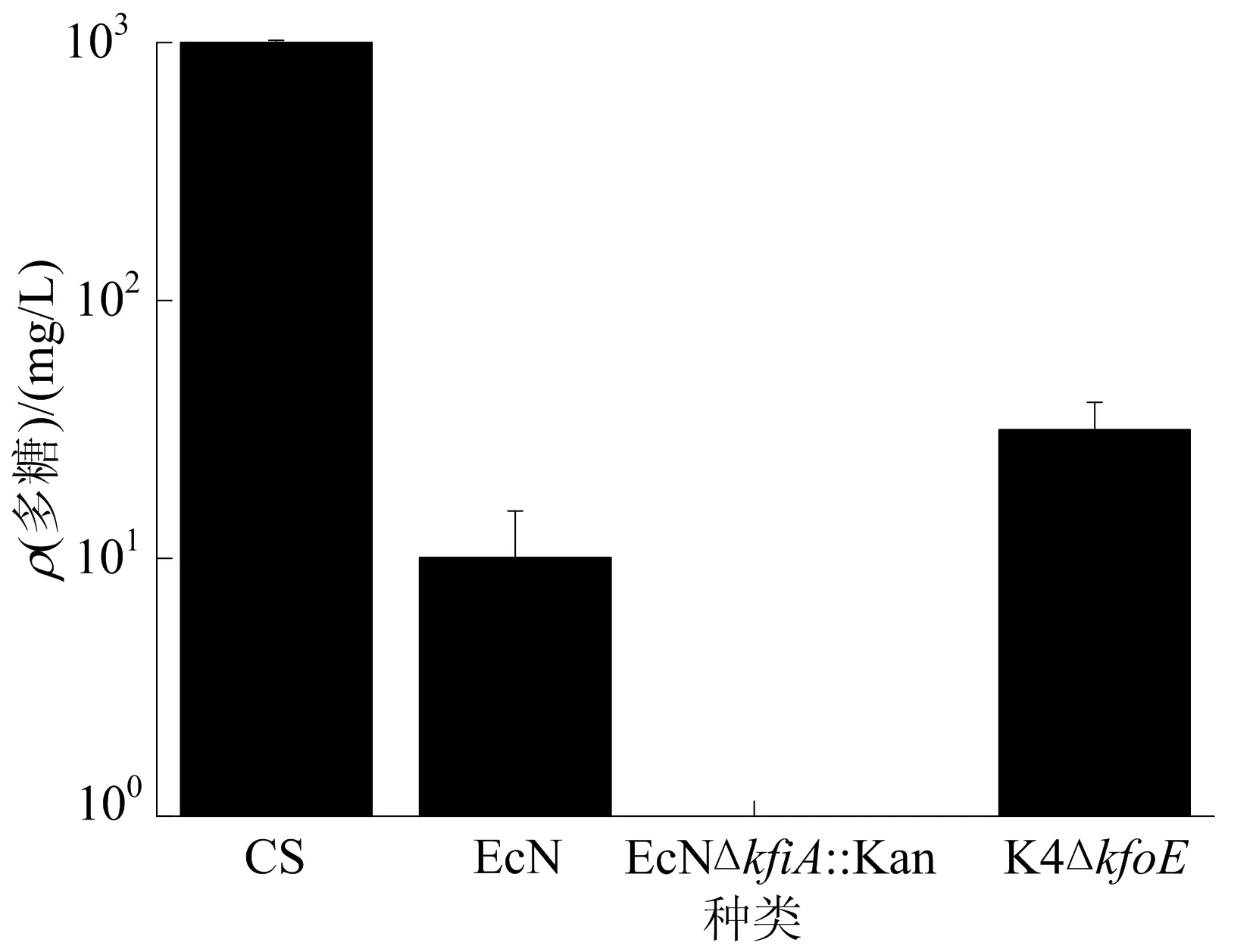
图7 培养液中软骨素类多糖的质量浓度
将硫酸软骨素C溶液的A620代入损失率计算公式,得到损失率为23.1%。将EcN、K4ΔkfoE上清的A620代入软骨素质量浓度计算公式,得到EcN上清中软骨素类多糖质量浓度为10.1 mg/L,K4ΔkfoE上清中软骨素的质量浓度为31.5 mg/L。
3 讨 论
硫酸软骨素的传统制备方法主要是从动物的软骨组织中提取[16],存在结构不均匀、动物源致病菌等问题[17]。软骨素与大肠杆菌K4的荚膜多糖结构类似[18]。近年来,通过微生物发酵生产软骨素,并进一步制备出硫酸软骨素,逐渐成为研究热点[19]。该方案具有潜在的显著降低成本、低污染、工艺简单、产品质量稳定等优点。大肠杆菌K4是软骨素类似物的主要生产菌株,其产物是果糖软骨素。本研究使用敲除了kfoE基因的K4ΔkfoE菌株,其产物去除了该菌荚膜多糖中的果糖基团,是制备硫酸软骨素的重要原材料[20]。但是在测定该菌产生的软骨素质量时,微生物培养液中的复杂成分(如培养基单糖成分、代谢产物、肽聚糖成份等)会干扰软骨素多糖的定量分析。因此,有必要开发一种方法快速定量检测发酵液中硫酸软骨素类多糖质量浓度。
硫酸软骨素的分子量范围为20~80 kDa,AsChnAC酶蛋白属于硫酸软骨素裂解酶AC,在葡糖醛酸C4位断裂β-1,4糖苷键,生成不饱和双键[13,21]。本文使用专一性的酶解方法去除杂质的干扰,结合蒽酮-硫酸法可以简便准确地测定复杂培养液中的多糖质量浓度。使用截留分子量为10 kDa的超滤管先将培养液中的小分子干扰物去除,再用裂解酶AsChnAC将硫酸软骨素类多糖降解为不饱和寡糖。通过超滤得到寡糖过滤液,进一步排除了大分子杂质的干扰,最后使用蒽酮-硫酸法可以方便地测出软骨素类多糖质量浓度。
该方法提供了一种发酵液中软骨素类多糖质量浓度的定量检测方法。该方法偶联了酶专一性分解软骨素与化学分析方法,只需通过2个步骤,即可将复杂成分中造成定量干扰的小分子、大分子杂质去除,可以快速地测定复杂培养液中的软骨素类多糖质量浓度。该方法具有普适性,利用不同专一性的多糖裂解酶,该方法也可以扩展使用于其他多糖的定量分析。
