猪链球菌荚膜多糖抗血清的制备及在血清分型中的应用
2023-08-14胡群肖琦温立斌彭大新何孔旺
胡群 肖琦 温立斌 彭大新 何孔旺

摘要:为获得猪链球菌荚膜多糖及其抗血清,采用高压破碎法、乙醇分级沉淀法、酶解法以及Sevage法提取纯化了猪链球菌2、3、7、9型荚膜多糖,采用己二酸二酰肼(ADH)间桥法将荚膜多糖与牛血清蛋白(BSA)偶联,将其制备成油乳疫苗免疫BALB/c纯系雌性小鼠制备抗血清,同时制备了猪链球菌2、3、7、9型全菌灭活苗抗血清进行了间接ELISA试验及玻片试验检测。试验结果显示,制备了高纯度的荚膜多糖,对荚膜多糖-牛血清白蛋白偶联物分析,荚膜多糖偶联蛋白后的分子量变大,荚膜多糖与牛血清白蛋白偶联比为1 ∶1,免疫小鼠表现出较高的免疫原性。而将单独的4种荚膜多糖以及荚膜多糖与牛血清白蛋白(牛血清白蛋白)混合作为比较也免疫小鼠不能激活免疫系统产生IgG抗体,不具有免疫原性。荚膜多糖结合蛋白抗血清与全菌灭活苗抗血清同时进行交叉ELISA以及玻片凝集试验,结果表明这4型荚膜多糖结合蛋白抗血清不与其他型菌株发生反应,具有型特异性,而全菌灭活苗抗血清与其他型菌株会发生一定程度的交叉反应。此研究结果为猪链球菌亚单位疫苗的研制以及猪链球菌分型试剂的制备提供了试验依据。
关键词:猪链球菌;荚膜多糖;抗血清;间接ELISA;玻片凝集试验
中图分类号:S852.4 文献标志码:A
文章编号:1002-1302(2023)13-0189-08
猪链球菌(Streptococcus suis,SS)是一种世界范围内危害严重的人畜共患病原体,病猪、健康猪以及临床康复猪均可携带[1-3]。猪链球菌可导致猪出现急性败血症、肺炎、脑膜炎和关节炎,发生不可逆转的后遗症;也会感染人并引起死亡[4]。在过去的20年里,猪链球菌是中国大多数养猪场最常见的病原菌,对许多亚洲国家的养猪业造成了巨大损害[5]。
根据猪链球菌荚膜多糖抗原成分的差异性,可分为35个血清型(1~34型、1/2型),但经研究发现20、22、26、32、34型不属于猪链球菌,因此目前认为剩余的29个血清型是真正的猪链球菌[6]。具有致病能力的血清型主要集中在1~9血清型,其中2型流行最广且分离率最高[7],血清型3、7、9在包括我国在内的许多国家都很常见[8]。
猪链球菌的主要毒力因子包括荚膜多糖、溶菌酶释放蛋白、细胞外因子以及溶血素等[9]。有研究表明,荚膜多糖主要是通过抗吞噬作用保护猪链球菌抵抗免疫反应,是猪链球菌重要的毒力因子和保護性抗原[10],可以作为疫苗开发的主要靶抗原。但是荚膜多糖抗原免疫原性较差[11],试验表明将荚膜多糖与载体蛋白偶联后可以大大提高荚膜多糖抗原的免疫原性[12]。根据偶联剂的不同,常用方式有2种:己二酸二酰肼(ADH)间桥法以碳二亚胺(EDAC)作偶联剂,以及还原氨基化法用过碘酸钠(NaIO4)将侧链基团氧化形成反应性醛基基团[13]。
由于猪链球菌血清型多且分布广,上世纪80年代澳大利亚、加拿大、荷兰等国家就已经使用具有完整荚膜多糖的灭活菌作为免疫原制备出猪链球菌抗血清,并将其应用于玻片凝集试验、毛细沉淀试验等最常见的血清学方法用于血清型鉴定,随后又出现了PCR、MLST等检测方法。目前国内最常用的猪链球菌检测方法是PCR检测。荚膜多糖是分型的依据,灭活菌体因具有完整的丰富荚膜经常被作为免疫原进行抗血清的制备,但灭活菌体由于含有多种抗原会导致交叉反应的出现,需要通过交叉吸附试验来去除各血清型之间的交叉反应。而本研究采用乙醇分级沉淀法、Sevage法提取纯化了猪链球菌2、3、7、9型的荚膜多糖,将其与牛血清白蛋白偶联制成荚膜多糖亚单位疫苗免疫小鼠制备抗血清,并采用这4种抗血清对实验室保存的其他已经定型的猪链球菌进行玻片凝集试验鉴定其特异性。从而为猪链球菌不同血清型的鉴定和主要血清型流行情况调查提供诊断试剂,为猪链球菌病的诊断及防控提供支撑。
1 材料与方法
1.1 材料
1.1.1 菌株 试验所用猪链球菌株各血清型菌株由江苏省农业科学院兽医研究所分离、鉴定和保存。
1.1.2 主要试剂和耗材 THB培养基购自美国BD公司;溶菌酶购自上海碧云天生物技术有限公司;蛋白酶K购自上海源叶公司;正丁醇、氯仿、无水乙醇、苯酚、葡萄糖、H2SO4 均购自国药集团化学试剂有限公司;NaHCO3、Na2CO3购自西陇化工股份有限公司;Bradford蛋白浓度测定试剂盒(去垢剂兼容型)购自碧云天生物技术有限公司;脱脂奶粉购自伊利公司;明胶购自Amresco公司;牛血清白蛋白购自南京助研生物技术有限公司;辣根过氧化物酶标记HRP亲和纯化山羊抗鼠IgG(H+L)二抗购自公司;单组分TMB显色液购自湖州英创生物科技有限公司;ELISA酶标板购自Corning Incorporated公司;弗式完全佐剂和弗式不完全佐剂购自Sigma公司。
1.1.3 试验动物 4周龄无特定病原体(specific pathogen free,SPF)的BALB/c纯系雌性小鼠购自上海实验动物中心。
1.2 方法
1.2.1 荚膜多糖抗原的制备以及含量的测定 将猪链球菌2、3、7、9型菌株置于37 ℃静止培养 15 h,将上述获得的菌液4 ℃、6 000 r/min低温离心 5 min,收集菌体;将菌体用灭菌PBS清洗3次;再加入50 mL灭菌PBS重悬后加入终浓度为 0.25 mg/mL 的溶菌酶,37 ℃裂解过夜;将上述溶液4 ℃、9 000 r/min离心30 min,收集上清,使用 0.22 μm 针头滤器过滤上清;将上清液加入终浓度为100 μg/mL的蛋白酶K,55 ℃过夜;80 ℃条件下处理30 min灭活酶,冷却至室温;将上述处理后的溶液加入CaCl2溶液至终浓度0.1 mol/L,搅拌1 h后,按体积比加入终浓度为25%的无水乙醇充分混合,4 ℃作用12 h去核酸后离心30 min后收集上清液;将上述上清液加入终浓度80%(体积分数)的无水乙醇充分混合后,4 ℃静置12 h然后离心30 min,收集得到的沉淀为粗多糖;将收集到的粗多糖用蒸馏水溶解,Sevage溶液(正丁醇 ∶氯仿=1 ∶4) ∶多糖水=1 ∶4充分混合后,9 000 r/min低温离心 10 min,分离得到清液,如此重复直至看不到中间分层的蛋白,将去蛋白的荚膜多糖液用80%(体积分数)无水乙醇沉淀 9 000 r/min 离心30 min,最后冻干得纯化的荚膜多糖抗原。
1.2.2 荚膜多糖质量检测
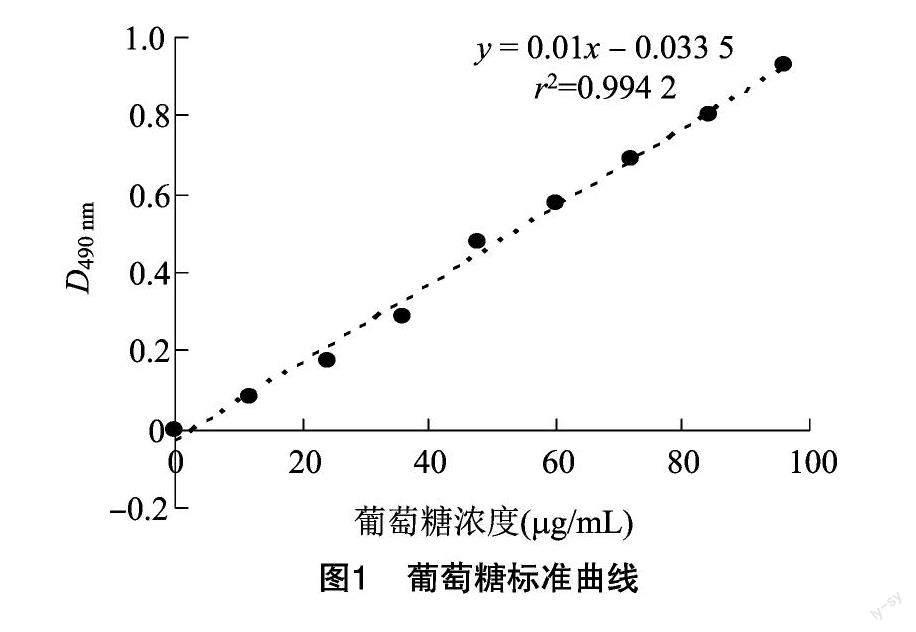
1.2.2.1 荚膜多糖含量的测定 葡萄糖标准曲线的绘制:取9个EP管,分别加入0.6 mg/mL葡萄糖标准溶液0、4.8、9.6、14.4、19.2、24、28.8、33.6、36 μL,各管中加入蒸馏水稀释到60 μL,再加入 180 μL 显色液充分混匀,做3个平行,100 ℃金属浴中加热25 min并冷却,用酶标仪测定吸光度D490 nm值并作标准曲线。多糖含量的测定:将冻干的荚膜多糖用灭菌蒸馏水进行适当稀释后取5 μL样品后加蒸馏水补至60 μL混匀后加入180 μL显色液,按苯酚-硫酸法检测样品溶液的D490 nm值后将其带入标准曲线方程后所得的浓度,再根据公式:多糖含量=0.9×C×D/m×100%,计算得出荚膜多糖中多糖含量。其中:C是指荚膜多糖样品液中单糖的浓度;m是指荚膜多糖样品液中多糖的质量;D是指荚膜多糖样品液被稀释的倍数;0.9是指把葡萄糖换算成多糖后的校正系数。
1.2.2.2 荚膜多糖中杂蛋白含量的测定 按照Bradford蛋白浓度测定试剂盒(去垢剂兼容型)操作,根据标准曲线和使用的样品体积计算出样品中的蛋白浓度。
1.2.2.3 荚膜多糖中核酸含量的测定 利用微量紫外分光光度计测定核酸浓度。
1.2.3 荚膜多糖-蛋白偶联物的制备 取荚膜多糖粉末配制成5 mg/mL的溶液,取3 mL多糖溶液与0.15 g ADH振荡混匀,再加入0.03 g EDAC振荡混匀,用1 mol/L的HCl调整pH值为5.6。室温缓慢振荡反应4 h后,将反应混合物装在透析袋4 ℃条件下,用0.2 mol/L的NaCl透析12 h,多次换液以除去ADH和EDAC。将上述衍生物加入牛血清白蛋白1 ∶1质量比,振荡混匀,用1 mol/L的HCl将混合物的pH值调节至5.6,然后再加入终浓度为0.5 mol/L的EDAC振荡混匀。用1 mol/L的HCl维持pH值,4 ℃条件下缓慢振荡反应12 h,然后将该混合物装入透析袋中,用0.2 mol/L的NaCl进行透析48 h以除去EDAC等小分子。将上述溶液装入截留分子量300 ku透析袋透析24 h以去掉游离的牛血清白蛋白,将上述溶液冻干最终得到荚膜多糖-蛋白偶联物。
1.2.4 荚膜多糖-蛋白偶联物的分析
1.2.4.1 偶联物的定性分析 用PBS分别将多糖及荚膜多糖-蛋白偶联物稀释至适宜浓度,使用紫外可见分光光度计对荚膜多糖、牛血清白蛋白以及偶联物进行全波长紫外扫描,鉴定是否偶联成功。
1.2.4.2 偶联物的SDS-PAGE分析 将荚膜多糖-蛋白偶联物与牛血清白蛋白稀释至适宜浓度,进行SDS-PAGE分析。
1.2.4.3 偶联物的定量分析 测定荚膜多糖-蛋白偶联物中的多糖含量,同时使用Bradford法对多糖蛋白偶联物中蛋白含量进行测定,计算偶联比。
1.2.5 荚膜多糖抗血清的制备
1.2.5.1 疫苗制备 根据上述测得的多糖含量,将猪链球菌2型荚膜多糖(CP2)、猪链球菌3型荚膜多糖(CP3)、猪链球菌7型荚膜多糖(CP7)和猪链球菌9型荚膜多糖(CP9)多糖偶联物进行适当稀释,分别与弗氏完全佐剂及弗氏不完全佐剂进行等体积混合,使混合物中荚膜多糖达到50 μg;将CP2、CP3、CP7和CP9多糖进行适当稀释,分别与弗氏完全佐剂及弗氏不完全佐剂进行等体积混合,使混合物中荚膜多糖达到50 μg;根据上述测得的多糖含量和牛血清白蛋白含量,将CP2、CP3、CP7和CP9多糖进行适当稀释与牛血清白蛋白混合,分别与弗氏完全佐剂及弗氏不完全佐剂进行等体积混合,使混合物中荚膜多糖达到50 μg。
1.2.5.2 小鼠免疫和采血 小鼠随机分为13组,每组5只;其中4组分别免疫CP2、CP3、CP7和CP9多糖偶联蛋白结合疫苗;4组分别免疫多糖CP2、CP3、CP7和CP9疫苗;4组分别免疫CP2、CP3、CP7和CP9多糖和牛血清白蛋白混合物;1组为对照组。首免时采用皮下免疫注射3种弗氏完全佐剂混合物,剂量为0.2 mL/只,以PBS为阴性对照;首免后14 d进行二次免疫,皮下免疫注射上述弗氏不完全佐剂混合物,剂量0.2 mL/只,阴性对照注射同样剂量的PBS;首免后28 d,將多糖质量同样为50 μg的偶联物不加任何佐剂进行腹腔注射,对照注射同样剂量PBS。分别在免疫后14、28、35 d随机对3只小鼠进行眼眶采血,三免后1周进行小鼠摘眼球采血并分离血清。
1.2.6 全菌灭活苗抗血清的制备 将猪链球菌2、3、7、9型菌种接种于THB固体培养基37 ℃培养 24 h,挑取单菌落置于5 mL THB液体培养基中振荡培养至各菌株的平台期,做菌落平板计数,同时以终浓度0.3%的甲醛37 ℃ 100 r/min灭活菌体 48 h。无菌条件下制备油苗(油相 ∶水相=2 ∶1),取乳化后的油苗滴入水中不散开则证明乳化结束,进行质量检测。4周龄BALB/C小鼠分为5组,试验组4组,每组5只小鼠,空白对照组1组,灭活苗终浓度含菌量为4×109 CFU/mL,腹腔注射 0.2 mL,在 14 d 和28 d时按同样剂量和途径加强免疫,最后一次免疫后7 d采血分离血清,-20 ℃保存。
1.2.7 间接ELISA检测抗体水平 将各多糖按照确定的最佳抗原包被浓度包被酶联板,每孔 100 μL,4 ℃过夜,用PBST洗涤4次,每次3 min,每孔加入200 μL 1%明胶封闭液,37 ℃封闭2 h,将各组待检测血清随机取3份以1 ∶100稀释,置于37 ℃孵育20 min,用PBST洗涤4次,每孔加1 ∶1 000羊抗鼠IgG-HRP 100 μL,置于37 ℃中反应20 min,洗涤4次,避光显色10 min,加入终止液,测D450 nm。
1.2.8 交叉ELISA 将上述所有分组的抗血清分别与CP2、CP3、CP7和CP9之间交叉孵育进行间接ELISA的检测。
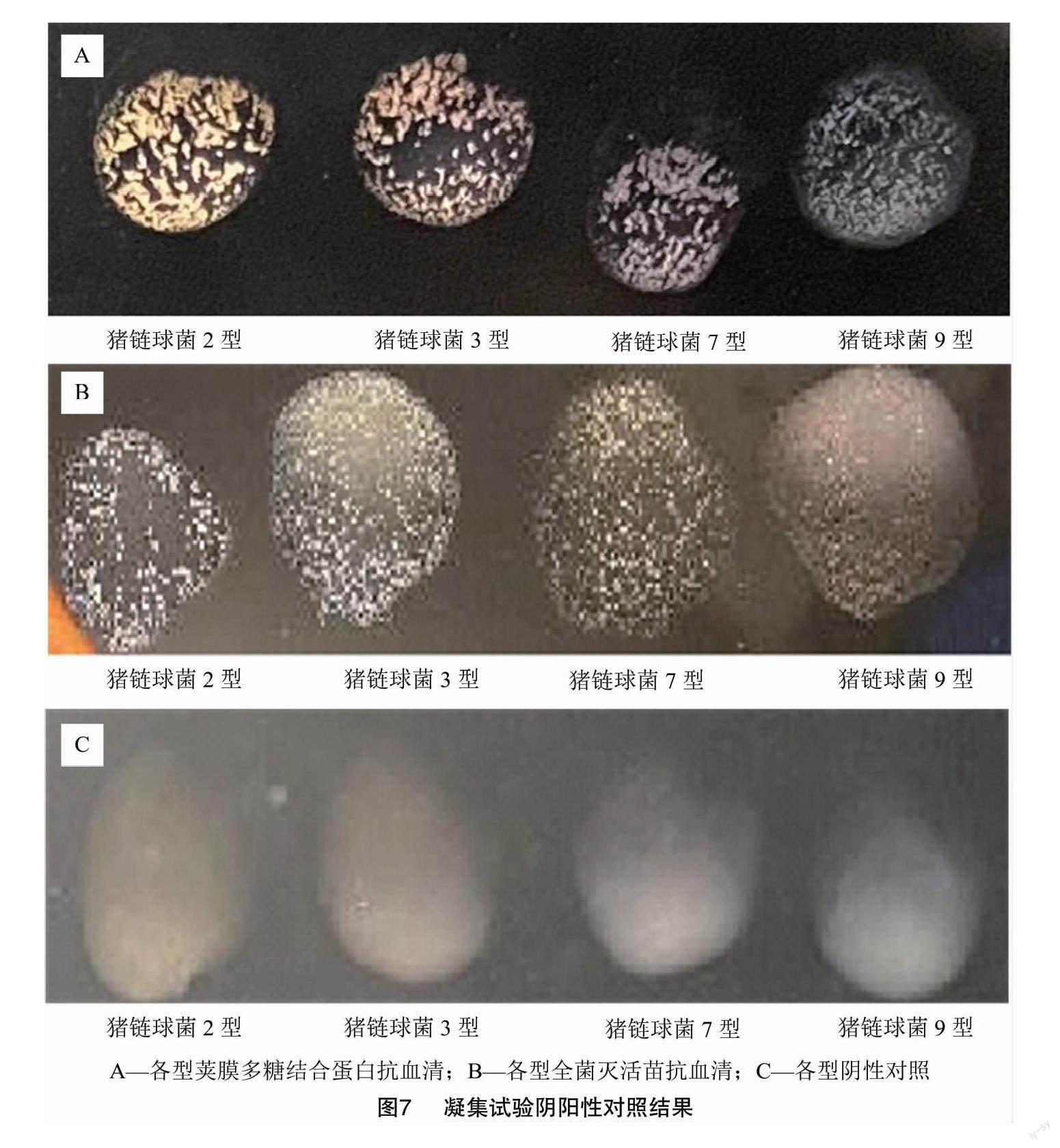
1.2.9 玻片凝集试验 将笔者所在实验室保存的猪链球菌2、3、7、9型菌种,接种于THB固体培养基上,37 ℃恒温箱培养24 h后做凝集抗原。将荚膜多糖抗血清与全菌灭活苗抗血清用生理盐水稀释2、4、8倍后取10 μL于载玻片上,用接种环蘸取各型菌株放入血清中涂匀,阴性小鼠血清做对照,2~5 min 观察有无凝集,每组做3个技术重复。按照最佳稀释度的抗血清取10 μL于载玻片上,用接种环蘸取猪链球菌4、5、6、11、12、13、15、16、17、18、20、21、24、25、26、27、28、29、30、31、33型做玻片凝集試验,每组做3个技术重复。采用2、3、7、9型荚膜多糖抗血清以及全菌灭活苗抗血清鉴定各型菌株放入血清中涂匀,阴性小鼠血清做对照,2~5 min观察有无凝集,每组做3个技术重复。
2 结果与分析
2.1 荚膜多糖质量检测
2.1.1 荚膜多糖含量的测定 由图1可见,线性回归方程为:y=0.01x-0.033 5,r2=0.994 2。根据公式:多糖含量=0.9×C×D/m×100%,计算得出猪链球菌2、3、7、9型中荚膜多糖含量分别为70.1%、72%、80.1%、76.7%。
2.1.2 荚膜多糖中蛋白含量的测定 按照Bradford蛋白浓度测定试剂盒(去垢剂兼容型)操作,结果如图2所示。线性回归方程为:y=0.640 5x+1.162 7,r2=0.995 2。即提取的猪链球菌2、3、7、9型荚膜多糖中杂蛋白的浓度各为0.01、0.005、0.012、0.011 mg/mL。
2.1.3 荚膜多糖中核酸含量的测定 提取的猪链球菌2、3、7、9型荚膜多糖中核酸的浓度各为0.018、0.04、0.02、0.011 mg/mL。
2.2 荚膜多糖-蛋白偶联物的分析
2.2.1 偶联物的定性分析 用紫外光分光光度计200~400 nm对CP2、CP2-牛血清白蛋白偶联物、牛血清白蛋白扫描,结果如图3所示,CP2-BSA从 200 nm 向210 nm偏移,符合偶联物的特征。其他3种荚膜多糖-蛋白偶联物与CP2相似。
2.2.2 偶联物的SDS-PAGE分析 牛血清白蛋白的分子量为66 ku,一般多糖的分子质量在400~600 ku之间,SDS-PAGE结果如图4所示,可看到4种偶联物基本都分布在胶孔处,与牛血清白蛋白相比,4种偶联物分子大小显著增加,符合偶联物的特征。
2.2.3 偶联物的定量分析 对荚膜多糖蛋白结合
物中的多糖含量进行测定,同时使用 Lowry法对荚膜多糖蛋白结合物中牛血清白蛋白含量进行测定,偶联比结果见表1。
2.2.4 间接ELISA检测抗体水平
2.2.4.1 多糖结合蛋白抗血清ELISA检测抗体IgG水平 试验结果(图5)显示,只有荚膜多糖结合蛋白苗抗血清D450 nm可以达到2左右,单独的荚膜多糖组以及荚膜多糖与牛血清白蛋白混合组均不能引起IgG抗体的产生。
2.2.4.2 全菌灭活苗抗血清ELISA检测抗体IgG水平 全菌灭活苗抗血清D450 nm接近1(图6)。
2.2.5 交叉ELISA 将上述制备的抗血清进行交叉ELISA,结果显示猪链球菌3型全菌灭活苗的抗血清与CP7存在交叉反应,而荚膜多糖抗血清均无反应,特异性好(表2、表3)。
2.2.6 玻片凝集试验鉴定猪链球菌血清型 荚膜多糖结合蛋白抗血清稀释至2倍、全菌灭活苗抗血清原液不稀释,与不同猪链球菌进行玻片凝集试验。结果(图7)显示,各型荚膜多糖结合蛋白抗血清以及全菌灭活苗抗血清分别与各型凝集原之间发生强凝集反应,阴性对照血清无凝集。2、3、7、9型荚膜多糖结合蛋白抗血清针对4、5、6、11、12、13、15、16、17、18、20、21、24、25、26、27、28、29、30、31、33型菌株无凝集;21型猪链球菌与2、7、9型全菌灭活苗抗血清有少量凝集,29型猪链球菌与2、3、9型全菌灭活苗抗血清有少量凝集,30、31、33型菌株与SS3全菌灭活苗抗血清有少量凝集;30、31型菌株与SS7全菌灭活苗抗血清有少量凝集(图8)。表明各型荚膜多糖结合蛋白抗血清特异性好,而全菌灭活苗抗血清会有不同程度的交叉反应。
3 讨论
荚膜多糖结合蛋白疫苗对荚膜多糖的质量要求很高,需要将杂蛋白以及核酸去除,核酸去除方法包括乙醇沉淀法、酶解法、CTAB沉淀法和活性炭吸附法等,蛋白去除方法有酸沉淀法、苯酚抽提法、Sevage法、酶解法、脱氧胆酸钠法等[14]。张紫恒等发现采用静置法培养菌株多糖产量高[15],故本研究采用静置法37 ℃培养15 h后通过蛋白酶K初步去除蛋白、使用乙醇分级沉淀法有效去除核酸之后Sevage法进一步去除蛋白,成功提取纯化了猪链球菌2、3、7、9型荚膜多糖,且荚膜多糖杂蛋白浓度均小于0.01 mg/mL,核酸浓度均小于0.04 mg/mL,表明纯化后的荚膜多糖中仅有微量核酸残留,几乎没有蛋白残留。该提取步骤成本低、流程简单,为猪链球菌荚膜多糖提取纯化工艺线性放大、工业化生产提供了试验数据。Goyette-Desjardins G等通过还原氨基化法将猪链球菌2型CPS与破伤风类毒素偶联制备了荚膜多糖结合蛋白疫苗并在猪体内评估了偶联后疫苗的免疫学特性,与灭活苗比较保护率相差无几[16]。周琪等利用己二酸二酰肼(ADH)间桥法制备了副猪嗜血杆菌荚膜多糖抗血清,可用于菌种及菌株检测等[17]。本试验采用己二酸二酰肼(ADH)间桥法制备了CPS-BSA,将荚膜多糖用作包被抗原采用间接ELISA对小鼠血清抗体进行检测分析,试验结果表明单纯的荚膜多糖以及荚膜多糖与牛血清白蛋白混合后接种小鼠均不能激活免疫系统产生IgG,而与牛血清白蛋白偶联后的油乳剂疫苗接种小鼠后产生了具有特异性的多糖抗体。之后采用全菌灭活苗抗血清与荚膜多糖偶联蛋白苗抗血清进行比较,结果发现全菌灭活苗抗血清与其他猪链球菌血清型有交叉,可能是由于菌体中有共同抗原导致,而荚膜多糖偶联蛋白苗抗血清与猪链球菌4、5、6、11、12、13、15、16、17、18、20、21、24、25、26、27、28、29、30、31、33型均无反应,特异性好,符合绝大多数血清使用要求,可用于养殖场、实验室等菌种及菌株检测与血清型鉴定,且对其他多种含荚膜多糖的细菌抗血清制备提供了参考。
参考文献:
[1]杨艳北,许 晶,沈城辉,等. 低浓度红霉素对猪链球菌蛋白表达、交叉耐药性与荚膜多糖的影响[J]. 微生物学报,2022,62(5):1843-1850.
[2]Cucco L,Paniccià M,Massacci F R,et al. New sequence types and antimicrobial drug-resistant strains of Streptococcus suis in diseased pigs,italy,2017—2019[J]. Emerg Infect Dis,2022,28(1):139-147.
[3]Kataoka Y,Yamashita T,Sunaga S,et al. An enzyme-linked immunosorbent assay (ELISA) for the detection of antibody against Streptococcus suis type 2 in infected pigs[J]. J Vet Med Sci,1996,58(4):369-372.
[4]Hlebowicz M,Jakubowski P,Smiatacz T. Streptococcus suis meningitis:epidemiology,clinical presentation and treatment[J]. Vector Borne Zoonotic Dis,2019,19(8):557-562.
[5]Haas B,Grenier D. Understanding the virulence of Streptococcus suis:a veterinary,medical,and economic challenge[J]. Med Mal Infect,2018,48(3):159-166.
[6]Dutkiewicz J,Zajc V,Sroka J,et al. Streptococcus suis:a re-emerging pathogen associated with occupational exposure to pigs or pork products. Part Ⅱ-Pathogenesis[J]. Ann Agric Environ Med,2018,25(1):186-203.
[7]Oh S I,Jeon A B,Jung B Y,et al. Capsular serotypes,virulence-associated genes and antimicrobial susceptibility of Streptococcus suis isolates from pigs in Korea[J]. J Vet Med Sci,2017,79(4):780-787.
[8]Feng Y,Zhang H,Wu Z,et al. Streptococcus suis infection:an emerging/reemerging challenge of bacterial infectious diseases?[J]. Virulence,2014,5(4):477-497.
[9]Obradovic M R,Segura M,Segalés J,et al. Review of the speculative role of co-infections in Streptococcus suis-associated diseases in pigs[J]. Vet Res,2021,52(1):49.
[10]WangQ,ZhouH,LinH,etal.Porcine circovirus type 2 exploits
JNK-mediated disruption of tight junctions to facilitate Streptococcus suis translocation across the tracheal epithelium[J]. Vet Res,2020,51(1):31.
[11]楊学云,吴建勇,李建军,等. 金黄色葡萄球菌5型荚膜多糖偶联抗原的制备及免疫原性分析[J]. 中国兽医科学,2012,42(3):299-303.
[12]谢黎卿,杨 洋,彭远义,等. 病原微生物荚膜多糖的生物学功能[J]. 畜牧兽医学报,2021,52(3):576-587.
[13]潘志忠. 金黄色葡萄球菌荚膜多糖完全抗原的制备、鉴定及免疫学研究[D]. 长春:吉林大学,2007:27-31.
[14]宗克强,罗树权,谭小梅. 肺炎链球菌荚膜多糖纯化及质量控制方法的研究现状[J]. 微生物学免疫学进展,2021,49(3):82-87.
[15]张紫恒. 不同血清分型链球菌荚膜多糖的提取分离与结构组成初步分析[D]. 青岛:中国海洋大学,2011:36-37.
[16]Goyette-Desjardins G,Calzas C,Shiao T C,et al. Protection against Streptococcus suis serotype 2 Infection using a capsular polysaccharide glycoconjugate vaccine[J]. Infect Immun,2016,84(7):2059-2075.
[17]周 琪,贺现辉,杜雅萍,等. 副猪嗜血杆菌SC096株荚膜多糖及其抗血清的制备[J]. 中国畜牧兽医,2014,41(12):81-84.
