致病疫霉酵母双杂交cDNA文库的构建及鉴定
2023-08-14陈泓妃顾赛汝王洪洋李灿辉刘晶
陈泓妃 顾赛汝 王洪洋 李灿辉 刘晶
摘要:致病疫霉是引起马铃薯晚疫病的重要病原菌,在全世界范围内造成了严重的经济损失。以2种不同致病力的致病疫霉菌株侵染马铃薯叶片5个时间点的混合菌丝样品作为cDNA文库的材料来源,利用Gateway法分别构建了初级文库与次级文库,初级文库与次级文库的库容量分别为1.60×107、1.52×107 CFU,插入片段长度大多在 1 000~2 000 bp之间,重组率均达到100%。次级文库质粒转化酵母菌构建酵母文库,所得酵母文库滴度为1.00×108 CFU/mL,转化效率为6×108 CFU/μg。结果表明,本研究构建的酵母双杂交cDNA文库质量较高,完全可以满足互作蛋白高质量、高效率筛选的要求。该文库为后续深入解析致病疫霉的致病机制奠定了基础。
关键词:致病疫霉;马铃薯;酵母双杂交;cDNA文库
中图分类号:S435.32 文献标志码:A
文章编号:1002-1302(2023)13-0060-05
致病疫霉(Phytophthora infestans)属于腐霉科(Pyhiaceae)疫霉属(Phytophthora),是引起世界范围内马铃薯晚疫病的重要病原卵菌[1]。19世纪中期,马铃薯晚疫病在爱尔兰大暴发并引起饥荒,数百万人因此丧命或流亡他国[2]。如今,晚疫病仍是马铃薯生产上的重要病害,全球每年因马铃薯晚疫病导致的经济损失高达数十亿欧元[3]。目前,我国马铃薯种植面积位居世界第一,但马铃薯晚疫病在我国各马铃薯主产区长期流行,严重制约了我国马铃薯产业的发展,持续有效的防治措施仍有待挖掘[4-5]。因此,深入解析致病疫霉的致病机制对于后续开发新的杀菌剂作用靶标以及培育新的抗晚疫病马铃薯品种至关重要。
酵母双杂交系统(yeast two-hybrid system)是研究蛋白与蛋白间的互作、筛选与已知蛋白互作的未知蛋白的常用方法[6]。该系统最早由Fields和Song在研究真核生物的基因转录调控功能时提出并建立的,具有速度快、效率高、成本低等优点,可用于微生物及动植物体中互作蛋白的研究[7]。该系统依赖于酵母转录因子GAL4的特性,GAL4拥有2个典型的转录因子结构域:DNA结合结构域(DNA binding domain,简称BD)和转录激活结构域(activation domain,简称AD),BD能够结合GAL1启动子区的DNA序列,AD能够激活转录[8]。将2个目的基因分别连接到含BD和AD序列的表达载体中,使BD和AD序列分别与2个目的基因的开放阅读框(ORF)融合,随后将重组载体转入相应酵母菌株使目的基因在酵母细胞中表达;若目的基因表达的蛋白之间发生互作,则GAL4转录因子的BD和AD也随之相互靠近并结合,GAL4随即发挥其转录因子功能,与上游激活序列结合后激活报告基因的表达[9]。根据上述原理,筛选酵母cDNA文库可知晓与已知蛋白互作的未知蛋白。将已知蛋白的编码基因连接到BD表达载体上,作为“诱饵”载体。将待筛选物种的cDNA文库中不同的插入片段连接到AD表达载体上,作为“猎物”载体。随后,“诱饵”载体与“猎物”载体转化酵母细胞。若一个酵母细胞中同时表达的“诱饵”蛋白与“猎物”蛋白发生互作,则报告基因被激活,通过提取该酵母细胞质粒,利用测序手段获得与已知蛋白互作的基因序列。
构建高质量的酵母双杂交cDNA文库是成功筛选未知互作蛋白的关键。目前,病原菌侵染植物后构建酵母双杂交文库已有不少报道,包括马铃薯、茄子、花生、辣椒、番茄、棉花、拟南芥等[10-16]。这些文库都是以病原菌侵染后的植物材料作为来源,提取RNA后反转录成cDNA最终构建酵母双杂交文库,而以侵染植物后的病原菌作为来源构建酵母双杂交文库的案例较少。因此,本研究以侵染马铃薯不同時间的致病疫霉作为材料来源构建酵母双杂交cDNA文库,为后续筛选互作蛋白、研究致病疫霉的致病机制奠定基础。
1 材料与方法
1.1 试验材料
马铃薯二倍体野生种感病材料C9701 (Solanum chacoense)于2022年3月种植于云南师范大学马铃薯科学研究院恒温气候室(温度为 22 ℃,光照/黑暗周期为16 h/8 h)中,生长6周后使用。致病疫霉菌株88069 (1.3.4.7) (中低毒力菌株)及HB09-14-2 (1.2.3.4.5.6.7.8.9.10.11) (强毒力菌株) 接种于黑麦-V8培养基上并在 18 ℃ 黑暗条件下培养7 d后,用手术刀切取大小约为 0.5 cm×0.5 cm的菌块放置于青豆汁培养液中静置培养3.5 d后收获菌丝,备用。大肠杆菌菌株DH10B,酵母菌株Y187,载体pDONR222j及pGADT7-DEST均由笔者所在实验室保存提供。
1.2 主要试剂及试剂盒
FastTrack MAG mRNA纯化试剂盒及CloneMinerTM II cDNA 文库构建试剂盒购自Invitrogen公司,Trizol、SD-Leu购自TAKARA公司,质粒提取试剂盒购自OMEGA公司,鲑鱼精DNA、PEG/LiAc、DMSO等试剂购自Sigma公司。
1.3 总RNA的提取及mRNA分离纯化
将收集的致病疫霉菌丝均匀放置于马铃薯叶片上,随后在菌丝上再覆盖1层叶片并放置于托盘中,18 ℃保湿培养。取侵染马铃薯叶片0、12、24、48、72 h的致病疫霉菌丝等量混合后,分别用液氮迅速研磨成粉末后用Trizol提取法提取菌丝总RNA。利用1%琼脂糖凝胶电泳检测RNA的完整性,利用FastTrack MAG mRNA纯化试剂盒纯化mRNA。
1.4 cDNA文库的构建
随后参照CloneMinerTM Ⅱ cDNA 文库构建试剂盒说明书合成cDNA第1链及第2链(Gateway法)。将cDNA与重组接头连接后分级分离并收集,通过BP重组反应将收集的cDNA片段连接到载体pDONR222上。随后利用电转法将上述重组产物转化到大肠杆菌感受态细胞DH10B中(1.5 kV,200 Ω,25 μF)。在37 ℃,225~250 r/min条件下培养1 h后,取部分菌液涂布平板用于文库容量鉴定,剩余菌液加入甘油至终浓度20%并保存于-80 ℃冰箱,得到初级文库菌液。初级文库质量鉴定合格后,将初级文库菌液扩大培养并抽提质粒,利用LR重组反应将所得质粒与pGADT7-DEST进行重组,再将重组产物电转化到大肠杆菌感受态细胞DH10B中。同制备初级文库菌液相似,转化后的DH10B在摇床培养 1 h后,取部分菌液涂布平板用于文库容量鉴定,剩余菌液加入甘油至甘油终浓度为20%并保存于-80 ℃冰箱,得到次级文库菌液。
1.5 cDNA文库的质量鉴定
1.5.1 文库容量鉴定 分别取初级文库菌液及次级文库菌液10 μL,用无菌水稀释100倍后分别取50 μL涂布于含50 mg/L卡那霉素(Kan)及50 mg/L氨苄霉素(Amp)的 LB固体培养基平板上,过夜培养后统计菌落数并计算文库容量。文库滴度(CFU/mL)=平板菌落数/涂板体积×稀释倍数。文库容量(CFU)=文库滴度×文库菌液总体积。
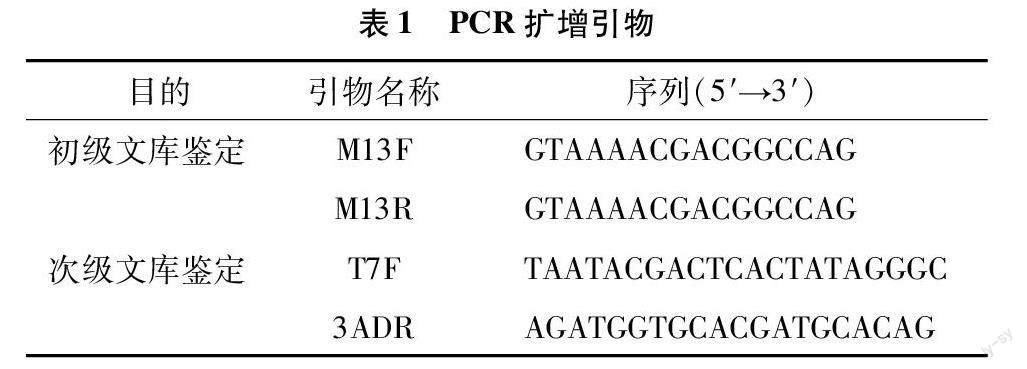
1.5.2 重组率及插入片段长度鉴定 从“1.5.1”节中的初级文库及次级文库菌液培养平板上分别随机挑取24个单克隆进行菌落PCR鉴定。初级文库及次级文库鉴定所用引物对分别为M13F/M13R及T7F/3ADR,鉴定引物序列见表1 (由北京擎科生物科技有限公司合成)。PCR 反应条件:95 ℃预变性 5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 3 min,30个循环;72 ℃充分延伸5 min后4 ℃保存。随后利用1%琼脂糖凝胶电泳检测扩增产物,统计文库重组率及插入片段长度。
1.6 次级文库质粒转化酵母感受态细胞
利用PEG /LiAc转化法将次级文库质粒转化酵母感受态细胞Y187。取上述质量鉴定合格的次级文库质粒5 μg与20 μL变性鲑鱼精DNA在离心管中充分混匀,随后加入600 μL酵母感受态细胞Y187,轻柔振荡混匀后加入2.5 mL PEG/LiAc溶液并再次混匀。将混合液置于30 ℃水浴45 min,期间颠倒混匀数次。随后向混合液中加入160 μL二甲基亚砜(DMSO),混匀后置于42 ℃水浴20 min,其间颠倒混匀数次。室温700 g离心5 min,弃上清并用30 mL 0.9% NaCl重新悬浮细胞,立即将菌液均匀涂布于100个SD-Leu平板上,30 ℃倒置培养 3~6 d。为检测酵母文库滴度,需同时将上述重悬后的细胞按1 ∶10、1 ∶100、1 ∶1 000、1 ∶10 000的比例稀释后涂布于SD-Leu平板,每个平板均匀涂布100 μL菌液,待平板上长出菌落后统计菌落数量并计算酵母文库滴度及酵母文库转化效率。酵母文库转化效率(CFU/μg)=(平板菌落数×悬浮液体积×稀释倍数)/(涂布菌液体积×转化DNA量)。
从转化涂布后的平板上随机挑取24个单克隆进行菌落PCR鉴定。随后将平板置于4 ℃冷却3~4 h,向每个平板中加入5 mL YPDA培养基溶液(含30%甘油),用无菌玻璃涂棒均匀刮下所有酵母菌落,计算酵母细胞总数,收集并分装酵母双杂交文库菌液,-80 ℃保存备用。
2 结果与分析
2.1 总RNA的提取、mRNA的分离及dscDNA的合成
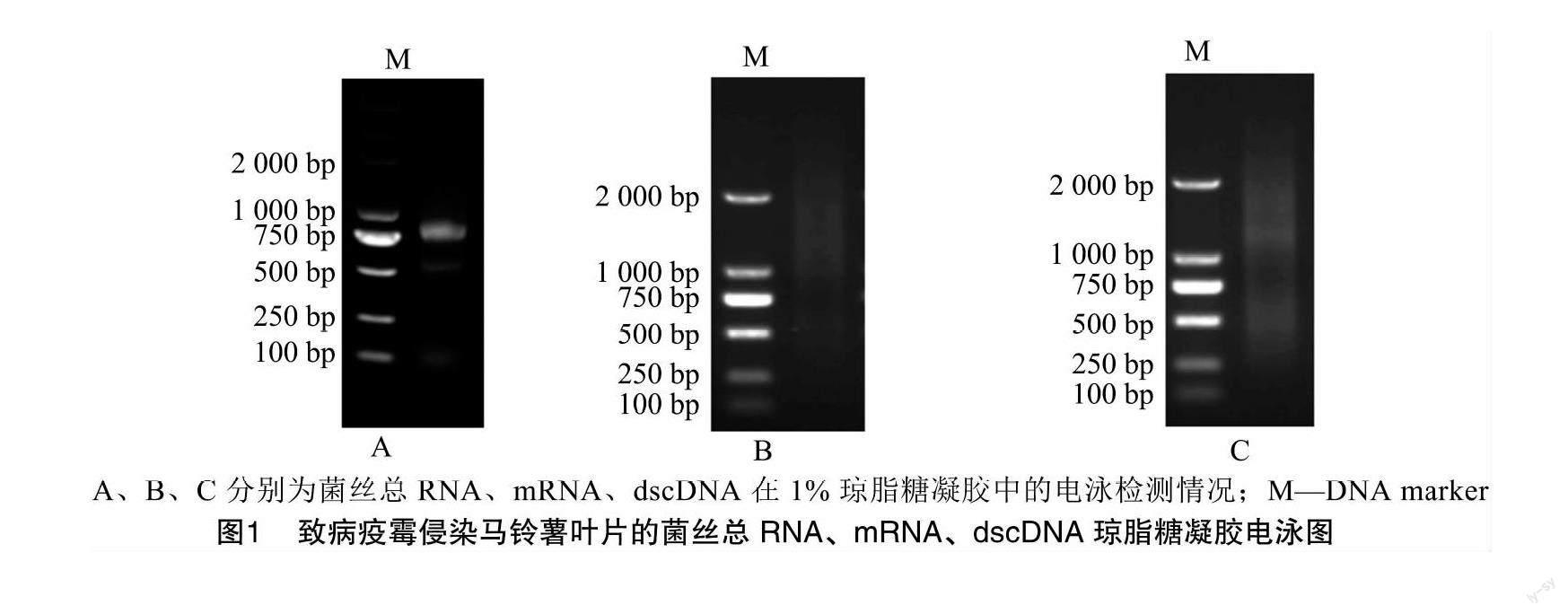
提取致病疫霉侵染马铃薯叶片不同时期菌丝混合样品的总RNA,用1%琼脂糖凝胶电泳检测提取的总RNA质量是否合格。结果如图1-A所示,琼脂糖凝胶电泳后28S rRNA及18S rRNA条带清晰且无拖尾现象,说明RNA未发生降解,可用于后续mRNA的分离纯化。用NanoDrop核酸蛋白分析仪检测总RNA浓度为0.97 μg/μL,D260 nm/D280 nm为2.26,D260 nm/D230 nm为1.74。上述结果均表明,致病疫霉侵染马铃薯叶片不同时期菌丝混合样品的总RNA质量较高。使用純化试剂盒分离纯化mRNA,琼脂糖凝胶电泳结果显示分离纯化后的mRNA呈弥散状,条带均匀分布在500~2 500 bp之间(图1-B),说明分离的mRNA质量较高。随后,根据文库构建试剂盒说明书合成双链互补DNA (dscDNA)并进行均一化处理,如图1-C所示,dscDNA呈现出均匀的弥散条带,条带大小为500~2 500 bp,说明制备的dscDNA包含了不同大小和丰度的基因,可用于后续文库的构建。
2.2 cDNA初级文库的构建及鉴定
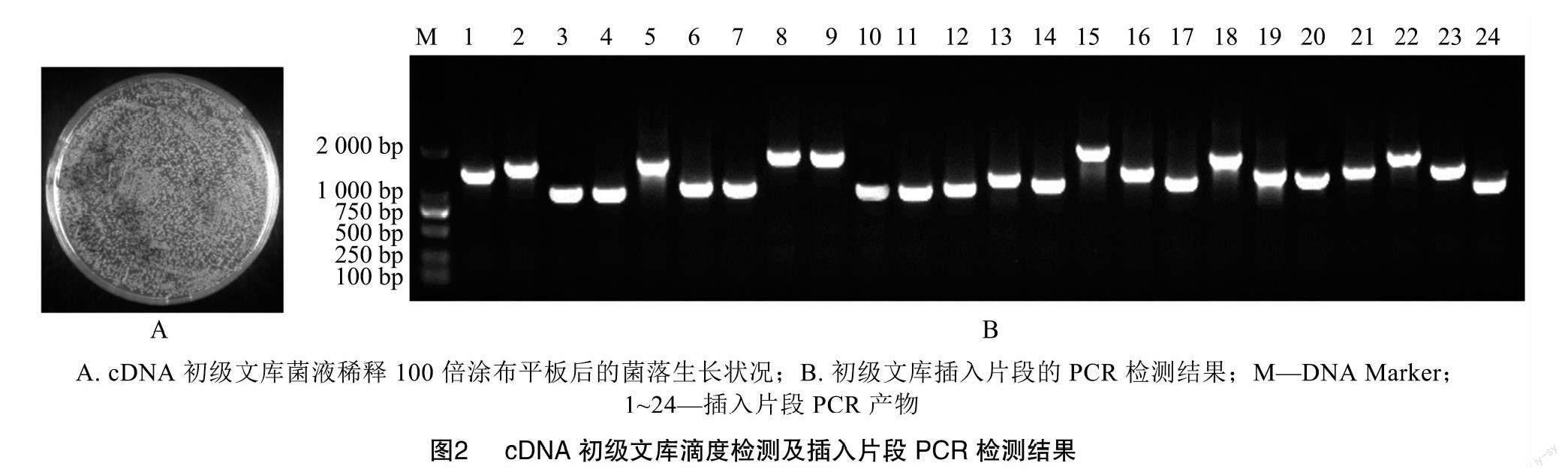
cDNA与重组接头连接后,利用BP重组反应将cDNA片段连接到文库载体pDONR222上。随后,通过电转化法将重组质粒导入大肠杆菌DH10B中,将上述菌液涂布到平板上并进行菌落计数(图2-A)。统计结果表明,初级文库滴度为4.00×106 CFU/mL,转化后的菌液体积为4 mL,因此初级文库容量为1.60×107 CFU。从上述转化涂布后的平板上随机挑取24个单克隆菌落进行PCR鉴定,结果如图2-B所示,所有挑取的单克隆均扩增出条带,条带大小在1 000~2 000 bp之间。说明致病疫霉cDNA片段成功插入初级文库载体,重组率为100%。
2.3 cDNA次级文库的构建及鉴定
提取cDNA初级文库质粒,利用LR重组反应将初级文库质粒与次级文库载体pGADT7-DEST进行重组,将重组产物转化到大肠杆菌DH10B中,涂布平板并进行菌落计数(图3-A)。结果表明,次级文库滴度为3.80×106 CFU/mL,次级文库容量为1.52×107 CFU。随机挑取上述转化平板上的24个单克隆菌落进行PCR鉴定,所有单克隆都能扩增出清晰条带,条带大小大多在 1 000~2 000 bp 之间(图3-B),重组率为100%。上述结果表明,本研究所构建的cDNA次级文库容量较大、质量较高,完全可以满足酵母双杂交筛选互作蛋白的要求。
2.4 cDNA次级文库质粒转化酵母感受态细胞
提取cDNA次级文库质粒并转化酵母感受态细胞Y187,制备酵母双杂交文库菌液。统计平板上的酵母菌落数并计算得出酵母文库滴度为1.00×108 CFU/mL (图4-A),酵母文库转化效率为6×108 CFU/μg。随机挑取24个酵母单克隆菌落进行PCR鉴定,琼脂糖凝胶电泳结果表明,所有单克隆都能扩增出1条清晰的条带,条带大小大多在 750~2 000 bp之间(图4-B)。综上,酵母文库转化效率较高,酵母文库菌液覆盖了全部的次级文库质粒,酵母文库质量较高,可用于后续互作蛋白的筛选。
3 讨论与结论
由致病疫霉引起的马铃薯晚疫病是引起马铃薯减产的主要原因。深入探究致病疫霉的致病机制并在此基础上选育抗病马铃薯新品种是防治马铃薯晚疫病的根本措施。全面解析致病疫霉的致病性相关基因的功能,探究这些基因通过何种机制促使马铃薯感病显得尤为重要。蛋白质是基因编码的产物也是基因功能的具体执行者,大多数蛋白需要通过与其他蛋白相互作用来发挥其功能[13]。目前,常用来研究蛋白间相互作用关系的试验技术为酵母双杂交技术,该技术具有成本低廉且高效快捷的优点,被广泛用于分析2个已知蛋白间的相互作用,或者用已知蛋白作为“诱饵”来钓取能够与之结合的未知蛋白。
目前,以侵染植物后的病原菌作为材料来源提取RNA并构建酵母双杂交文库的相关报道较少。本研究选取2种不同致病力的致病疫霉菌株侵染马铃薯叶片5个时间点的菌丝样品作为cDNA文库的材料来源,可以准确反应致病疫霉侵染马铃薯时其致病性相关基因受到激发的真实表达情况,在确保文库构建的完整性的同时,也保证了文库的代表性。构建高质量的酵母双杂交cDNA文库对于后续筛选互作蛋白至关重要,cDNA文库的质量直接影响了互作蛋白的筛选效率[15]。本研究采用Gateway法利用特异性重组技术构建文库,最大程度避免了低丰度基因克隆的丢失;为降低高丰度基因对文库质量造成的负面影响,本研究对dscDNA进行了均一化处理,提高了后续酵母文库筛选的效率。从初级文库及次级文库的鉴定结果来看,本研究得到的初级文库容量为1.60×107 CFU,重组率为100%;次级文库容量为1.52×107 CFU,重组率为100%;初级文库及次级文库插入片段的长度大多在 1 000~2 000 bp 之间,包含了相当一部分全长cDNA序列。用次级文库质粒转化酵母感受态细胞,最终得到酵母文库菌液,该酵母文库滴度为1.00×108 CFU/mL,转化效率为6×108 CFU/μg。以上结果均说明,本研究所构建的致病疫霉酵母双杂交cDNA文库质量较高,理论上利用此文库能够筛选出与诱饵蛋白相互作用的所有未知蛋白,这将为后续深入研究致病疫霉致病相关基因及其致病机制奠定基础。
参考文献:
[1]郑小波. 疫霉菌及其研究技术[M]. 北京:中国农业出版社,1997.
[2]Fry W E,McGrath M T,Seaman A,et al. The 2009 late blight pandemic in the eastern United States-causes and results[J]. Plant Disease,2013,97(3):296-306.
[3]Haverkort A J,Boonekamp P M,Hutten R,et al. Durable late blight resistance in potato through dynamic varieties obtained by cisgenesis:scientific and societal advances in the DuRPh project[J]. Potato Research,2016,59(1):35-66.
[4]张欣杰,宋文睿,陈 汉,等. 马铃薯晚疫病化学防控现状与展望[J]. 中国植保导刊,2021,41(6):33-39.
[5]程海洋,魏有海,郭良芝,等. 马铃薯晚疫病生防细菌的筛选及鉴定[J]. 江苏农业科学,2021,49(18):116-121.
[6]王 婷,葛怀娜,郭 宏. 酵母双杂交技术应用进展[J]. 生物技术进展,2015,5(5):392-396.
[7]Fields S,Song O. A novel genetic system to detect protein-protein interactions[J]. Nature,1989,340(6230):245-246.
[8]朱玉贤,李 毅,郑晓峰.现代分子生物学[M]. 5版.北京:高等教育出版社,2019.
[9]Yu D S,Liao L B,Zhang J,et al. A novel,easy and rapid method for constructing yeast two-hybrid vectors using in-fusion technology[J]. BioTechniques,2018,64(5):219-224.
[10]韦 吉,栾宏瑛,王荟洁,等. 致病疫霉诱导的马铃薯酵母双杂交文库构建及无毒蛋白PiAVR3b寄主靶标筛选[J]. 植物保护,2022,48(4):114-122,130.
[11]肖熙鸥,林文秋,李 威,等. 感染青枯病病原菌 R. solanacearum的茄子酵母双杂交文库构建及评价[J]. 北方园艺,2016,21:102-105.
[12]陈玉婷,刘 露,楚盼盼,等. 受青枯菌诱导的花生根酵母双杂交文库构建和AhRRS5互作蛋白的筛选[J]. 作物学报,2021,47(11):2134-2146.
[13]王玉姣,陈姗姗,孙柏华,等. 辣椒疫霉菌诱导辣椒酵母双杂交cDNA文库的构建及鉴定[J]. 山东农业大学学报(自然科学版),2018,49(3):379-382.
[14]白圣懿. 番茄SlMLO4互作蛋白的篩选与初步验证[D]. 银川:宁夏大学,2022.
[15]许 艳,李 冉,宋 健,等. 大丽轮枝菌及激素处理后棉花酵母双杂交文库的构建[J]. 植物保护,2021,47(2):46-55.
[16]汪 俭,李 敏,张 鹏,等. 辣椒疫霉侵染拟南芥的酵母双杂交cDNA文库构建及其应用[J]. 植物病理学报,2017,47(3):416-421.
