水杨酸调控乙烯反应因子提高雏菊切花保鲜效果
2023-08-14陈星星张治平
陈星星 张治平

摘要:乙烯反应因子(ERFs)是植物特有的转录因子,在乙烯释放、胁迫防御等生理生化反应中发挥重要作用。然而关于雏菊(Bellis perennis L.)ERF基因家族的组成特征及其在切花过程中的功能作用知之甚少。结果表明,在雏菊共鉴定出7个乙烯反应因子(BpERF),其蛋白质长度110~329 aa,相对分子量2.61~5.25 ku,等电点4.72~8.36。系统发育和蛋白质序列比对结果表明,这7个BpERF可分为3个亚家族(ERF-a、ERF-b和ERF-c)并具有AP2保守结构域和YRG、RAYD等保守序列。基因结构和启动子分析表明,BpERF的启动子中含有许多细胞分化和植物激素相关的顺式元件,其中ERF-c亚家族的BpERF005同时含有衰亡顺式作用元件和水杨酸响应元件,表明BpERF005在切花保鲜中可能响应水杨酸(SA)的施用。转录组分析(RNA-Seq)表明,BpERF005在SA处理下转录水平明显降低,qRT-PCR结果与RNA-Seq结果高度一致;此外,SA处理下,BpERF005在花序中的表达模式与乙烯排放速率呈显著(P=0.024 9<0.05)线性正相关关系,表明BpERF005是SA调控雏菊乙烯合成的指示基因,且施用SA显著增加了雏菊切花的瓶插寿命。综上,水杨酸可通过抑制雏菊切花过程中乙烯反应因子(BpERF005)的转录表达,从而降低乙烯排放速率以延长雏菊切花的瓶插寿命。
关键词:雏菊;瓶插寿命;水杨酸;乙烯反应因子;全基因组;基因表达水平
中图分类号:S682.1+10.9+3 文獻标志码:A
文章编号:1002-1302(2023)13-0041-08
雏菊(Bellis perennis L.)是世界花卉贸易中最具商业价值的观赏花卉之一,由于其花色艳丽、花姿优美、花型洋溢大方而广受市场追捧[1]。然而,雏菊品种因花朵面积较宽,蒸腾失水量大造成花瓣散乱等现象而不耐插切花,且当其浸在花瓶溶液时,茎端处易被微生物附生污染,使得瓶插寿命进一步缩短[2]。采后导致衰老进程加快是影响切花适销性的关键因素,引起采后衰老的关键因素包括碳水化合物消耗严重、呼吸速率升高、茎部微生物附生积水、花序失水、活性氧累积、抗氧化系统活性降低及乙烯(ET)产量增加[3],其中花朵的衰老与乙烯释放速率、单位产量密切相关,衰老速率对乙烯合成高度敏感并受乙烯转导通路调控[4]。
在植物体中,乙烯的生物学功能通过乙烯信号转导途径实现,乙烯反应因子(ERF)作为乙烯信号转导通路中最重要的元件,在乙烯的生物合成及功能表达中起着至关重要的作用[5]。ERF位于乙烯信号通路下游,是典型的植物特异性转录因子,同时也是植物AP2/ERF超家族的重要成员,参与植物生理生化和非生物胁迫反应[6]。AP2/ERF家族成员的特征是存在一个AP2-DNA结合域,该结构域可与下游启动子区域的-GCC-盒、DRE或C-重复序列的顺式元件相互作用从而直接或间接作用于靶向基因,根据AP2-DNA结合域的数量和基序相似性,ERF家族可分为5个亚家族[7]。近几十年来,从植物中分离和克隆了许多ERF基因,这些基因参与调控生物体生理发育、细胞增殖、胁迫反应和激素合成,但有研究表明,并不是所有的ERF皆作用于乙烯的生物合成,有些ERF可能对植物相关生理途径无任何功能[8],目前关于菊花ERF的组成及功能鲜有研究涉及。
水杨酸(SA)是一种广泛存在于植物中的酚类化合物,是被广泛使用的植物生长调节剂。在高等植物中,SA通过莽草酸循环的苯丙氨酸途径和异分支酸途径合成,苯丙氨酸途径在细胞质中起作用,而异分支酸途径在叶绿体中表达[9]。SA可介导植物的防御反应并调节多种生理过程,如种子发芽、激活免疫系统、开花和衰老[10]。近年来,由于SA在水果和蔬菜采后质量保持方面表现出良好效果,受到了越来越多的关注。据报道,SA可通过抑制乙烯前体物的转化以介导乙烯的生物合成,从而影响花卉采后的衰老代谢进程[11]。以上研究为水杨酸应用植物保鲜提供了一定的理论依据,然而关于水杨酸如何介导乙烯合成的机制尚不清楚,且关于水杨酸如何作用于菊花的采后保鲜更是鲜有涉及。基于此,本研究挖掘了对雏菊ERF的组成与特征,并探索了水杨酸对雏菊靶向ERF的影响。研究结果可为揭示水杨酸应用切花保鲜提供分子理论依据。
1 材料与方法
1.1 试验材料和试验方法
试验于2022年1—3月在河南农业职业学院园艺培养室中进行。供试雏菊品种为塔索BEL0201,来自河南省洛阳千卉谷农业有限公司。
选择发育相近、舌状花完全开放、花朵健壮、花茎硬挺的雏菊作为试材,将雏菊根茎于水中剪切成斜口型,保留花梗长度约20 cm,将切花插入装有100 mL常规培养液(无水杨酸)的三角锥形瓶(250 mL),雏菊花茎切口悬于培养液中,每瓶5株,插瓶深度约5 cm,瓶口采用透气薄膜封住,每3 d更换1次营养液,并在0、3、6、12、24、48、96、120 h取样保存于-80 ℃环境。
水杨酸处理即更换培养液时喷施5 mL的 100 mg/L 水杨酸溶液,该水杨酸质量浓度已被证明是菊花切花保鲜的最佳浓度[12],对照加入相同体积蒸馏水。
1.2 BpERF基因家族成员的鉴定及理化性质分析
从菊科基因组库(http://www.amwayabrc.com/)中下载菊花全基因组数据,基于HMMER(v3.1)平台检索菊花ERF家族成员[13],将搜索结果提交到NCBI保守域搜索平台(https://www.ncbi.nlm.nih.gov/)。手动筛选含AP2结构域序列,初步筛选得到229条序列,分别依次命名为AP2/ERF001~AP2/ERF229。去除残缺及未定义序列,共得到7条完整序列,分别命名为BpERF001~BpERF007,将BpERF提交至蛋白质理化性质程序(https://zenodo.org/record/)以预测全长氨基酸序列的理化性质,同时BpERF蛋白质序列提交WoLF PSORT(https://wolfpsort.hgc.jp/)预测亚细胞定位。
1.3 BpERF系统发育、基因结构、保守基序和顺式作用元件分析
通过拟南芥数据库(https://www.arabidopsis.org/index.jsp)获取拟南芥的ERF基因家族的氨基酸序列。将BpERF与同源拟南芥氨基酸序列(AtERF)数据共同整合为特定的fasta文件,并借助MEGA-X在线软件(https://www. megasoftware.net/)采用邻接法构建系统发育树,Bootstrap设置为2 000,其余参数为默认值[14]。
基因结构文件取自菊花基因组数据库Gff3文件,利用MEME在线工具(https://meme-suite.org/meme)对保守基序进行预测,简介模体(Motif)设置为6,其余参数默认。基于Plant CARE线上工具(http://bioinformatics.psb.ugent.be)以预测BpERF的启动子顺式调控作用元件。
1.4 BpERF转录组数据的获取与分析
通过基因组数据库下载的7个BpERF转录组数据和NCBI的序列读取数据库(SRA)下载雏菊的转录组数据(PRJNA548462),将下载的SRA默认格式文件转换为fastq文件,再导入fastqc软件获取质控报告。fastq文件利用trim galore、kallisto软件指令去除低质量数据并进行序列对比,以获取TPM表达量[15],通过TBtools在线工具对提取的AP2/ERF家族成员表达量数据构建热图。
1.5 染色体定位和同线性分析
使用TBtools的Map Genes On Genome From Sequence Files方法定位7个BpERF的染色体位置。使用的预序列从Phytozome在线平台获取(https://phytozome.jgi.doe.gov/pz/portal.html)。采用TBtools的Circos-plots工具链接多组连锁群(LG)之间的关系进行共线性可视化,使用默认参数的MCScanX并设置为pBLAST≤10-5[16]。
1.6 RT-qPCR、RNA-Seq验证表达数据及乙烯排放速率测定
利用气相色谱仪同步测定雏菊花瓣的乙烯释放速率,具体步骤参考史国安等的方法[5]。RNA测序用于交叉验证RT-qPCR的基因表达数据。每次处理完成后,分别从3株植株中收获茎、叶和花序组织,立即冷冻在液氮中,并储存在-80 ℃环境用于RNA分离和RT-qPCR分析,提取、纯化雏菊RNA,将纯化基因分为2个部分,一部分用于RT-qPCR分析,其看家基因、反应程序及条件参照李菲等的研究[17],目标基因序列相关引物采用Primer 5.0软件设计(F:5′-ATCATCTCTCTCTTCTCTGT-3′、R:5′-CAAACCAAACCGAAACGA-3′),其相对表达水平采用2-ΔΔCT断层扫描方法算法表示。另一部分运送至上海美吉生物医药科技有限公司,使用Illumina Novaseq 3000进行RNA-Seq测序文库构建和数据分析,基因转录水平的结果以每百万读数(TPM)的转录物水平表示。
1.7 数据处理与分析
借助Excel 2016进行数据预处理,采用DPS 14.0进行单因素方差分析及t检验,Origin 9进行相关图形绘制。
2 结果与分析
2.1 BpERF基因家族理化性质特征分析
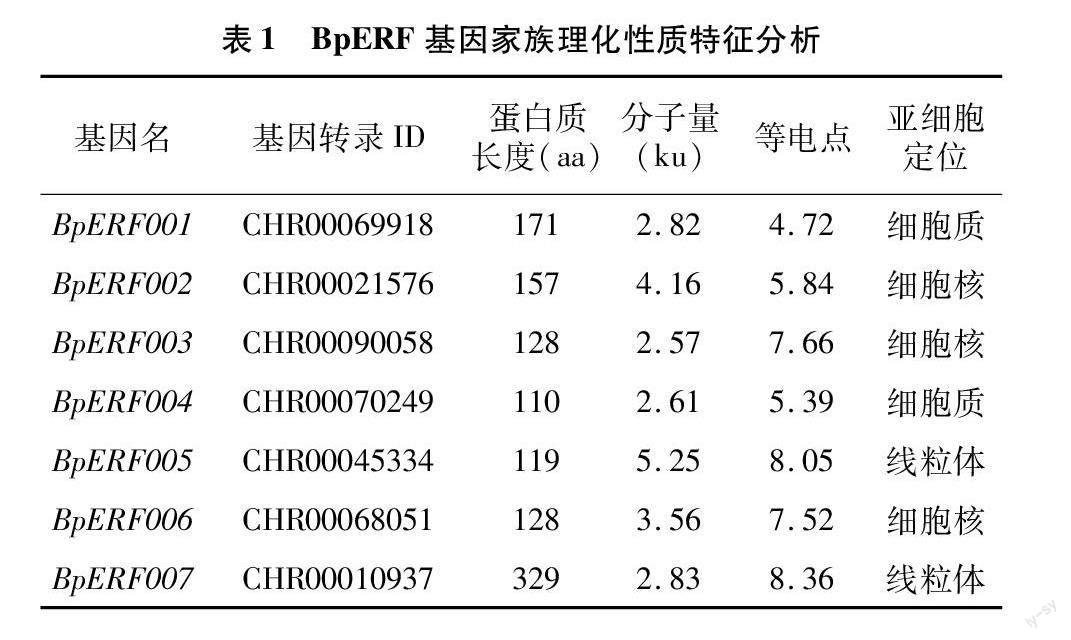
将BpERF基因序列與拟南芥数据库中的ERF蛋白序列进行BLAST对比,结果表明,在雏菊的基因组中共鉴定出7个ERF基因,分别命名为BpERF001、BpERF002、BpERF003、BpERF004、BpERF005、BpERF006和BpERF007(表1)。由表1可知,BpERF家族蛋白质长度范围为110~329 aa,蛋白质相对分子量在2.57~5.25 ku之间,等电点范围为4.72~8.36,其中BpERF001、BpERF002、BpERF004为酸性蛋白,其他则为碱性蛋白。亚细胞定位预测显示,BpERF001、BpERF004位于细胞质中,BpERF002、BpERF003、BpERF006位于细胞核中,BpERF005、BpERF007位于线粒体中。
2.2 BpERF系统发育、保守基序和氨基酸序列比对分析
采用邻接法分析7个BpERF和5个拟南芥直系同源物之间的系统发育关系,对BpERF全长蛋白质序列进行多重比,根据结构域分析,将7个BpERF基因分为3个亚家族(ERF-a、ERF-b和ERF-c),其中BpERF002、BpERF003、BpERF006属于ERF-a亚家族,BpERF007属于ERF-b亚家族,BpERF001、BpERF004、BpERF005属于ERF-c亚家族。
分析了7个BpERF的非翻译区(UTR)、编码序列(CDS)和内含子的基因结构。结果表明,除 ERF-a 亚家族的BpERF003、ERF-b亚家族中的BpERF007均具有1个内含子外,其他同一亚家族的BpERF基因内含子数目相同,且外显子/内含子结构相似(图1-B)。MEME预测的保守基序显示,motif-1在7个BpERF蛋白中都表现出保守性(图1-B)。此外,Motif-3只存在于ERF-a亚家族成员中,而motif-5只存在于ERF-c亚家族成员中,且ERF-c亚家族的BpERF001不具有motif-5。结构域序列进行的多重比对表明,全长氨基酸序列相似的BpERF在AP2结构域上存在高度相似性(图1-C)。这些发现表明,BpERF转录因子的结构和功能具有相似性,尤其是属于同一亚家族的BpERF转录因子。
2.3 BpERF共线性分析
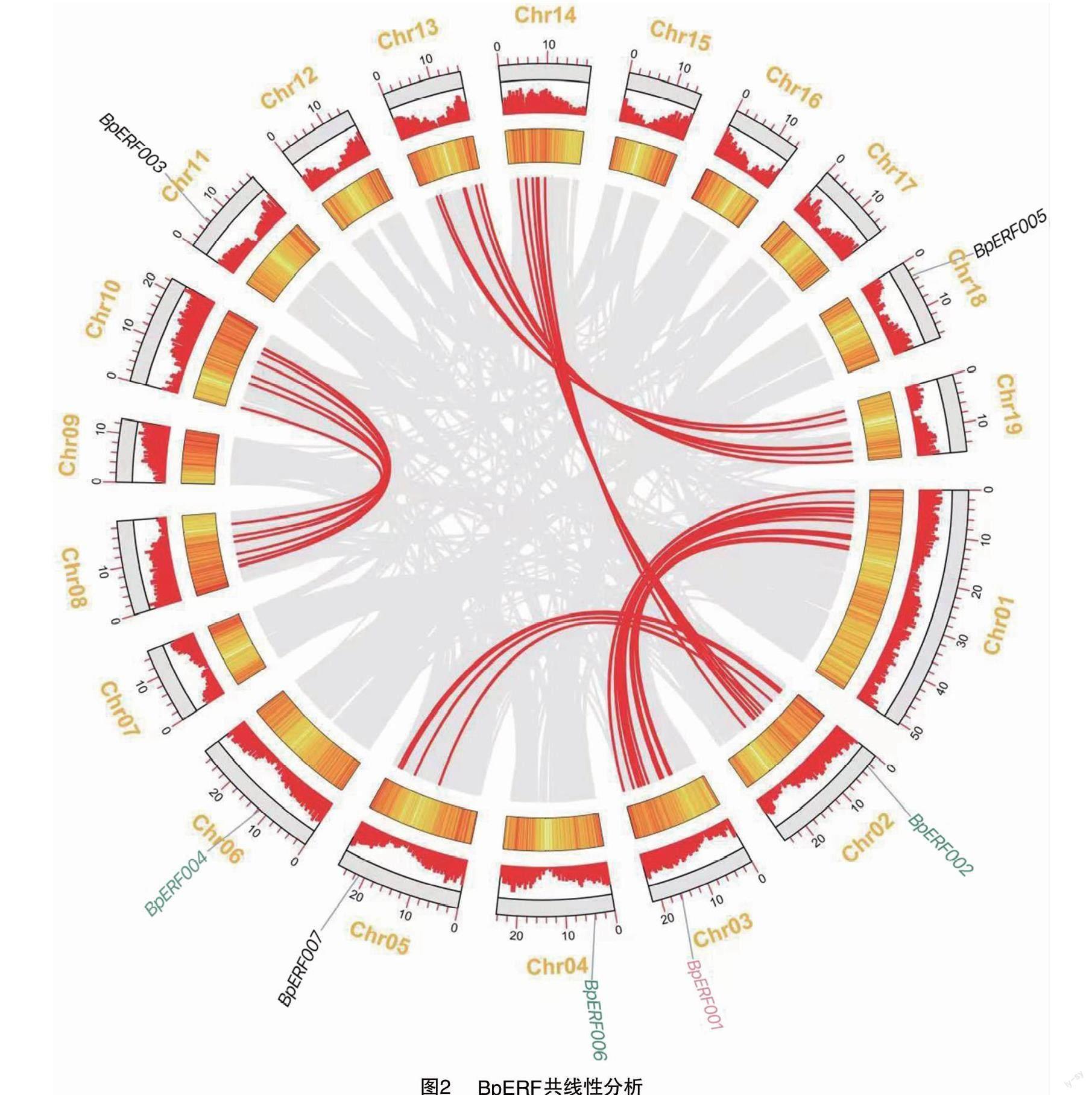
本研究中,基于ERF基因序列特征共得到19个连锁群(LG),7个BpERF基因分别被定位在Chr02、Chr03、Chr04、Chr05、Chr06、Chr011、Chr018中,且各BpERF的分布无重合定位现象(图2)。基于MCScanX对菊科和拟南芥包含的ERF基因进行了同线性分析,鉴定出21 519个菊科ERF基因与拟南芥ERF基因具有相似性;而在21 519个菊科ERF基因中发现209个ERF基因全基因组复制现象;在209个ERF基因中发现了83个共线基因(占比3971%),表明该83个BpERF基因存在全基因组复制事件,它们主要分布在2个LG(Chr01、Chr03)上,且BpERF001隶属于这83个共线基因之一。此外,共线性分析显示雏菊中的BpERF002、BpERF004和BpERF006隶属于30个串联共线的ERF基因,表明BpERF002、BpERF004、BpERF006存在基因串联重复序列(图2)。
2.4 BpERF基因启动子的顺式作用元件分析
基于PlantCARE数据库分析了7个BpERF基因的启动子的顺式作用元件。分析结果表明,BpERF包含10个顺式作用元件:Me JA响应元件、赤霉素响应元件、厌氧诱导元件、低温顺式作用元件、下降过程顺式元件、衰亡顺式作用元件、水杨酸响应元件、生长素响应元件、 防御和应激反应元件、创伤胁迫响应元件;但不同的BpERF在启动子顺式元件组成上存在差异。例如,仅BpERF007存在创伤胁迫响应元件,仅BpERF001、BpERF005、BpERF007特异性存在防御和应激反应元件,仅BpERF002、BpERF003、BpERF005含有衰亡顺式作用元件;BpERF001、BpERF004、BpERF006、BpERF007不含水杨酸响应元件。以上结果表明,BpERF002、BpERF003、BpERF005同时具有水杨酸响应原件和衰亡衰亡顺式作用元件,意味着这3个转录因子可能在切花保鲜中发挥作用。
2.5 基于RNA-Seq分析切花中BpERF的表达模式
由图4可知,就BpERF在不同组织的表达水平而言,以花序(Flower)和侧芽(Shoot)中的表达量高于茎秆(Stem)和叶片(Leaf),其中地上部组织中,各基因在花序中的表达水平相对较高,尤其是BpERF001、BpERF002和BpERF003,而BpERF001、BpERF003和BpERF007在茎、叶中皆超低表达。就基因表达总量来看,BpERF002和BpERF005较高。就水杨酸处理(SA)和无水杨酸处理(CK)的表达量对比结果来看,各基因在茎秆中的表达量差异较小;在叶片中除BpERF005外,其他基因在SA处理与CK的表达量差异也较小;而在侧芽中,BpERF001、BpERF002和BpERF004的SA处理与CK间的差异较小;同理,花序中的BpERF001、BpERF002和BpERF006的SA处理与CK间的差异较小。总体来看,在任一组织中,仅BpERF005基因的SA处理与CK间差异较大,且均为CK大于SA处理,即SA处理可诱导BpERF005基因发生下调表达,初步表明BpERF005基因可能是雏菊切花过程中调控植株衰老的潜在基因,应在后续研究中予以重视。
2.6 基于RT-qPCR分析目标基因的表达模式对水杨酸处理的响应
由图5-A可知,BpERF005在各组织中的相对表达量表现为茎秆<叶片<花序<侧芽,而施用水杨酸处理总体上没有改变BpERF005在各组织中的表达模式,仅显著或极显著降低了各组织的相对表达量,尤其在花序中。由图5-B可知,在切花后的120 h中,BpERF005在花序中的表达量呈先升高后降低的趋势,其表达峰值为切花后的12 h,此后开始逐渐降低,但任一时间点中,水杨酸处理均显著或极显著降低了BpERF005的表达水平,尤其在切花后的12 h。
2.7 水杨酸处理对雛菊切花乙烯排放速率及瓶插寿命的影响
由图6-A可知,切花后雏菊花序的乙烯排放速率与BpERF005在花序中的表达模式基于趋于一致,均呈先升高后降低模式,均在切花后的12 h达到峰值;而在水杨酸处理后期的排放速率与CK相比在任一切花时间点均降低;同时水杨酸处理后雏菊的瓶插寿命为9.1 d(218.4 h),CK为6.5 d(156 h),瓶插寿命显著延长了62.4 h。对切花后雏菊花序的乙烯排放速率和BpERF005表达量进行线性分析(图6-B)发现,两者存在显著(P=0.024 9<0.05)的线性正相关关系,这进一步显示BpERF005可能是调控乙烯排放的靶基因。
3 讨论与结论
改变遗传生理、改善瓶插环境及将生物化学策略应用于切花保鲜,以延缓或抑制乙烯的生物合成是延缓切花衰老的主要策略[18]。探索乙烯反应因子组成特征及响应机制,有望提高切花保鲜效果,从而提高观赏性及经济效益。本研究中基于HMMER检索和蛋白质Blast对比发现,在雏菊中共鉴定出7个乙烯反应因子(ERF),ExPASy和WoLF PSORT预测表明,BpERF基因蛋白质长度为110~329 aa,相对分子量为2.61~5.25 ku,等电点为 4.72~8.36;其中BpERF001、BpERF002、BpERF004为酸性蛋白,其他则为碱性蛋白。亚细胞定位预测显示,BpERF在细胞质、细胞核、线粒体中均有分布。
基于全长蛋白质序列构建的系统发育关系分析表明,7个BpERF共归属于3个亚家族(ERF-a、ERF-b和ERF-c),其中BpERF002、BpERF003、BpERF006属于ERF-a亚家族,BpERF007属于ERF-b亚家族,BpERF001、BpERF004、BpERF005属于ERF-c亚家族。这与之前研究中得出的结论存在差异:一般而言,高等植物中ERF1往往与ERF4、ERF5基因结构存在差异,所以不归属于同一亚家族中[19];造成差异的原因可能是菊科植物早期基因组发生变异分化的结果[20]。此外,同源性分析表明,这7个基因中只有4个拟南芥同源直系物,雏菊基因数量的增加表明在雏菊进化史中经历了基因复制事件[21]。在漫长的生物进化史中,全基因组复制事件和串联复制事件对菊科ERF转录因子基因的增加具有重要影响。同线性分析显示,BpERF001存在全基因组重复,而BpERF002、BpERF004和BpERF006与基因串联重复相关(图2)。
本研究中,基因结构分析表明,同一亚家族的基因具有相对相似和保守的内含子/外显子结构和基序,本研究确定了7个BpERF基因中的6个保守基序,AP2结构域中的保守motif 1存在于所有7个BpERF基因中;而motif 3和motif 5分别在ERF-a和ERF-c亚家族中保守,这个结果支持了系统发育分析和亚科分类的可靠性。多重比对显示,这7个BpERF蛋白具有AP2结构域和其他保守序列,例如YRG和RAYD元件。大量研究表明,ERF-c亚家族中的蛋白质含有一个保守的第14顺序列缬氨酸残基,AP2结构域中的保守缬氨酸残基往往决定着DNA与AP2结构域元件的特异性[22]。总之,以上结果表明,7个BpERF基因均高度保守,而ERF-c亚家族的成员可能在雏菊胁迫耐受与发育生理中发挥作用。
基因的翻译、转录与表达受顺式作用元件和反式作用因子调节[23-24]。本研究结果表明,不同BpERF基因的启动子包含多种胁迫应激反应元件,如厌氧诱导元件、防御和应激反应元件及创伤胁迫响应元件(图3)。一些BpERF基因启动子包含下降过程顺式元件、衰亡顺式作用元件以及激素(Me-JA、ABA、SA、IAA)响应元件,这表明ERF基因也可能通过调节激素分泌与凋亡代谢网络从而调控植物的表型衰老[7,25]。此外,启动子顺式作用元件分析发现,BpERF002、BpERF003、BpERF005同时含有衰亡顺式作用元件和水杨酸响应元件,意味着该3个转录因子可能在水杨酸应用于切花保鲜中发挥作用。
基于RNA转录组的相关性热图分析表明,不同的BpERF基因在不同组织中的表达模式存在差异,且对施用水杨酸的响应程度也不同。整体而言,不同组织中各BpERF基因的转录水平表现为花序>侧芽>叶片>茎秆,施用水杨酸条件下,BpERF005的转录水平显著或极显著下调,qRT-PCR基因表达结果与RNA-Seq转录结果高度一致,表明该结果可靠。qRT-PCR分析表明,BpERF005的相对表达量呈先升高后降低的趋势,其表达峰值为切花后的12 h,且乙烯排放速率与BpERF005表达模式趋于一致,线性相关分析表明,二者呈显著正相关关系(P=0.024 9<0.05)。此外,外源施用水杨酸使得雏菊的瓶插寿命显著延长了62.4 h。本研究仅基于转录表达结果验证了雏菊花序中BpERF005的表达模式及表型生理,然而在不同组织中不同的BpERF的功能租用可能存在差异,通过过表达和基因沉默技术检测这7个BpERF的具体分子机制是下一步的研究方向。
本研究通过全基因组综合分析结果表明,在雏菊中共鉴定得到7个乙烯反应因子(BpERF),ExPASy和WoLF PSORT预测表明,BpERF蛋白质长度为110~329 aa,相对分子量为2.61~5.25 ku,等电点为4.72~8.36,且在细胞质、细胞核、线粒体中均有分布。系统发育树和蛋白质序列的多重比对表明,这7个BpERF可归属于3个亚家族(ERF-a、ERF-b和ERF-c)并携带AP2保守结构域和YRG、RAYD等保守序列,因此可能受植物激素调节。基因结构和启动子分析表明,不同BpERF的启动子中存在许多与细胞分化反应和植物激素相关的顺式元件,其中BpERF002、BpERF003、BpERF005同时含有衰亡顺式作用元件和水杨酸响应元件,意味着这3个转录因子可能在水杨酸应用于切花保鲜中发挥作用。BpERF转录组分析(RNA-Seq)表明,与不施用水杨酸处理(CK)相比,水杨酸处理后不同组织中BpERF005的转录水平均明显降低,初步表明BpERF005是SA调控雏菊乙烯生物合成的潜在基因,qRT-PCR结果与RNA-Seq结果高度一致。此外,施用水杨酸处理下,BpERF005在花序中的表达模式与乙烯排放速率存在显著线性正相关关系,证实了BpERF005是调控雏菊乙烯合成的指示基因,且水杨酸显著延长了雏菊切花的瓶插寿命。研究结果为揭示乙烯反应因子在雏菊切花衰老过程中的功能提供了分子基础,也为水杨酸应用切花保鲜提供了理论依据。
参考文献:
[1]Karahan F. Morphology,anatomy,palynology and achene micromorphology of Bellis L.(Asteraceae) species from Turkey[J]. Acta Botanica Croatica,2020,79(1):59-67.
[2]赵 莉. 茶多酚与海藻酸钠膜对鲜切雏菊保鲜的影响[J]. 北方园艺,2015(11):124-129.
[3]ul Haq A,Lone M L,Farooq S,et al. Efficacy of salicylic acid in modulating physiological andbiochemical mechanisms to improve postharvest longevity in cut spikes of Consolida ajacis (L.) Schur[J]. Saudi Journal of Biological Sciences,2022,29(2):713-720.
[4]Min T,Xie J,Yi Y,et al. Expression of ethylene response factor genes during fresh-cut lotus root storage and browning[J]. Journal of the American Society for Horticultural Science,2018,143(6):462-469.
[5]史国安,王 依,史 田,等. 納米银和乙烯利预处理调控伊藤牡丹‘巴茨拉切花瓶插品质[J]. 林业科学,2022,58(9):79-89.
[6]董亚茹,李茹霞,赵东晓,等. 7个桑树AP2/ERF转录因子的生物信息学及表达分析[J]. 山东农业科学,2022,54(1):7-13.
[7]许世达,耿兴敏,王露露. 植物乙烯响应因子(ERF)的结构、功能及表达调控研究进展[J]. 浙江农林大学学报,2021,38(3):624-633.
[8]悦曼芳,张 春,吴忠义.植物转录因子AP2/ERF家族蛋白结构和功能的研究进展[J]. 生物技术通报,2022,38(12):11-26.
[9]Sharma A,Sidhu G P S,Araniti F,et al. The role of salicylic acid in plants exposed to heavy metals[J]. Molecules,2020,25(3):540.
[10]胡小京,赵 云,关元静.水杨酸对金鱼草切花保鲜效果的影响[J]. 江苏农业科学,2020,48(8):213-218.
[11]苏金龙,王小璐,李素方,等. 水杨酸延缓猕猴桃果实采后衰老与精氨酸分解代谢的关系[J]. 西北植物学报,2020,40(10):1714-1721.
[12]Budiarto K,Zamzami L,Endarto O.Effect of salicylic and ascorbic acids on post-harvest vase life of Chrysanthemum cut flowers[J]. Horticultural Science,2022,49(1):38-47.
[13]王昊宁,周 佩,刘 燕,等. 菊花AP2/ERF家族全基因组分析[J/OL]. 分子植物育种. [2023-02-16]. http://kns.cnki.net/kcms/detail/46.1068.S.20211224.1611.008.html.
[14]Kumar S,Stecher G,Li M,et al. MEGA X:molecular evolutionary genetics analysis across computing platforms[J]. Molecular Biology and Evolution,2018,35(6):1547-1549.
[15]Bray N L,Pimentel H,Melsted P,et al. Near-optimal probabilistic RNA-seq quantification[J]. Nature Biotechnology,2016,34(5):525-527.
[16]Chen C J,Xia R,Chen H,et al. TBtools,a toolkit for biologists integrating various biological data handling tools with a user-friendly interface[J]. BioRxiv. (2018-03-27)[2023-05-07]. https://www.biorxiv.org/content/10.1101/289660vl.ful.pdf.
[17]李 菲,户 倩,翟怡雯,等. 菊花CmERA1基因的克隆与表达模式分析[J]. 南京农业大学学报,2022,45(2):254-260.
[18]陈 进,刘小林. 鲜切花采后生理变化特征及保鲜技术研究进展[J]. 现代农业科技,2017(15):136-137,139.
[19]Yao W J,Zhou B R,Zhang X M,et al. Transcriptome analysis of transcription factor genes under multiple abiotic stresses in Populus simonii×P. nigra[J]. Gene,2019,707:189-197.
[20]Wong E L Y,Hiscock S J,Filatov D A.The role of interspecific hybridisation in adaptation and speciation:insights from studies in Senecio[J]. Frontiers in Plant Science,2022,13:907363.
[21]Wang S J,Huang J J,Wang X D,et al. Expression analysis of the NAC transcription factor family of Populus in response to salt stress[J]. Forests,2019,10(8):688.
[22]Djemal R,Khoudi H.Isolation and molecular characterization of a novel WIN1/SHN1 ethylene-responsive transcription factor TdSHN1 from durum wheat (Triticum turgidum L. subsp. durum)[J]. Protoplasma,2015,252(6):1461-1473.
[23]徐金龙,张文静,向凤宁. 植物盐胁迫诱导启动子及其顺式作用元件研究进展[J]. 植物生理学报,2021,57(4):759-766.
[24]顾鹏鹏,马鑫磊,姚 锐,等. 谷子HSP90基因家族鉴定及干旱胁迫下表达分析[J]. 江苏农业科学,2022,50(6):45-52.
[25]刘畅宇,陈 勋,龙雨青,等. 乙烯生物合成及信號转导途径中介导花衰老相关基因的研究进展[J]. 生物技术通报,2019,35(3):171-182.
