响应面优化猪苓菌核多糖超声辅助提取工艺及抗氧化活性分析
2023-08-13郑伊琦张安强张小军梅光明何鹏飞
郑伊琦,张安强,张小军,梅光明,何鹏飞,
(1.浙江海洋大学食品与药学学院,浙江舟山 316022;2.浙江省海洋水产研究所,浙江舟山 316021;3.浙江工业大学食品科学与工程学院,浙江杭州 310014;4.浙江省海水增养殖重点实验室,浙江舟山 316021)
猪苓(Polyporus umbellatus)为真菌界,担子菌亚门,层菌纲,多孔菌目(Polyporales),多孔菌科、多孔菌属[1],别名豕苓、猪茯苓等,在我国分布范围较广,主要产自河北、山西、陕西。猪苓菌核具有利水渗湿功效[2],作为药物使用在我国已有悠久历史[2]。猪苓中含有包括甾体类及多糖类等化合物在内的多种营养成分,其多糖含量依产地不同而在4.12~31.18 mg/g 范围内[3]。猪苓多糖与其许多生理功能具有紧密联系,具有良好的免疫增强[4-5]、抗肿瘤[6]、肝脏保护[7]、抗辐射[8]等生理功能。Gao 等[9]还发现猪苓多糖-硒纳米粒子具有抗增殖能力且低细胞毒性,可作为一种膳食补充剂运用于癌症化学预防中。
由于真菌分布范围极其广泛,已被作为活性多糖的重要来源进行开发。真菌多糖的提取方法有很多,目前除了传统的热水浸提法外,还有酶法提取、超声辅助热水提取法、微波辅助热水提取法等方法[10]。传统提取法具有耗时长、得率低、能耗大等缺点,超声辅助热水提取法是利用高频的超声波产生高速、强烈的空化效应和扰动效应等特点,简化提取过程,大幅缩短提取时间,提高提取效率,不对提取物、活性产生影响,且操作方法简单成本较低,具有高重现性被广泛应用于各类有效成分的提取[11]。提取温度、提取时间、液料比和超声功率是超声辅助提取过程中的重要参数,也是多糖提取工艺优化中极受关注的变量参数[12-13]。响应面法(response surface methodology,RSM)是一种可用于优化工艺条件的有效方法,该方法可以确定工艺运行过程中不同影响因素及各因素之间的相互作用对响应值的影响。通过对数学方法和统计方法的结合,拟合得到一个完整的二次多项式模型,用以呈现更优秀的实验设计和结果表达[14]。对多糖进行提取时,除了提高产量外,还应考虑其生物活性。Anraku 等[15]研究发现,抗氧化剂可有效延缓脂质氧化、抑制癌细胞增殖以及自由基产生,抗氧化活性是生物活性的基础。热水浸提法仍是目前猪苓菌核多糖的主要提取方法,该方法具有耗时长、提取效率低等不足。将超声辅助提取法应用于猪苓菌核多糖的提取,并应用响应面优化法确定不同参数对多糖得率的影响作用,建立最优提取工艺,提高猪苓菌核多糖得率及提取效率,对于猪苓菌核多糖开发利用具有极其重要的意义。
故本文采用单因素实验结合响应面法探究了猪苓菌核多糖超声辅助热水提取过程中提取温度、提取时间、液料比和超声功率对多糖得率的影响作用并确定最优提取工艺条件,同时通过DPPH 自由基清除试验和总还原力试验评估最优工艺条件下获得的猪苓菌核多糖的体外抗氧化活性,为猪苓菌核活性多糖的高效制备及进一步开发利用奠定基础。
1 材料与方法
1.1 材料与仪器
干燥的猪苓菌核 产自陕西省佛坪县;DPPH、抗坏血酸 美国Sigma 公司;BCA 蛋白浓度测定试剂盒(增强型) 上海碧云天生物技术有限公司;葡萄糖、苯酚、浓硫酸、3,5-二硝基水杨酸(DNS)、酒石酸钾钠、铁氰化钾、三氯化铁、三氯乙酸、磷酸二氢钾、磷酸氢二钾等 分析纯,国药集团化学试剂有限公司。
DJ-04 中药粉碎机、SHB-Ⅱ-A 循环水真空泵上海淀久仪器有限公司;RE2000 旋转蒸发仪 上海亚荣生化仪器厂;V-1800PC 紫外-可见分光光度计上海美谱达仪器有限公司。
1.2 实验方法
1.2.1 猪苓菌核预处理 干燥猪苓菌核使用粉碎机粉碎后,加入8 倍质量的工业酒精浸泡过夜,重复3 次,以去除其中小分子糖、色素和脂溶性成分等物质[16]。酒精浸泡后的猪苓菌核粉末经过滤、干燥后,置于阴凉通风处备用。
1.2.2 猪苓菌核多糖的超声辅助提取 准确称取10 g经预处理后的猪苓菌核粉末,按照液料比20 mL/g加入蒸馏水,置于超声功率300 W、提取温度70 ℃的条件下超声提取90 min。提取液经7000 r/min 离心10 min 和过滤后减压浓缩,用蒸馏水定容至100 mL。
1.2.3 单因素实验 在改变其中一个影响因素而其余因素不变的情况下,分别考察提取温度水平(50、60、70、80、90 和100 ℃)、超声功率水平(120、180、240、300 和360 W)、液料比水平(10、15、20、25 和30 mL/g)和提取时间水平(25、40、55、70 和90 min)四个影响因素对猪苓菌核多糖得率的影响。
1.2.4 响应面优化试验设计 在单因素实验结果的基础上,采用四因素三水平的Box-Behnken 试验设计方案(BBD)对猪苓菌核多糖提取工艺参数进行响应面优化分析,考察因素及水平设计见表1,试验设计方案见表2。在响应面优化设计试验结果基础上进行验证实验,比较预测多糖得率与实际多糖得率。

表1 响应面试验因素水平设计Table 1 Independent variables and their levels for the response surface design
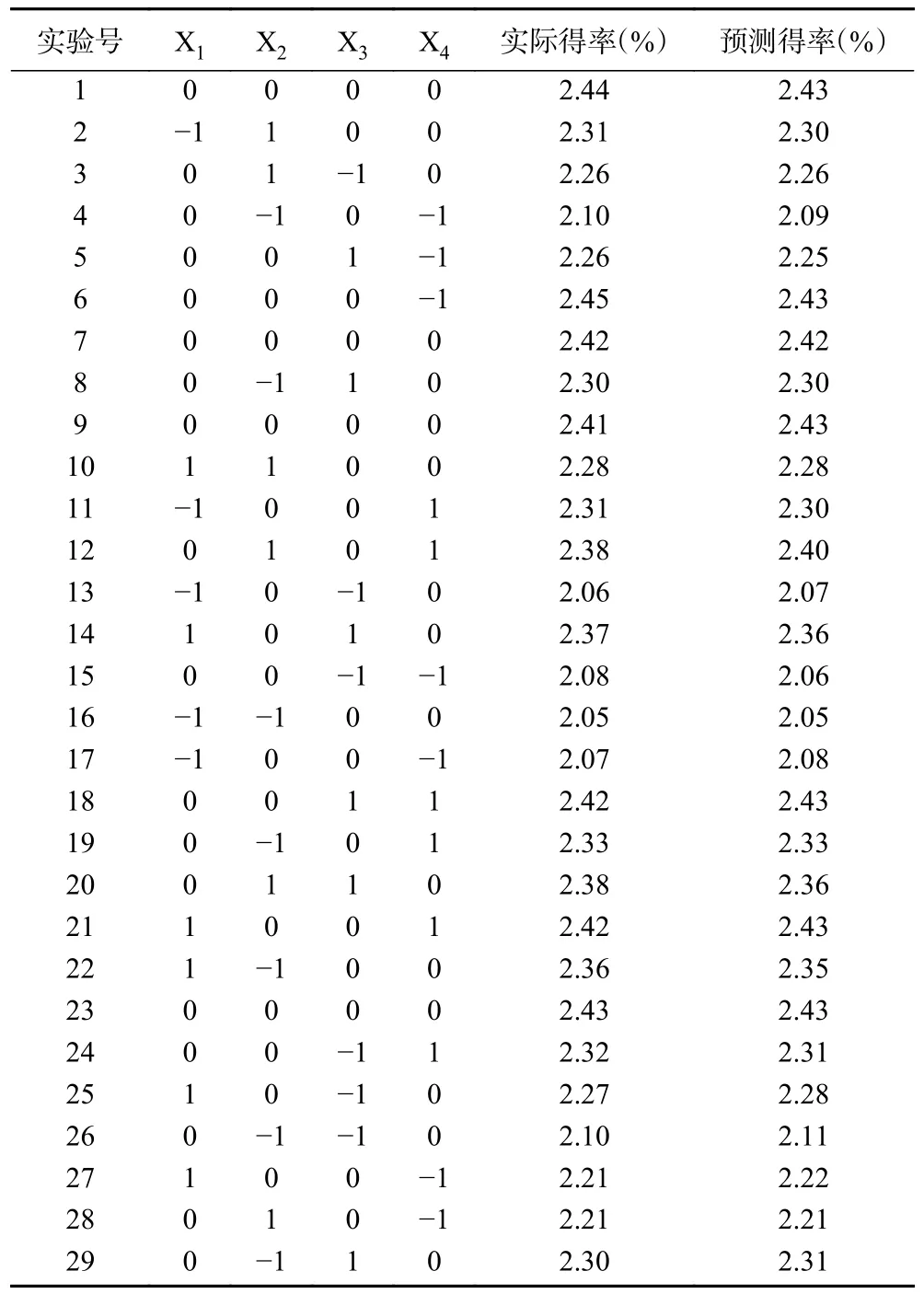
表2 响应面试验设计及结果Table 2 Design and result Box-Behnken
1.2.5 猪苓菌核粗多糖分离工艺 按照最优工艺提取猪苓菌核多糖,提取液采用旋转蒸发仪减压浓缩10 倍后,加入工业酒精使酒精浓度依次达到30%vol、60%vol、80%vol,静置过夜后离心(7000 r/min,10 min),沉淀分别命名为粗多糖PUPF-30、PUPF60、PUPF80。
1.2.6 总糖含量测定 使用苯酚-硫酸法测定总糖含量[17],具体步骤为取1.00 mL 多糖溶液于试管中,补加水至2.00 mL,加入5 mL 6%苯酚溶液,沸水浴15 min,迅速冷却至室温后,测定490 nm 处吸光度值。总糖含量以无水葡萄糖计,浓度范围20~120 μg/mL的回归方程为y=0.0068x-0.0025,决定系数R2=0.998。
1.2.7 还原糖含量测定 还原糖含量的测定采用3,5-二硝基水杨酸法[17],简要步骤如下:取1.00 mL多糖溶液于试管中,加入3.00 mL 水杨酸试剂,置于沸水浴中反应5 min 后,冷却至室温并用水定容至25.0 mL,测定520 nm 处吸光值。还原糖含量以无水葡萄糖计,浓度范围0.2~1.0 mg/mL 的回归方程为y=1.002x-0.0355,决定系数R2=0.999。
1.2.8 猪苓多糖得率测定 猪苓菌核多糖提取液经适当稀释后,分别测定总糖和还原糖含量,得率按下式计算:
式中:Ct表示稀释液中总糖浓度,mg/mL;Nt表示总糖测定稀释倍数;Cr表示稀释液中还原糖浓度,mg/mL;Nr表示还原糖测定稀释倍数;V 表示提取液体积,mL;M 表示原料质量,g。
1.2.9 蛋白质含量测定 按照BCA 蛋白浓度测定试剂盒说明,取25 μL 样品溶液与200 μL BCA 工作液混匀,37 ℃反应30 min,测定562 nm 处吸光值。以牛血清白蛋白为标准品绘制曲线,回归方程y=0.00128x+0.04034,决定系数R2=0.999。
1.2.10 紫外全波长扫描 猪苓菌核粗多糖组分用蒸馏水配制成2 mg/mL 溶液,置于石英比色皿中,采用紫外分光光谱仪在200~400 nm 波长范围内扫描。
1.2.11 抗氧化活性测定
1.2.11.1 DPPH 自由基清除活性 粗多糖组分用蒸馏水稀释成0.1、0.25、0.5、1.0、2.0、4.0 mg/mL 的溶液,移取2.00 mL 溶液与等体积的0.2 mmol/L 新鲜配制的DPPH 甲醇溶液混匀,避光孵育30 min后,在517 nm 处测量吸光度值。实验以抗坏血酸为阳性对照[18]。清除活性计算公式如下:
式中:Ai表示样品吸光度值;Aj表示样品本底吸光度值;A0表示空白对照吸光度值。
1.2.11.2 总还原力测定 向各试管中加入不同浓度的样品溶液,加入等体积0.2 mol/L 磷酸盐缓冲液(pH6.6)和1%(w/v)铁氰化钾溶液,50 ℃水浴20 min后加入2.0 mL 10%三氯乙酸溶液,混匀后离心取2.5 mL 上清液加入等体积蒸馏水和0.5 mL 氯化铁溶液,在波长700 nm 处测量吸光度值[19]。
1.3 数据处理
所有实验均平行3 次,结果以平均值±标准偏差(n=3)表示。采用IBM SPSS 19.0 统计软件对实验数据进行统计分析,显著水平P<0.05。试验中图形的绘制使用OriginPro 2015,使用Design-Expert 软件进行响应面法优化分析。
2 结果与分析
2.1 单因素实验结果
在保证其余因素不变的情况下,提取温度、超声功率、液料比和提取时间对猪苓菌核多糖得率的影响如图1 所示。在液料比20 mL/g、超声功率300 W、提取时间90 min 条件下,随着提取温度从50 ℃升到100 ℃,猪苓菌核多糖得率先显著升高(P<0.05),70 ℃后则无明显变化(图1a)。地木耳多糖超声辅助提取中也有相似的得率随温度变化趋势[20],其原因可能是温度升高有助于提高多糖的溶解度及传质效率,但高温下蒸气压升高而形成的气穴缓冲作用减弱了超声空化作用[21-22]。因此,选择提取温度为60、70、80 ℃进行后续响应面试验。
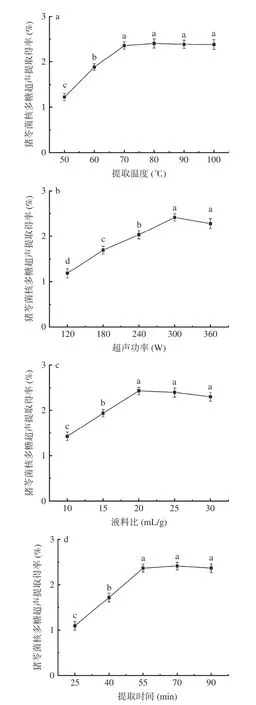
图1 单因素实验结果Fig.1 Results of single-factor experiments
超声功率与空化气泡数量、崩塌能量及空化过程经济型等密切相关,是声空化作用中的重要参数[23]。图1b 显示了液料比20 mL/g、提取温度70 ℃、提取时间90 min 条件下,猪苓菌核多糖得率在120~300 W范围内与超声功率显著正相关(P<0.05),但在300~360 W 范围内则为负相关,这可能是由于超声功率超过了空化作用的临界功率值,空化气泡不能充分崩塌而导致的[24]。此外,超声功率过大而使多糖出现部分降解,也是造成多糖得率下降的另一可能原因[25]。因此,选择超声功率为240、300 和360 W 三个水平进行后续响应面试验。
在提取温度70 ℃、超声功率300 W、提取时间90 min 条件下,液料比在10~30 mL/g 范围内对猪苓菌核多糖得率的影响如图1c 所示,随着液料比的增大,多糖得率先显著升高(P<0.05)而后缓慢降低(P>0.05),液料比为20 mL/g 时的多糖得率最大。液料比增大,固相和液相间多糖的质量浓度差增加,从而使传质动力增加,多糖得率增大;但溶剂增多也造成了单位体积内的超声能量降低,而使得多糖得率降低[26]。选择液料比为15、20 和25 mL/g 进行后续响应面试验。
在液料比20 mL/g、提取温度70 ℃、超声功率300 W 条件下,提取时间在25~90 min 范围内对猪苓菌核多糖得率的影响如图1d 所示。25~55 min 内多糖得率随提取时间延长显著升高(P<0.05),55~90 min 内多糖得率则先缓慢升高后缓慢下降。延长提取时间有助于多糖在溶剂中的溶出和扩散,但时间过长则可能使多糖发生降解而影响多糖得率[13]。综上,选择提取时间为40、55 和70 min 进行响应面试验。
2.2 响应面优化试验结果
2.2.1 响应面回归模型及统计分析 对提取温度(X1)、超声功率(X2)、液料比(X3)及提取时间(X4)进行BBD 试验设计,实验结果见表2。随着因子水平的组合变化,多糖得率在2.05%~2.44%范围内波动。采用Design Expert 软件对实验结果进行拟合分析,得到完全二次多项式回归模型如下:
回归模型进一步应用方差分析及显著性检验进行评估,结果见表3。F值和P值用于显著性评估,F值越高,P值越低,显著性则越高[27]。从表3 可知,模型F值为144.18,P<0.0001,表明回归模型极其显著,模型很好地解释了多糖得率中的变异;失拟项F=0.8500,P>0.05,说明了模型失拟和纯误差造成的得率变异之间差异不显著,模型预测值和实验值吻合良好[28]。决定系数R2=0.9931,校正决定系数=0.9862,预测决定系数=0.9696,说明该回归模型选择合适,具有良好的拟合优度和预测能力。较小的变异系数CV(0.6535%)说明结果准确性和可靠性较高。Adeq Precision 指示了模型信噪比,其值大于4 则表明模型抗干扰能力良好[29]。该模型Adeq Precision=35.7917,说明其在自变量范围内是准确可靠的。
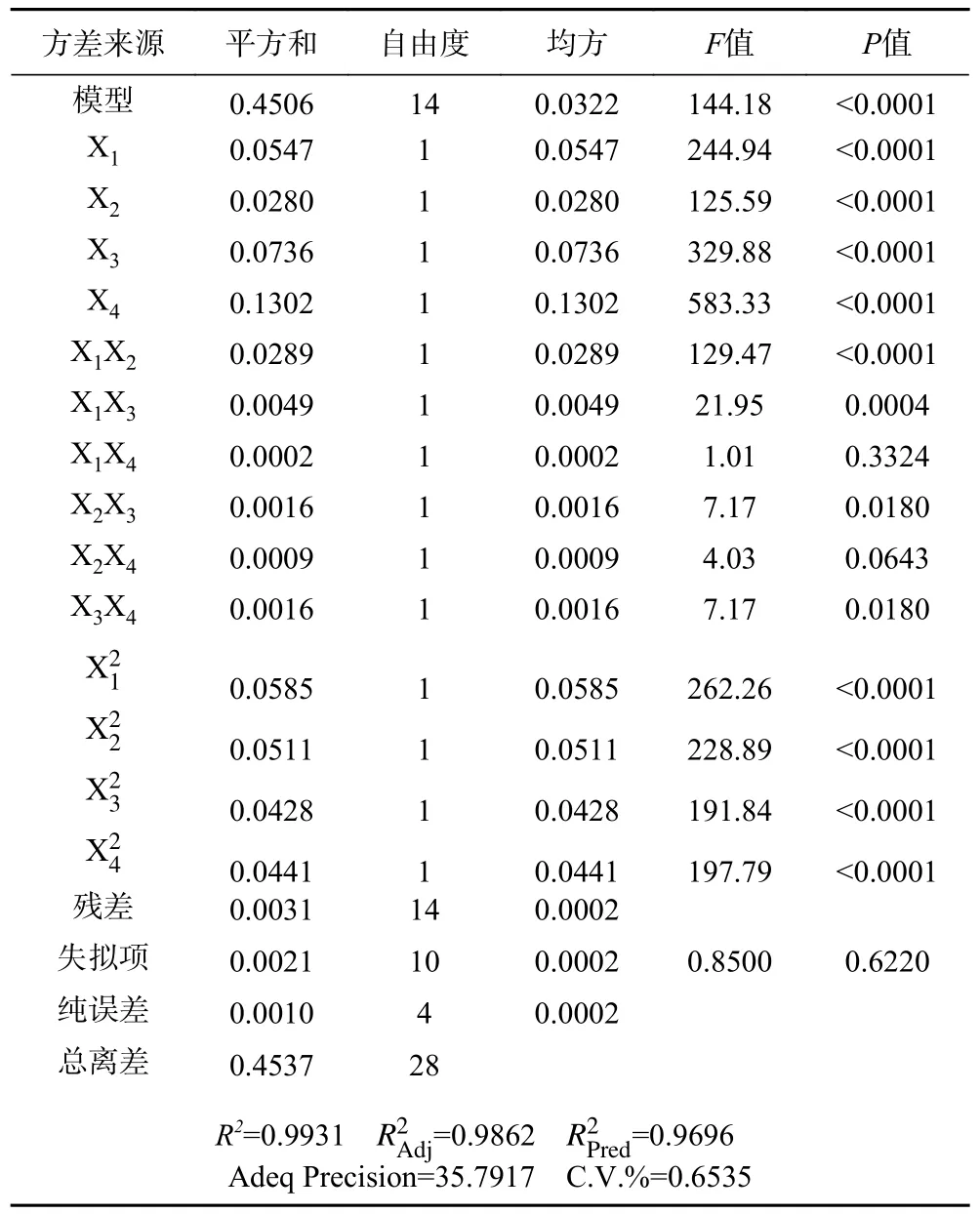
表3 二次模型的方差分析表Table 3 ANOVA table for quadratic model
2.2.2 响应面模型充分性诊断 模型充分性诊断可判断近似模型是否会产生不良或误导性的结果[30]。预测值与实际值关系可用于评估模型适用性,数据点分布近似直线则表明模型预测得率和实际得率之间高度一致。标准化残差的正态概率分布近似为一条直线,证明了模型标准化残差符合正态分布。残差与实验运行顺序二者关系可用于验证残差的序列相关性,残差围绕中心线随机分布,表明彼此相近的残差之间无相关性。综上,本文所采用的响应面模型对猪苓菌核多糖得率的描述是充分的。
2.2.3 响应面因素分析 由方差分析表(表3)中各项回归系数的F值和P值可知,所有线性系数和二次项系数均极为显著,交互项中X1X2、X1X3、X2X3、X3X4的系数也是显著的,说明提取温度和提取时间之间以及超声功率和提取时间之间无显著交互作用,而其余因素间的交互作用对多糖得率有显著影响。由X1X2的系数及F值可知,交互项中提取温度和超声功率的交互作用对多糖得率影响最大。根据回归方程中各项系数符号可知,多糖得率与线性项正相关,而与交互项及二次项均为负相关,因此可推断出猪苓菌核多糖得率可能存在最大值。
响应曲面图和等高线图可直观生动地显示不同因素对因变量的影响作用,等高线接近椭圆则说明两因素的交互作用显著;响应曲面图中曲线越陡则该因素影响越大[31]。图2a~图2f 显示了随着提取温度、超声功率、液料比和提取时间的增大,猪苓菌核多糖得率均先上升后下降的变化趋势,响应曲面中曲线变化趋势表明不同因素对多糖得率的影响作用由大到小分别为:提取时间、液料比、提取温度、超声功率。椭圆形等高线图(图2a、图2b、图2d、图2f)说明了提取温度和超声功率、提取温度和液料比、超声功率和液料比、液料比和提取时间之间交互作用显著;近似圆形的等高线图(图2c、图2e)则表明提取温度和提取时间、超声功率和提取时间之间的交互作用对多糖得率无显著影响。
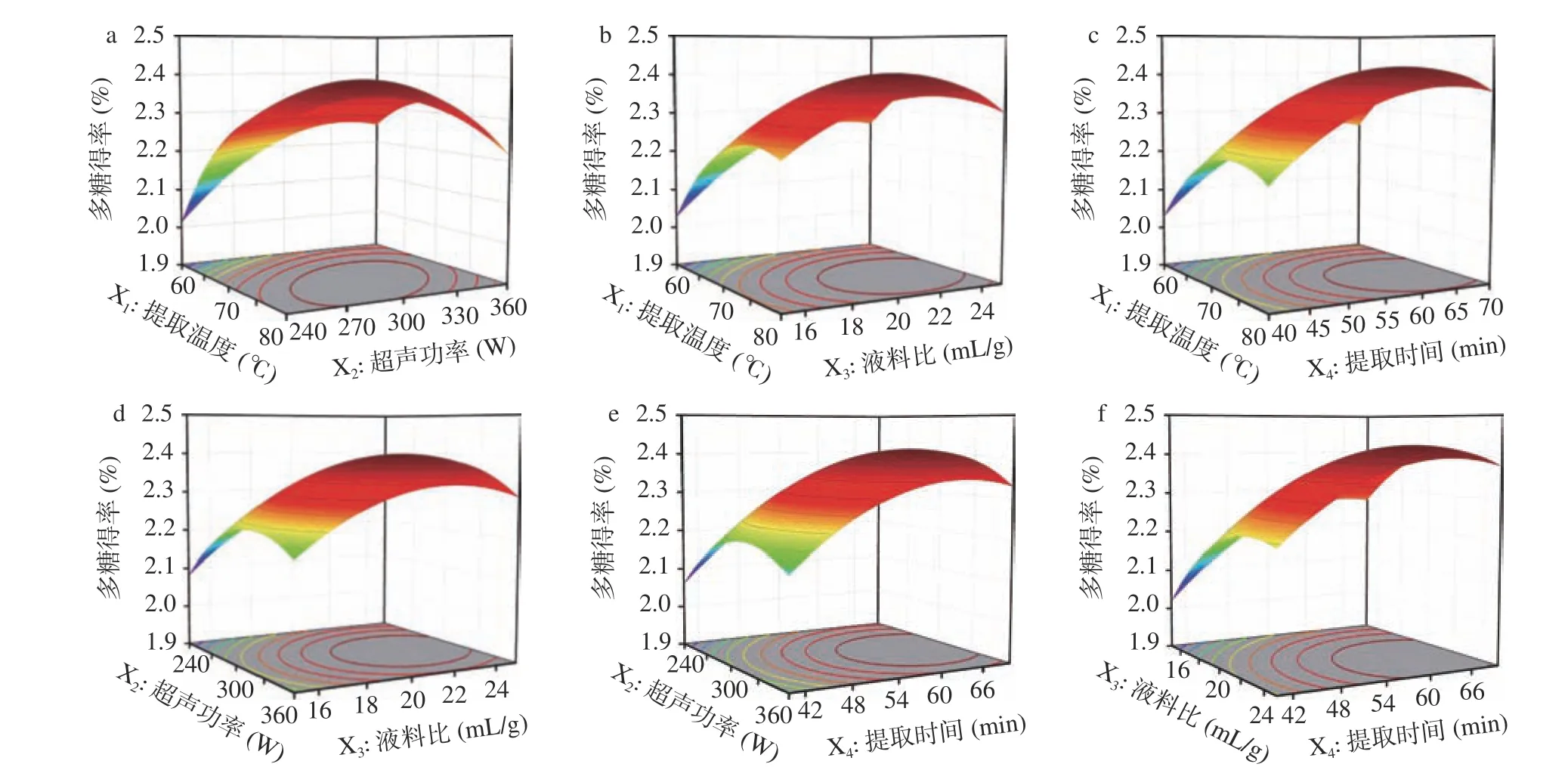
图2 各因素交互作用对多糖得率影响的响应面图Fig.2 Response surface plots of the effects of interactions among factors on polysaccharide yield
由图2a~图2f 可直观地看到在响应面优化的参数范围内,猪苓菌核多糖得率可取得最大值。利用回归预测模型计算可知猪苓菌核多糖超声辅助提取最佳工艺条件为提取温度72.3 ℃、超声功率304.2 W、提取时间为63.6 min、液料比为21.7 mL/g,最大得率为2.48%。
2.2.4 响应面优化试验结果验证 参照响应面最佳提取工艺,并根据实际情况调整工艺条件为提取温度72.0 ℃、提取功率300 W、提取时间65 min 和液料比22 mL/g,在此条件下进行3 次平行实验得到猪苓菌核多糖得率为2.47%±0.03%,与回归模型预测的多糖得率最大值相比无显著差异,说明应用响应面模型优化多糖超声辅助提取工艺条件的结果可靠。
2.3 猪苓粗多糖理化特性分析
按照最优工艺条件提取后,通过酒精沉淀分级得到3 个猪苓菌核粗多糖组分PUPF30、PUPF60、PUPF80,它们的紫外全波长扫描结果如图3 所示。3 个组分的最大紫外吸收均在200~210 nm,表明了多糖为它们的主要成分;同时260~280 nm 范围内的少量吸收则说明了它们也含有少量蛋白和核酸。对3 个粗多糖组分的总糖、还原糖和蛋白含量进一步进行测定,结果如表4 所示。多糖含量由高到低为PUPF60、PUPF80、PUPF30,对应含量分别为58.60%、50.35%、39.99%;蛋白含量由低到高为PUPF60、PUPF80、PUPF30,对应含量分别为14.42%、25.54%、25.80%。PUPF60 在三个组分中是多糖含量最高且蛋白含量最低的组分。

图3 猪苓菌核粗多糖紫外全波长扫描图Fig.3 UV scanning spectra of crude polysaccharide fractions form crude polysaccharide from Polyporus umbellatus sclerotium
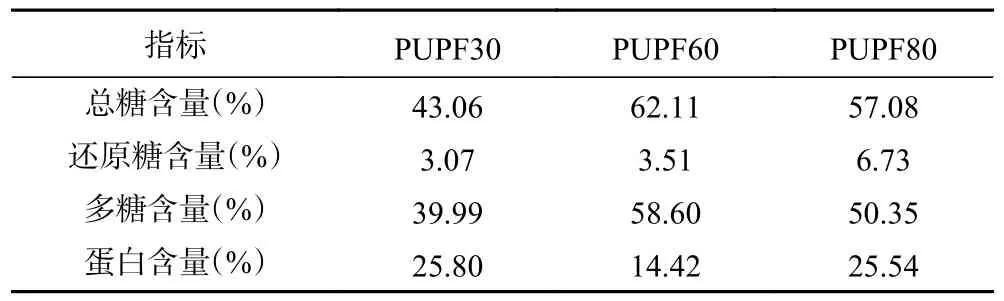
表4 猪苓菌核粗多糖组分糖含量和蛋白含量Table 4 Glucose content and protein content of crude polysaccharide components in sclerotium of Polyporus umbellatus
2.4 猪苓菌核多糖体外抗氧化活性
2.4.1 猪苓菌核多糖的DPPH 自由基清除活性DPPH 作为一种以氮为中心的稳定自由基,其在517 nm处的最大吸收随着自由基清除剂的加入而下降,被广泛用于自由基消除能力的体外评估[32-33]。猪苓菌核粗多糖组分的DPPH 自由基清除活性如图4 所示。在实验浓度范围内,三个粗多糖组分均呈现出一定的DPPH 自由基清除活性,自由基清除能力随多糖浓度增高而增高。PUPF60 和PUPF80 的自由基清除活性明显优于PUPF30,浓度4 mg/mL 时,PUPF30的清除率为50.63%,而PUPF60 和PUPF80 的清除率分别为83.95%和87.48%,接近同等浓度下VC的清除率。

图4 猪苓菌核粗多糖组分对DPPH 自由基清除率的影响Fig.4 Effects of crude polysaccharide components from Polyporus umbellatus sclerotium on DPPH radical clearance rate
2.4.2 猪苓菌核粗多糖组分的总还原能力测试结果多糖的总还原力与抗氧化活性呈正相关,多糖作为一种电子供体能与自由基反应生成稳定产物,阻止过氧化物生成[34]。猪苓菌核多糖能使铁氰化物复合物中Fe3+转变成相应的Fe2+,还原力越强,对应的吸光度值越高[35]。如图5,在0.1~4.0 mg/mL 的实验浓度范围内,随着猪苓菌核多糖浓度增大,吸光度值也随之增大。三个粗多糖组分的总还原力大小比较结果为PUPF80>PUPF60>PUPF30。
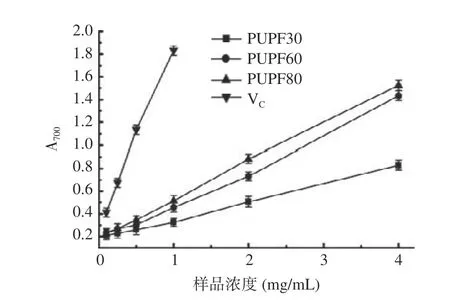
图5 猪苓菌核粗多糖组分对体系总还原力的影响Fig.5 Effect of crude polysaccharide components from Polyporus umbellatus sclerotium on total reducing power of the system
活性氧(ROS),包括过氧化氢、超氧阴离子和羟基自由基等,是引起食品、药品氧化劣变以及多项机体失调的重要影响因素,而抗氧化剂是有效降低这些活性氧造成的不利效应的重要物质。合成抗氧化剂潜在的毒副效应近年来日益受到关注,因此天然抗氧化剂的开发研究正逐渐加速。多糖是天然抗氧化剂的重要来源,如铁皮石斛多糖[36]和祁白芷多糖[37]的抗氧化活性均已报道。天然活性多糖可能的抗氧化机制是通过从稳定的化合物中转移氢原子或单电子来终止链式反应,同时多糖的抗氧化与其化学组成、分子量、构象等结构特性密切相关[38-39]。抗氧化结果显示猪苓菌核经超声辅助提取后,制备得到的三个组分均具有一定的抗氧化活性,同时PUPF60 和PUPF80 在DPPH 自由基清除能力及总还原能力测试中的抗氧化性能优于PUPF30,有作为候选天然抗氧化剂而进一步研究利用的发展潜力。
3 结论
在单因素实验的基础上,猪苓菌核多糖超声辅助提取的响应面回归模型显著,失拟项不显著,对多糖得率的描述充分,适于多糖得率的优化预测分析。根据实际情况调整响应面优化最佳提取工艺条件为提取温度72.0 ℃、提取功率300 W、提取时间65 min和液料比22 mL/g,在此条件下进行3 次平行实验得到猪苓菌核多糖得率为2.47%±0.03%,与回归模型预测的猪苓菌核多糖最大得率结果无显著差异。回归模型显著性分析表明猪苓菌核多糖得率不仅与四个提取参数显著相关,也与提取温度和超声功率、提取温度和液料比、超声功率和液料比、液料比和提取时间之间的交互作用显著相关。超声辅助提取的猪苓菌核多糖经分级醇沉制备得到PUPF30、PUPF60、PUPF80,多糖含量分别为39.99%、58.60%、50.35%,蛋白含量分别为25.80%、14.42%、25.54%。抗氧化测试结果表明猪苓菌核多糖组分在DPPH 自由基清除能力和还原力均呈一定的剂量依赖性,但PUPF80和PUPF60 的抗氧化能力明显优于PUPF30。综上,响应面应用于猪苓菌核多糖超声辅助提取工艺优化是合适的,且优化后的提取工艺可用于猪苓菌核活性多糖的有效提取制备,为猪苓菌核多糖的进一步开发利用奠定了基础。
