基于网络药理学及体外实验探讨人参-甘草对非小细胞肺癌的作用机制
2023-08-13周文月文艺儒周森林王梦琪许光亚
周文月,文艺儒,周森林,王梦琪,童 宇,许光亚,时 政,
(1.成都大学临床医学院/附属医院食品与生物工程学院,药学院,基础医学院,四川成都 610106;2.四川大学华西医院,四川成都 610041)
肺癌是全球发病率和病死率均较高的恶性肿瘤之一,非小细胞肺癌(Non-small cell lung cancer,NSCLC)约占肺癌的85%[1]。我国是目前世界上肺癌疾病负担最重的国家,诊断时已经中晚期的非小细胞肺癌(NSCLC)患者约占肺癌总发病的45%[2]。目前治疗肺癌的手段主要有手术、放疗、化疗和靶向治疗等,其中化疗是最普遍的治疗方式,但患者用药后往往会出现耐药现象和不同程度的副作用[3-4]。因此,开发新的防治手段非常重要。保健食品对肿瘤的防治能力已成为近年来的研究热点,其具有安全性高、价格低廉、可长期服用等优点,在恶性肿瘤的防治中发挥其独特的优势[5]。
人参、甘草是中医药中常见的药对药材,我国卫生部已将人参列为可用于保健食品物品,将甘草列为药食同源物品[6-7]。近些年人参、甘草已经被用于保健食品的开发。研究表明二者协同配伍后有优于单味药材的抗肿瘤作用,可表现出协同增效作用[8-9]。人参(Panax ginsengC. A. Mey.)为五加科植物人参的干燥根或根茎,人参含有三萜皂苷类及多糖类化合物,其中皂苷类化合物具有抗肿瘤、抗氧化、抗炎等作用[10],Liu 等[11]发现人参中主要成分人参皂苷Rg3可通过激活VRK1/P53BP1 通路来调节NSCLC 细胞中的DNA 损伤,达到抗肿瘤作用。甘草(Glycyrrhiza uralensisFisch)是一味常用大宗药材,甘草的主要成分是三萜皂苷和黄酮类,其主要成分具有抗癌、抗溃疡、抗炎等多种药理作用[12-13]。Zhu 等[14]发现甘草提取物通过下调CDK4 细胞周期蛋白D1 复合物和增加CD8+T 细胞浸润来抑制NSCLC 的生长。但是目前利用人参-甘草协同治疗NSCLC 的分子机制尚未明确。
近年来,将系统生物学的思想和方法应用于中药研究中,正成为一种新的趋势。网络药理学已发展成一个新兴学科,其包括了数据收集、靶点预测、网络分析、可视化多组分相互作用和信号通路预测等多种研究方法[15-16]。而网络药理学的整体性、系统性特点与中医药学从整体的角度去诊治疾病的理论不谋而合。目前,关于通过网络药理学探讨人参单体及甘草单体治疗NSCLC 的研究较多,但人参-甘草协同治疗NSCLC 的相关网络药理学研究暂未见报道。因此,本文利用网络药理学的高效性与中医药治疗的系统性,以及体外实验验证,探讨人参-甘草治疗非小细胞肺癌的潜在机制及药效作用,为临床上应用人参-甘草治疗非小细胞肺癌提供新的理论依据。
1 材料与方法
1.1 材料与仪器
A549 细胞、Ham’s F-12K 培养基 Procell 公司;人参 成都吉安康药业公司;甘草 四川和顺康药业公司;胰酶(+EDTA)、双抗 上海源培公司;胰酶(-EDTA) BOMEI 公司;胎牛血清 HyClone公司;MTT Biofroxx 公司;二甲基亚砜(DMSO)Sigma 公司;Annexin V-APC/PI 双染细胞凋亡检测试剂盒 凯基公司;PBS 缓冲液 Servicebio 公司。
DMI1 倒置生物显微镜 LEICA 公司;TDZ4-WS 台式低速离心机 长沙湘仪离心机仪器有限公司;MCO-15AC 二氧化碳培养箱 三洋电机国际贸易有限公司;SW-CJ-2F 洁净工作台 苏净集团苏州安泰空气技术有限公司;SYQ-DSX-280B 压力蒸汽灭菌器 上海宜川仪表厂;HH-1 水浴锅 金坛市荣华仪器制造有限公司;UPH-‖-10T 优谱超纯水制造系统 成都超纯科技有限公司;TS-A 脱色摇床 常州普天仪器制造有限公司;spectra max PLUS 384 酶标仪 Molecular Device 公司;cytoflex 流式分析仪Beckman 公司。
1.2 实验方法
1.2.1 收集人参-甘草活性成分和靶点 利用中药系统药理学数据库与分析平台TCMSP(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP),选择“Herb Name”选项,分别将“人参”、“甘草”作为关键词,将类药性(DL)≥0.18、口服利用度(OB)≥30%作为筛选标准,获得人参、甘草的活性成分和相关靶点。
1.2.2 构建药物-活性成分-潜在靶点网络图 可视化网络构建与分析软件Cytoscape 是构建与研究中药网络的常用软件。把人参-甘草的活性成分与潜在靶点导入软件Cytoscape 中,构建药物-活性成分-潜在靶点网络图。
1.2.3 非小细胞肺癌靶点获取 在TTD、CTD 及Gene Cards 数据库中,以“Non-small cell lung cancer”为检索词,分别收集非小细胞肺癌的靶点,整合结果,去除重复,得到非小细胞肺癌的疾病靶点。
1.2.4 构建蛋白相互作用网络(PPI) 利用Draw Veen Diagam(http://bioinformatics.psb.ugent.be/webtools/Venn/)制作药物-疾病交集靶点Veen 图,并得到交集靶点。把交集靶点导入STRING,将物种定义为“Homo sapiens”,最后将数据导入Cytoscape 软件进行可视化,绘制PPI 网络图[15]。
1.2.5 GO 和KEGG 富集分析 将交集靶点导入DAVID 数据库中,进行GO 和KEGG 富集分析,以P<0.05 为标准,获得相关结果。将数据导入R 软件进行可视化分析。
1.2.6 细胞培养 将人非小细胞肺癌A549 细胞培养于含10%胎牛血清及1%双抗的1640 培养基中,置于37 ℃、5% CO2的恒温培养箱中培养。
1.2.7 人参-甘草溶液制备 将人参、甘草药材烘干粉碎,将人参、甘草于4:1 比例称质量,置于圆底烧瓶中,加入8 倍量去离子水,浸泡8 h,待煮沸后加热回流提取30 min,4 层纱布滤过,回流提取2 次,合并提取液。
1.2.8 MTT 比色法测定细胞增殖 参考廖景光等[16]的方法,取对数生长期的人非小细胞肺癌A549 细胞以2000 个/孔接种于96 孔板,每组6 个复孔,分别用0、12.5、25、50、100、200、300、400、600、800 μg/mL浓度的人参-甘草溶液(人参:甘草=4:1)处理12 h/24 h后每孔加入200 μL 终浓度为0.5 mg/mL 的MTT 溶液,37 ℃孵育4 h,弃去培养基,每孔加DMSO 150 μL低速振荡10 min,置酶标仪于570 nm 测定各孔的光密度(OD)值。4 次重复实验,取其平均值。
1.2.9 流式细胞仪检测细胞凋亡 参考张春晶等[17]的方法,取人非小细胞肺癌A549 细胞,以2×105个每孔接种于6 孔板,用0、1、2、4 mg/mL 浓度人参-甘草溶液处理24 h 后,经预冷的磷酸缓冲盐溶液(PBS)漂洗,用500 μL 的Binding Buffer 重悬细胞。加入Annex-in V-FITC 轻轻吹匀,再加入5 μL的PI 混匀,室温避光反应15 min,采用流式细胞仪检测细胞凋亡情况。
1.3 数据处理
所有检测均至少测定3 次,数据采用GraphPad Prism 软件进行分析,以均值±标准差(±SD)表示。组间比较采用单因素方差分析评估,P<0.05 表示其具有统计学意义。
2 结果与分析
2.1 人参-甘草中活性成分的筛选
检索TCMSP 数据库,得到了人参活性成分22 个,甘草活性成分92 个,其中山柰酚(kaempferol)是人参、甘草共有的成分。人参的活性成分主要为谷甾醇(beta-sitosterol)、二醇(diop)、人参萜二醇(panaxadiol)、苏齐内酯(suchilactone);甘草的活性成分主要为槲皮素(quercetin)、甘草宁B(Gancaoning B)、7-甲氧基-4'-羟基异黄酮(7-Methoxy-2-methyl isoflavone)、甘草宁A(Gancaoning A)、黄烷酮(licoisoflavanone)等,表1 列举出了OB 值前15的有效成分。
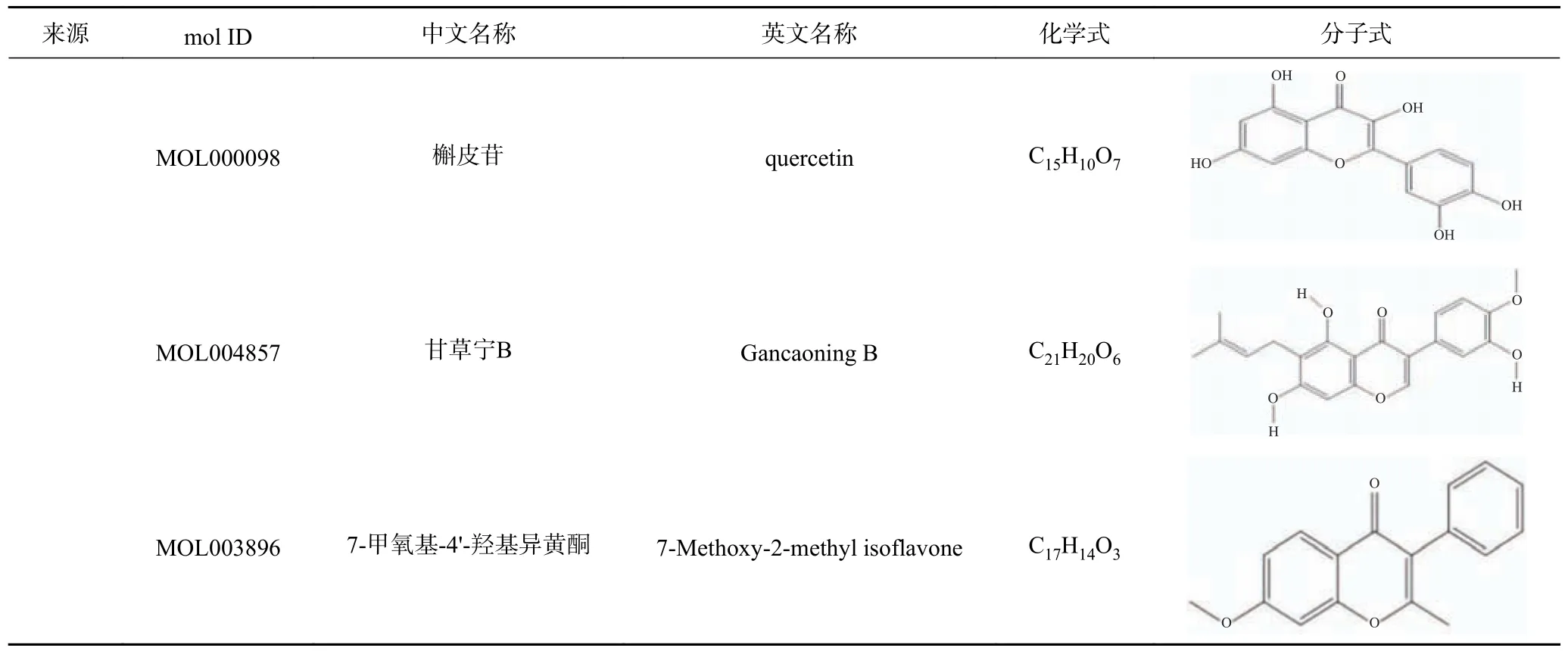
表1 15 种成分的基本信息Table 1 Basic information of 15 optimal components
2.2 交集靶点信息
检索TCMSP 数据库,得到人参和甘草的成分靶点1989 个,使用Uniprot 数据库进行校正,将靶点名(Target name)转换为基因名(Gene Name);使用数据库CTD、TTD、Gene Cards 获取非小细胞肺癌靶点,去除重复靶点;最后整合药物与疾病的靶点,利用Draw Veen Diaram 对交集靶点进行可视化处理,可知药物-疾病交集靶点共170 个,如图1 所示。

图1 药物疾病交集靶点Veen 图Fig.1 Veen diagram of intersection targets of drug diseases
2.3 构建药物-疾病交集靶点PPI 网络图
把170 个交集靶点输入STRING 数据库,所得结果导入Cytoscape 软件进行可视化。PPI 网络中共包含节点169 个,边3128 条,节点越大,颜色越深,则degree 越高,表明这些靶点占据网络核心[18],因此本文列举出了前15 的交集靶点及其相关信息(表2)。如图2 所示,度值排在前列的靶点包括苏氨酸蛋白激酶1(AKT1)、细胞性肿瘤抗体P53(TP53)、肿瘤坏死因子(TNF)、白细胞介素-6(IL6)、半胱天冬酶3(CASP3)、Myc 原癌基因蛋白(MYC)、等,表明这些靶点与药对人参-甘草作用非小细胞肺癌有着直接的关系。
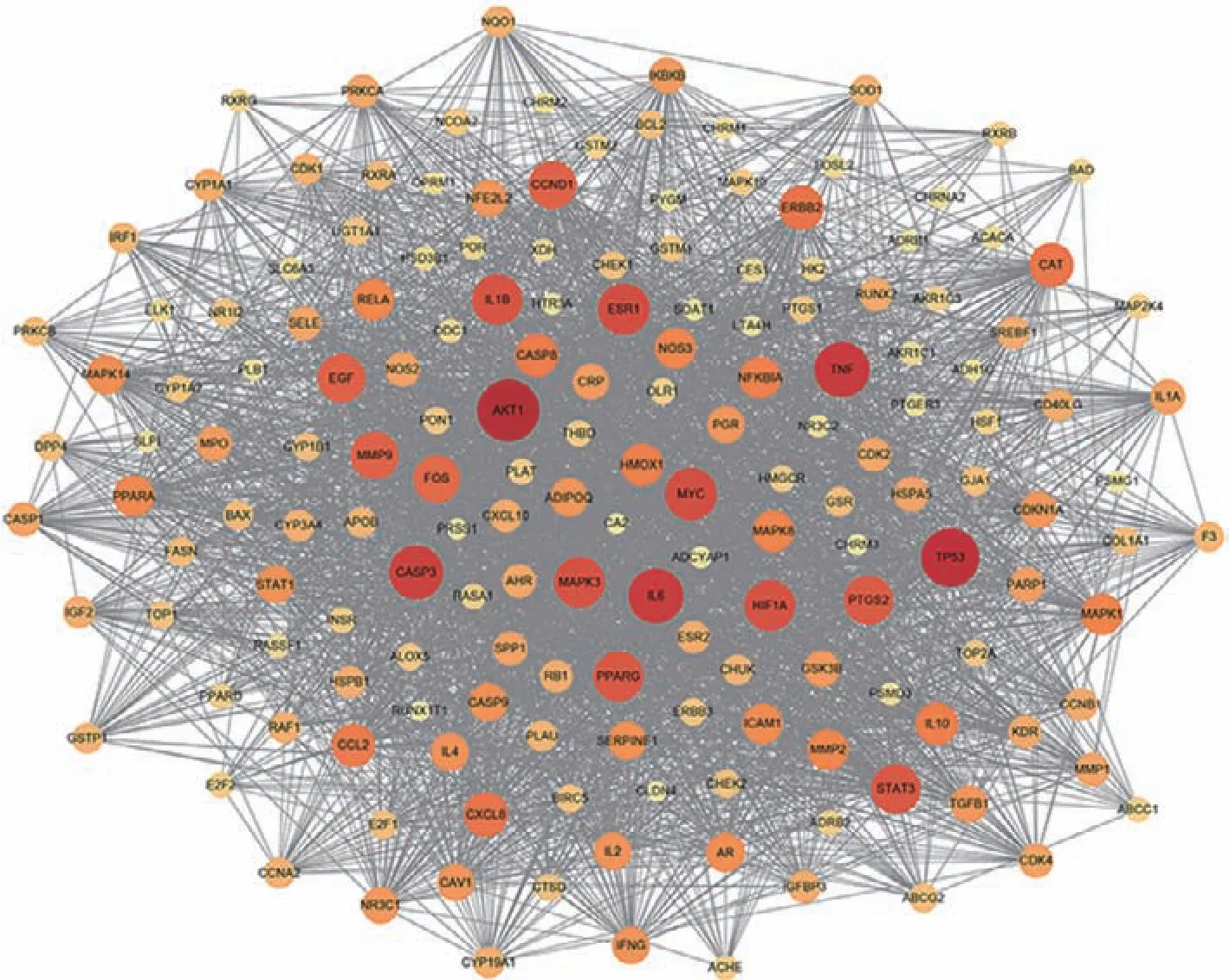
图2 交集靶点相互作用网络图Fig.2 Key gene protein interaction network map
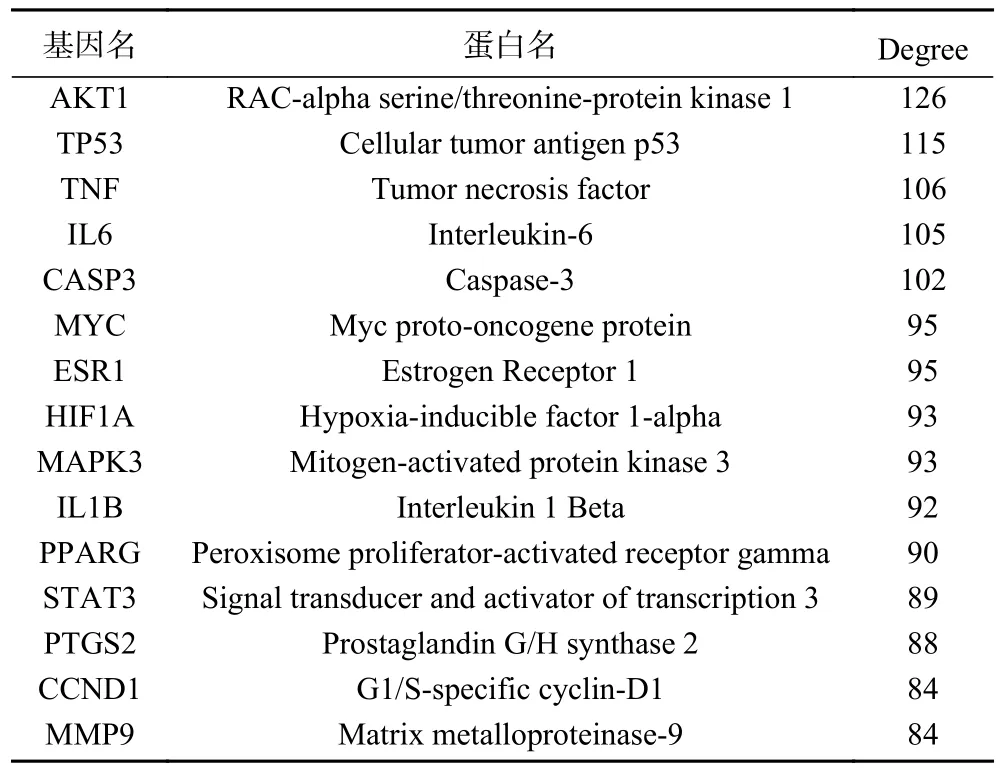
表2 15 个甘草、人参成分的潜在靶点信息Table 2 Potential targets of Radix Glycyrrhizae and ginseng
2.4 构建GO 和KEGG 通路富集结果网络图
将所得交集靶点导入到DAVID 数据库中,进行GO 和KEGG 富集分析,以P<0.05 为筛选标准。得到GO 富集分析条目共821 条:BP 条目629条,主要涉及RNA 聚合酶Il 启动子的转录正调控、转录阳性,DNA 模板化、凋亡过程的负调控、药物反应、凋亡等生物过程;CC 条目65 个,涵盖了内核、胞质、细胞质、核浆、细胞外空隙等细胞成分;MF 条目127 个,主要涉及蛋白结合、酶结合、转录因子等。KEGG 通路富集分析包含KEGG 通路169 条,如图3 其中涉及与癌症相关的17 条,主要包括非小细胞肺癌通路、肺癌通路、癌症通路、TNF 信号通路、T 细胞受体信号通路等。

图3 人参-甘草GO 功能注释和KEGG 通路富集分析Fig.3 Enrichment analysis of GO and KEGG pathways for potential targets of ginseng and licorice active ingredients
2.5 药物-活性成分-靶点网络图
将人参-甘草活性成分以及成分对应靶点输入Cytoscape 3.7.1 软件,构建药物-活性成分-靶点网络图。网络中节点(Node)代表药对人参-甘草成分与靶点,其中黄色菱形代表药对人参-甘草的成分,绿色圆形代表成分靶点;网络中的边(Edge)用于连接成分与靶点,整个网络展示药物-成分-靶点之间的联系,分析网络图(图4),可知网络图中包含节点(node)362 个,边(edge)20 条。证明人参-甘草通过多个药效成分调控多个靶点发挥抗非小细胞肺癌作用。
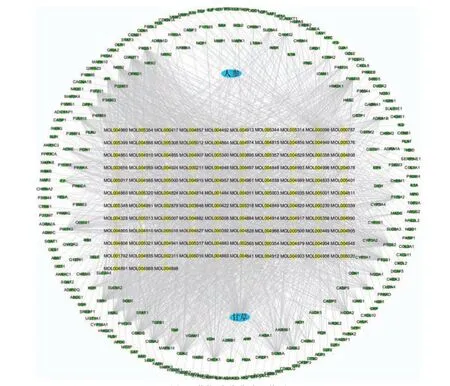
图4 药物-成分-靶点网络图Fig.4 Active ingredient - key target gene network map
2.6 人参-甘草对肿瘤细胞增殖的影响
与对照组相比,人参-甘草溶液对细胞人非小细胞肺癌A549 细胞具有抑制作用。前人研究表明,细胞增殖是肿瘤生长和发展的基础,而人参与甘草提取物溶液对A549 细胞均有不同程度抑制作用[17,19-20]。处理12 h 后,600、800 μg/mL 组抑制率与对照组相比显著性降低(P<0.05,P<0.01)。处理24 h 后,100、200、300、400、600、800 μg/mL 组与对照组相比,抑制率降低,有极显著性差异(P<0.01),如表3。这种抑制作用在实验范围内与溶液浓度、作用时间均呈正相关,会随着作用时间的增加或作用浓度的升高而增长。以上结果说明人参-甘草显著抑制人非小细胞肺癌A549 细胞增殖,并呈时间-剂量依赖性。这一结果与前人的研究基本一致。
表3 不同浓度人参-甘草溶液对细胞抑制率的影响( ±SD)Table 3 Effect of different concentrations of ginseng-licorice solution on cell inhibition rate ( ±SD)

表3 不同浓度人参-甘草溶液对细胞抑制率的影响( ±SD)Table 3 Effect of different concentrations of ginseng-licorice solution on cell inhibition rate ( ±SD)
注:与对照组相比,*P<0.05,**P<0.01。
组别N12 h24 h对照组300 12.5 μg/mL组30.07±0.020.12±0.04 25 μg/mL组30.19±0.010.47±0.03 50 μg/mL组30.35±0.020.92±0.02 100 μg/mL组30.39±0.024.49±0.01**200 μg/mL组30.40±0.038.85±0.04**300 μg/mL组30.95±0.0112.63±0.06**400 μg/mL组31.30±0.0313.56±0.01**600 μg/mL组31.81±0.02*14.22±0.03**800 μg/mL组33.38±0.02**15.50±0.05**
2.7 人参-甘草对肿瘤细胞凋亡的影响
细胞凋亡是指细胞在特定基因的控制下,受到多个基因严格控制而发生的自动死亡过程[21]。诱导细胞凋亡是消除肿瘤细胞的有效治疗方法。不同浓度人参-甘草溶液(1、2、4 μg/mL)处理人非小细胞肺癌A549 细胞24 h 后,采用流式细胞术检测其对细胞凋亡的影响。图5 中左上象限代表坏死细胞,左下象限代表正常细胞,右上象限代表晚期凋亡细胞,右下象限代表早期凋亡细胞。与对照组相比,1、2、4 μg/mL 组中凋亡细胞明显增多,正常细胞明显减少,凋亡率分别为6.11%、10.69%、84.16%(表4)。与对照组相比,随浓度增加人非小细胞肺癌A549 细胞凋亡率明显上升。结果表明人参-甘草诱导肿瘤细胞凋亡,呈明显浓度依赖性。本文的研究结果与现有文献报道一致[17,19-20]。

图5 不同浓度人参-甘草溶液对细胞凋亡的影响Fig.5 Effect of different concentrations of Ginseng-Licorice solution on cell apoptosis
表4 不同浓度人参-甘草溶液对细胞凋亡率的影响( ±SD)Table 4 Effect of different concentrations of ginseng-licorice solution on cell apoptosis rate ( ±SD)

表4 不同浓度人参-甘草溶液对细胞凋亡率的影响( ±SD)Table 4 Effect of different concentrations of ginseng-licorice solution on cell apoptosis rate ( ±SD)
注:与对照组相比,*P<0.05,**P<0.01。
组别N凋亡率(%)对照组33.07±0.38 1 mg/mL组36.11±0.30**2 mg/mL组310.69±0.51**4 mg/mL组384.16±0.41**
3 讨论与结论
近年来中药对NSCLC 治疗的显著疗效受到了科研工作者的关注,中药配伍作用于NSCLC 疗效机制的现代研究也越来越多。Hu 等[22]研究发现红花岩黄耆-莪术可通过调节PI3K/Akt 信号通路,有效抑制NSCLC 细胞增殖和迁移;赵粤[23]研究发现黄芪-半枝莲通过改善NSCLC 模型小鼠炎症状态,调节肠道菌群组成来发挥抗肿瘤作用;赵梦倩[24]研究发现黄芪-半枝莲可通过影响NSCLC 相关因子TNF-α、TGF-β及IL-6 的表达水平而发挥抗肿瘤作用,抑制NSCLC 细胞增殖。药食同源中药在抗肿瘤作用中存在巨大的潜力,因此本研究运用网络药理学方法分析人参-甘草对非小细胞肺癌的有效成分、潜在靶点和作用机制,并结合体外细胞实验MTT 比色法检测活性及流式细胞术检测凋亡对药理作用进行验证。
从PPI 网络图结果分析,可初步确定苏氨酸蛋白激酶1(AKT1)、细胞性肿瘤抗体P53(TP53)、肿瘤坏死因子(TNF)、白细胞介素-6(IL6)、半胱天冬酶3(CASP3)、Myc 原癌基因蛋白(MYC)等是人参-甘草治疗非小细胞肺癌的关键靶点。其中靶点AKT1 是一种蛋白激酶,AKT1 基因位点的突变与肿瘤的发生及生成关系密切,对细胞的增殖和生长均有影响[25-26]。TP53 是公认的抑癌基因,TP53 蛋白调节有多种细胞功能,如DNA 合成和修复、细胞周期阻滞、衰老和凋亡[27]。IL-6 是一种细胞因子,主要与炎症反应相关,白细胞介素现在被认为是连接炎症和癌症的重要介质[28]。TNF 则是癌症诱导炎症主要介质[29]。CASP3 是细胞凋亡中重要的蛋白酶,在细胞凋亡过程中被激活,并可通过多种作用机制影响肿瘤细胞的增殖凋亡[30-31]。MYC 基因由3 个副同源物C-MYC、N-MYC 和L-MYC 组成,是人类癌症中最常失调的驱动基因之一,MYC 表达和阻断已被证明参与肿瘤发生发展[32]。综上,人参-甘草可通过调控上述包括核心靶点在内的众多靶点起到治疗的NSCLC 作用。
KEGG 代谢通路富集分析结果显示,人参-甘草可能对非小细胞肺癌通路、肺癌通路、TNF 信号通路、T 细胞受体信号通路具有调控作用。在肿瘤的表达中,活化的AKT1 磷酸化下游底物,可调节细胞的凋亡、血管生成和药物反应[33]。且有数据表明AKT1 是不吸烟肺癌患者中最常见的单基因突变之一[34]。这提示,AKT 信号通路可能进一步作为癌症治疗的潜在分子通路。TNF 能控制免疫系统的发育,细胞存活信号通路,增殖并调节代谢过程,已经被证明具有选择性抗肿瘤活性[29,35]。TNF 中相关的凋亡配体TRAIL 可通过磷脂酰肌醇3'-激酶(PI3-K)激活AKT,从而阻断线粒体依赖凋亡通路中细胞色素c 释放的上游的Bid 裂解,诱导NSCLC 细胞存活[36]。以上体现了人参-甘草中的活性成分的多个靶点可通过多条代谢通路来干预NSCLC 的发生发展。
本研究通过MTT 比色法检测人参-甘草抑制人非小细胞肺癌A549 细胞增殖活性,结合抑制率的变化趋势可知,人参-甘草抑制A549 细胞活性对浓度和作用时间有依赖性。在一定范围内,其抑制作用与提取物浓度和作用时间均呈正相关。随后用细胞凋亡术测定人参-甘草诱导肿瘤细胞凋亡作用,结果表明人参-甘草诱导肿瘤细胞凋亡,呈明显浓度依赖性。从而进一步确定了人参-甘草对NSCLC 细胞的药效学作用。
综上所述,人参-甘草可能的抗非小细胞肺癌机制为,其中的活性成分山柰酚、槲皮苷、甘草宁B、7-甲氧基-4'-羟基异黄酮、甘草宁A、黄烷酮等多种活性物质通过AKT1、TP53、TNF、IL6、CASP3、MYC等靶点作用于NSCLC,通过TNF/AKT 信号通路、非小细胞肺癌通路、肺癌通路、T 细胞受体信号通路等多重信号通路最终干预NSCLC 的发生发展。体外实验进一步验证人参-甘草对NSCLC 有显著抑增殖、促凋亡作用。这为进一步深入的研究提供了新的理论基础,为临床上人参-甘草治疗NSCLC 提供了新思路。
