胺碘酮导管灌注对射频消融术后家兔心射频损伤灶、心肌细胞凋亡及心功能的影响*
2023-08-12黄明伟许朝祥张文兵王耀国
黄明伟 许朝祥 徐 源 张文兵 王耀国
(福建医科大学附属第二医院心血管内科,泉州 362000)
心房颤动(atrial fibrillation,AF,简称房颤)是心缺乏规律的电活动,通常表现为快速无序状态,可引起血流动力学改变,继发房颤后形成血栓,致残率及致死率升高[1]。射频消融技术是一种具有微创、高效及安全的治疗方法。射频消融技术本质是一种电磁波,通过使电极接触生物组织,不断变化电场产生热量,进而改变组织细胞活性[2]。但射频消融技术仍存在一定不足之处,治疗过程中阻断血流供应,增加心肌组织损伤[3]。胺碘酮是一种Ⅲ类抗心律失常药物,具有轻度Ⅰ类、Ⅱ类抗心颤药物的作用[4]。研究显示,在阵发性房颤患者采用射频消融技术联合胺碘酮导管灌注可以改善肺静脉电隔离效率的同时大大降低复发率[5]。笔者推测射频消融过程中持续灌注胺碘酮可使胺碘酮聚集于射频消融损伤灶的心局部组织。为此,本研究通过家兔实验,探讨射频消融过程中持续灌注胺碘酮,局部心脏消融组织病理损伤是否进一步加深加重,从而提高临床疗效,为阵发性房颤的防治提供新的思路。
1 材料和方法
1.1 实验动物
清洁级新西兰兔,雌雄各半,3~4 月龄,体质量2.0~2.5 kg,购自福建医科大学实验动物中心,动物许可证号SCXX(闽)2021-0015。动物于清洁级动物实验室适应性饲养7 d,温度23℃~25℃、湿度45%~55%,自由进食饮水。动物实验经福建医科大学医学动物实验伦理委员会批准(批准号LL219102002)。
1.2 药物、主要试剂与仪器
盐酸胺碘酮注射液(海润都制药股份有限公司,国药准字:H20045108);戊巴比妥钠(上海上药新亚有限公司,注射用水稀释为2%溶液);Bax、Bcl-2、caspase-3 及caspase-9 单抗(艾比玛特医药科技(上海);TUNEL 细胞凋亡检测试剂盒(南京凯基生物公司);自动生化分析仪(Au5400,Beckman Coulter Inc,Massachusetts,CA,USA);蛋白电泳仪(北京六一仪器厂)。
1.3 动物模型建立
所有家兔均饲养在相同实验室内,建立房颤模型[6]。采用2%戊巴比妥钠(40 mg/kg)麻醉家兔,在机械通气下进行无菌胸廓切开术,暴露心房分离肺静脉,将双极电极植入家兔右侧心房,后连接起搏器,在肺静脉上进行间距为5 mm 的电刺激,恢复7 d 后,采用心电图确保心房快速起搏为建模成功。假手术组仅进行开胸手术后缝合。实验方案均经动物实验伦理委员会批准。
1.4 分组及干预方法
40 只家兔分为假手术组、房颤模型组(模型组)、射频消融组及射频+胺碘酮组,各组均10 只,家兔建模过程中由于术后感染死亡4 只;模型组、射频消融组及射频+胺碘酮组家兔分别为8 只、9只及9 只。射频消融组采用射频消融方法治疗:家兔消毒后保持右侧卧位,采用飞利浦IU Elite 型多普勒超声进行引导,将探头在心尖非标准采用导线进行定位,以心室间隔长轴与引导线之间的夹角,且与引导线进行重叠处进行穿刺。射频针经胸壁肋间穿刺达到心室隔基底部。整个进针过程采用超声实施监测,避免损伤柯氏三角区。采用剃毛刀将兔胸前毛剔除干净,用手术刀作一长3~4 cm 的切口,深至深筋膜,然后采用止血钳对筋膜下肌肉进行钝性分离。在暴露3/4肋骨后,对2 根肋间动脉进行手术结扎,防止血液流出充满胸腔无法进行后期实验。肋间动脉结扎完毕后,沿着肋间动脉远心端剪断2 根肋骨使胸腔完全暴露于空气中,随后采用扩胸器撑开胸廓找到心,并对表面的心包进行小心剥离至完全暴露心。在左心房根部找到左心耳部位,并用医用缝合线将其稍微提起。采用大头直径4mm Celsius 四极温控消融导管,根据参数起始功率30 W,后按照10~15 W/min 逐渐加大功率,最大功率为80 W 进行消融,在家兔左心耳根部进行点线成环状消融。
假手术组穿刺过程与其他组别相同,但是不进行消融。消融结束后所有家兔采用0.2 mL/kg的六氟化硫微泡(商品名:声诺维)进行心肌声学造影,评估射频消融范围。射频+胺碘酮组在进行射频消融过程中,胺碘酮用5%葡萄糖肝素化溶液稀释500 mL,浓度为300 μg/mL,滴速为17 mL/min,通过导管持续灌注消融点;射频消融组使用0.9%肝素化生理盐水,通过导管持续灌注消融点。
1.5 心电图
2%戊巴比妥钠腹腔麻醉各组家兔,固定后采用电子心电图进行肢体导联,记录各组家兔心电图。建模家兔会发生阵发性房颤;F 波出现、P 波消失为房颤,F 波消失、P 波出现为房颤终止,记录各组家兔房颤的诱发时间及持续时间。
1.6 心功能
家兔胸部脱毛,采用彩色多普勒超声诊断仪检测各组家兔左心室射血分数(left ventricular ejection fraction,LVEF)、左心室缩短分数(left ventricular fractional shortening,LVFS)、左心室收缩末期内径(left ventricular endsystolic diameter,LVESD)、左心室舒张末期内径 (left ventricular end-diastolic diameter,LVEDD)。
1.7 H-E 染色检测损伤灶病理损伤
各组家兔颈椎脱臼处死,剥离心,0.9% 生理盐水清洗后切片,10%甲醛溶液固定,纵向切片,脱钙,石蜡包埋切片4 μm,二甲苯脱蜡,苏木精染色,盐酸处理,伊红复染,乙醇脱水,封片后观察组织形态。
1.8 透射电镜观察心房超微结构
左心房组织采用3%戊二醛固定后,采用醋酸双氧铀溶液和柠檬酸铅溶液进行组织染色,采用日本电子JEM-1200EX 透射电镜观察心肌组织超微结构,电压为70 kV,放大倍数为5 000~20 000。
1.9 TUNEL 法检测心肌细胞凋亡率
心肌组织包埋切片,乙醇脱水,PBS 冲洗,加入20 μg/mL 的蛋白酶K 溶液,在23 ℃下孵育30 min,PBS 冲洗后,放入3% H2O2,15 min 后再次PBS 冲洗,加入50 μL 的TUNEL 反应液,37℃下孵育60 min。PBS 冲洗,加入50 μL 转化剂过氧化物酶,凋亡呈现荧光黄色,每张切片选择5 个非重叠视野,计算细胞凋亡率,细胞凋亡率=凋亡细胞数/总细胞细胞数×100%。
1.10 免疫印迹检测Bax、Bcl-2、caspase-3及caspase-9蛋白水平
心室肌组织PBS 冲洗后切碎,加入1 mL 的细胞裂解液,3 000 r/min 4℃离心5 min,取上清液,加入样孔中,采用BCA 法检测总蛋白浓度,每孔上样蛋白量20 μg,SDS-PAGE 凝胶电泳。转印缓冲液配制好后放入4℃冰箱内预冷,然后全部转移到PVDF 膜上,再加入脱脂奶粉,全程封闭时长为1 h。加入一抗Bax(1∶500)、Bcl-2(1∶500)caspase-3(1∶500)及caspase-9(1∶500),TTBS漂洗,4℃过夜,加入羊抗兔IgG 二抗(1∶2 500),ECL 化学发光试剂系统JY-Clear 分析蛋白值。
1.11 统计学处理
数据采用GraphPad Prism 8 软件进行分析及统计,各组数据服从正态分布,计量资料数据采用±s描述,多组间比较采用方差分析,事后检验采用Bonferroni 法进行组间两两比较。P<0.05 表示差异有统计学意义。
2 结果
2.1 心电图比较
假手术组家兔心电图可见明显P 波,房颤模型组家兔P 波消失,出现典型F 波说明房颤模型建立成功。射频消融组及射频+胺碘酮组家兔心电图明显改变,F 波逐渐消失(图1)。与假手术组相比,模型组心率(HR)升高,RR 间期降低,QRS 及QT间期升高(P<0.05);与模型组相比,射频消融组房颤诱发时间延长,持续时间更短,HR 降低,RR间期升高,QRS 及QT 间期降低(P<0.05);与射频消融组相比,射频+胺碘酮组房颤诱发时间延长,持续时间更短,HR 降低,RR 间期升高,QRS 及QT 间期降低(P<0.05)(表1)。
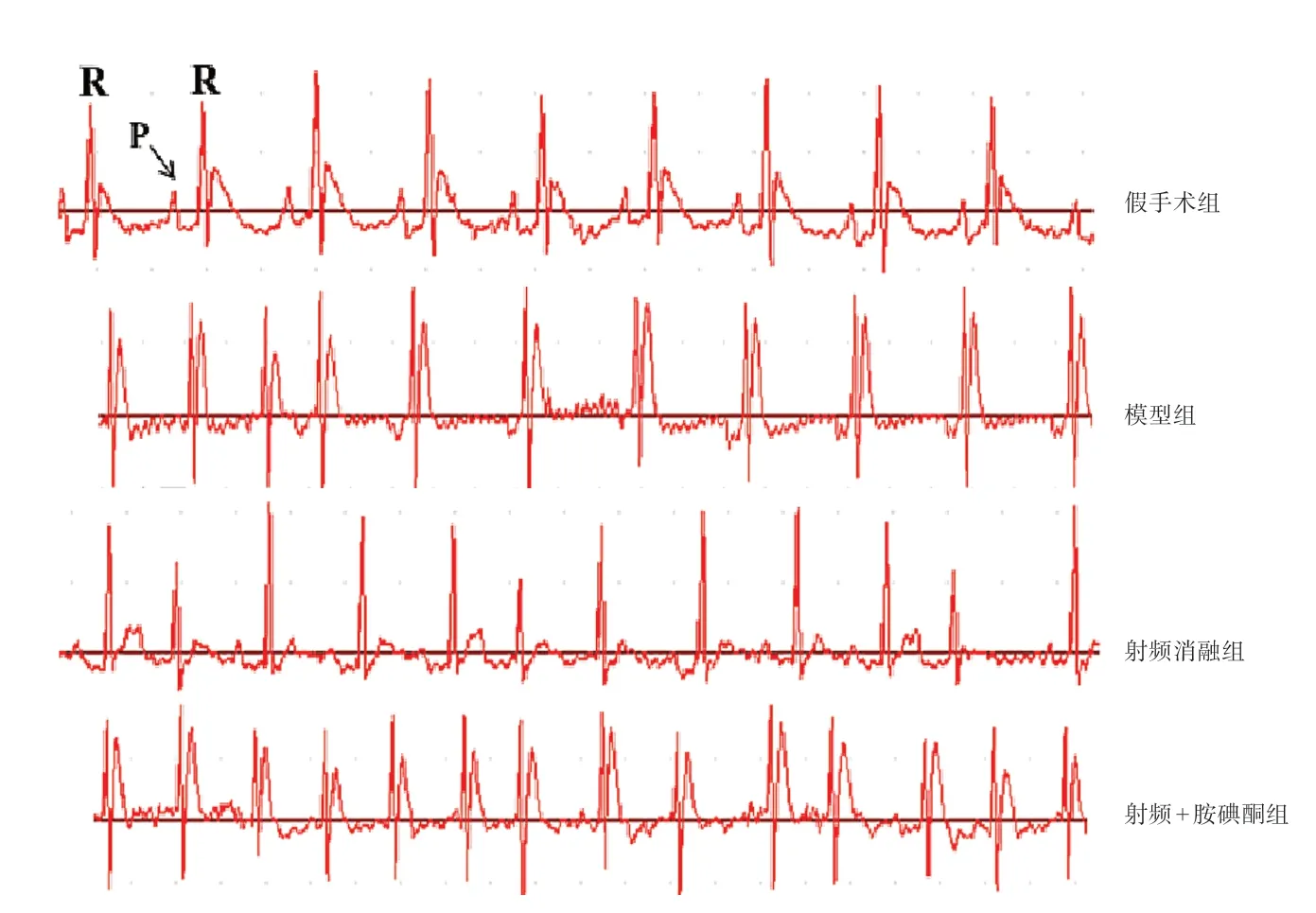
图1 各组家兔心电图比较
表1 各组家兔房颤诱发时间及持续时间比较(±s)
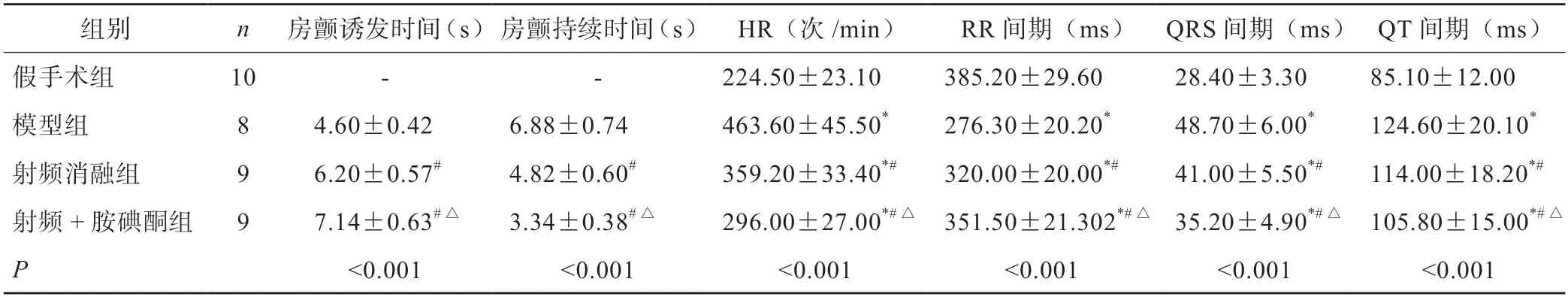
表1 各组家兔房颤诱发时间及持续时间比较(±s)
*P<0.05 vs 假手术组;#P<0.05 vs 模型组;△P<0.05 vs 射频消融组
组别n房颤诱发时间(s)房颤持续时间(s) HR(次/min)RR 间期(ms) QRS 间期(ms) QT 间期(ms)假手术组10--224.50±23.10385.20±29.6028.40±3.3085.10±12.00模型组84.60±0.426.88±0.74463.60±45.50*276.30±20.20*48.70±6.00*124.60±20.10*射频消融组96.20±0.57#4.82±0.60#359.20±33.40*#320.00±20.00*#41.00±5.50*#114.00±18.20*#射频+胺碘酮组97.14±0.63#△3.34±0.38#△296.00±27.00*#△ 351.50±21.302*#△ 35.20±4.90*#△ 105.80±15.00*#△P<0.001<0.001<0.001<0.001<0.001<0.001
2.2 各组家兔心功能比较
与假手术组相比,模型组家兔LVEF、LVFS降低,LVESD及LVEDD升高(P<0.05)。与模型组相比,射频消融组家兔LVEF、LVFS升高,LVESD及LVEDD 降低(P<0.05)。与射频消融组相比,射频+胺碘酮组家兔LVEF、LVFS 升高,LVESD及LVEDD 降低(P<0.05)(表2)。
表2 各组家兔心功能比较(±s)
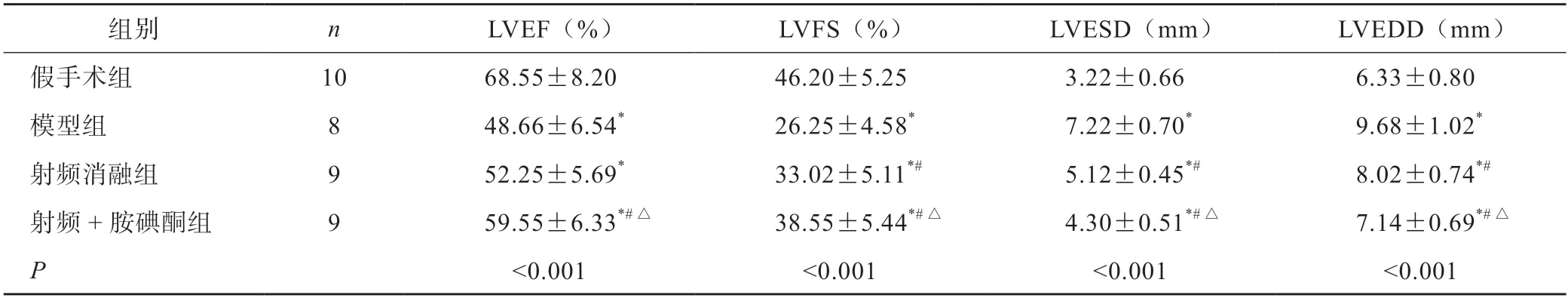
表2 各组家兔心功能比较(±s)
*P<0.05 vs 假手术组;#P<0.05 vs 模型组;△P<0.05 vs 射频消融组
组别nLVEF(%)LVFS(%)LVESD(mm)LVEDD(mm)假手术组1068.55±8.2046.20±5.253.22±0.666.33±0.80模型组848.66±6.54*26.25±4.58*7.22±0.70*9.68±1.02*射频消融组952.25±5.69*33.02±5.11*#5.12±0.45*#8.02±0.74*#射频+胺碘酮组959.55±6.33*#△38.55±5.44*#△4.30±0.51*#△7.14±0.69*#△P<0.001<0.001<0.001<0.001
2.3 各组家兔心射频损伤灶病理形态比较
假手术组家兔心肌组织结构完整,心肌细胞排列整齐及致密。模型组家兔心肌组织结构紊乱,心肌细胞排列紊乱、肥大,细胞间隙增加。射频消融组心肌组织结构紊乱增加。射频消融+胺碘酮组家兔心肌结构紊乱程度降低,心肌细胞间隙缩小(图2)。
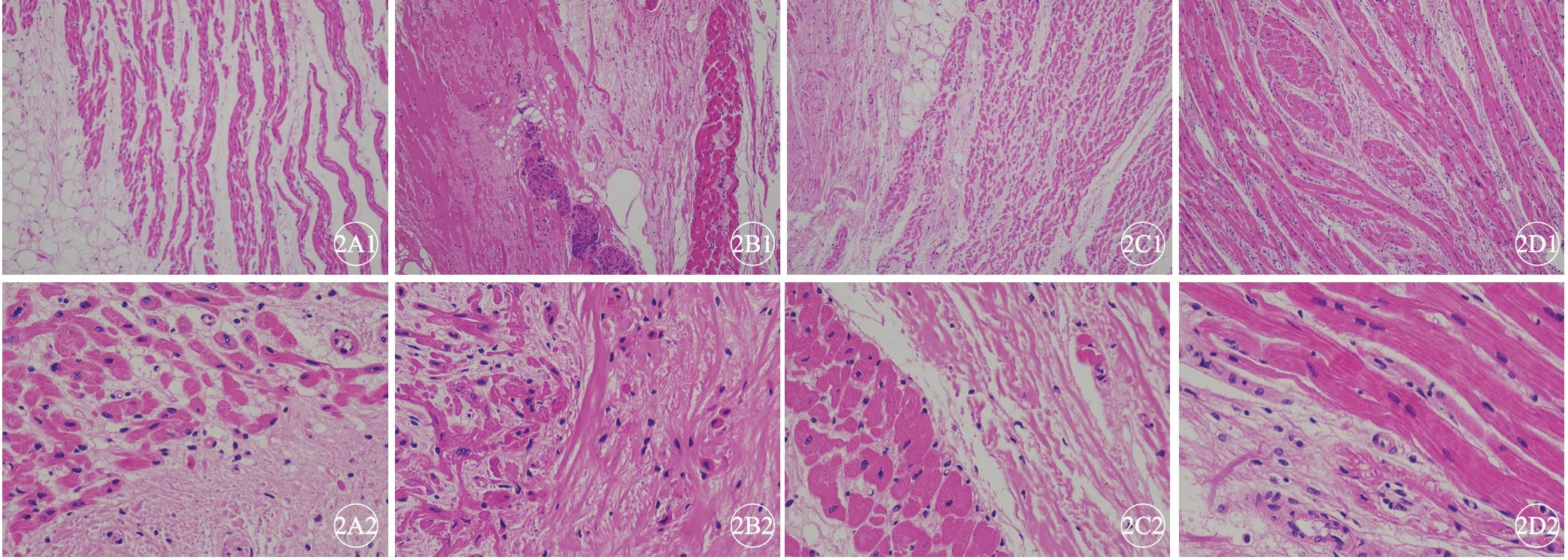
图2 各组家兔心射频损伤灶病理形态比较,H-E 染色。A:假手术组;B:模型组;C:射频消融组;D:射频+胺碘酮组;A1~D1:×100;A2~D2:×400.
2.4 各组家兔心肌组织形态
透射电镜结果显示,假手术组家兔心肌细胞肌节排列整齐,线粒体完好。与假手术组相比,模型组及射频消融组心肌细胞肌节排列紊乱且线粒体严重肿胀变形。与模型组相比,射频消融组紊乱更加严重。与射频消融组相比,射频+胺碘酮组心肌细胞肌节紊乱改变,线粒体肿胀现象好转(图3)。
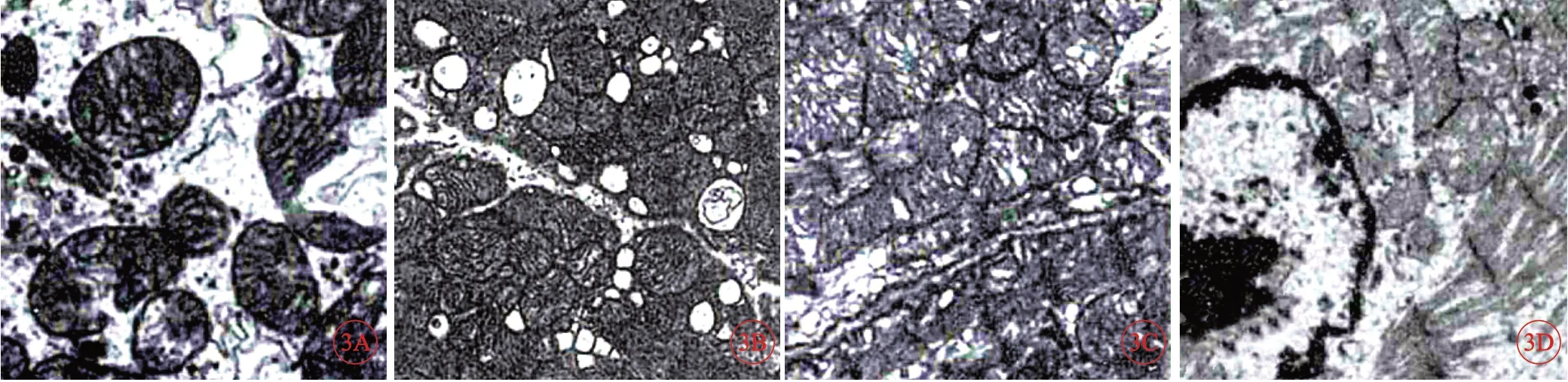
图3 各组家兔心肌组织电镜结果,×20 000。A:假手术组;B:模型组;C:射频消融组;D:射频+胺碘酮组.
2.5 各组家兔心肌细胞凋亡率比较
与假手术组心肌细胞凋亡率(4.30%±0.50%)相比,模型组家兔心肌细胞凋亡率(12.15%±1.35%)升高(P<0.05)。与模型组相比,射频消融组心肌细胞凋亡率(32.25%±3.66%)升高(P<0.05)。与射频消融组相比,射频+胺碘酮组心肌细胞凋亡率(25.66%±2.51%)降低(P<0.05),(图4)。
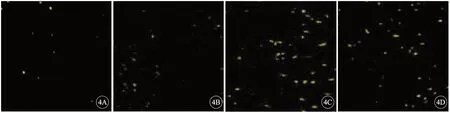
图4 TUNEL 法检测各组家兔心肌细胞凋亡,×200。A:假手术组;B:模型组;C:射频消融组;D:射频+胺碘酮组.
2.6 各组家兔心肌Bcl-2、Bax、caspase-3 及caspase-9蛋白表达比较
与假手术组相比,模型组Bcl-2降低,Bax、caspase-3及caspase-9升高(P<0.05)。与模型组相比,射频消融组Bcl-2降低,Bax、caspase-3及caspase-9升高(P<0.05)。与射频消融组相比,射频+胺碘酮组Bcl-2升高,Bax、caspase-3及caspase-9降低(P<0.05)(图5,表3)。
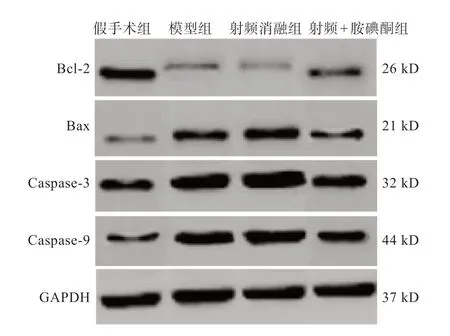
图5 各组家兔Bcl-2、Bax、caspase-3 及caspase-9 蛋白免疫印迹检测电泳条带
表3 各组家兔Bcl-2、Bax、caspase-3 及caspase-9 蛋白表达比较(±s)
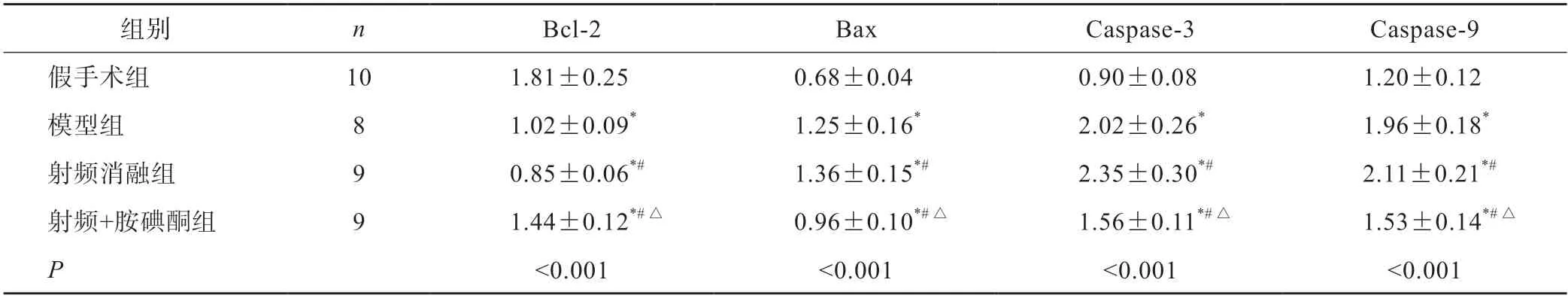
表3 各组家兔Bcl-2、Bax、caspase-3 及caspase-9 蛋白表达比较(±s)
*P<0.05 vs 假手术组;#P<0.05 vs 模型组;△P<0.05 vs 射频消融组
组别nBcl-2BaxCaspase-3Caspase-9假手术组101.81±0.250.68±0.040.90±0.081.20±0.12模型组81.02±0.09*1.25±0.16*2.02±0.26*1.96±0.18*射频消融组90.85±0.06*#1.36±0.15*#2.35±0.30*#2.11±0.21*#射频+胺碘酮组91.44±0.12*#△0.96±0.10*#△1.56±0.11*#△1.53±0.14*#△P<0.001<0.001<0.001<0.001
3 讨论
房颤已经成为严重威胁公众生命健康的疾病之一,对其治疗机制的研究一直是众多学者关注的重点[6]。射频消融可显著改善房颤患者心功能,电极通过稳定电流的物理性穿透力对局部组织产生高热效应,局部心肌组织易产生凝固性坏死而阻断房颤的异位传导从而发挥改善房颤的目的,但同时加快心肌损伤,提高心肌细胞凋亡[7]。
当前临床治疗房颤的主要目的是恢复正常的窦性心律,保证心房心室收缩及舒张的规律性。房颤采用射频消融可以通过保证消融的透壁性和径线的连续性,射频通过稳定电流的物理性具有较好的穿透力对局部组织产生高热效应,形成凝固性坏死而阻断房颤的异位传导,从而发挥改善房颤的目的,延长房颤诱发时间,缩短持续时间。Ⅲ类抗心律失常药物胺碘酮可以通过延长心肌组织的动作电位Q-T 间期的时间及有效不应期,而抑制窦房结和房室结,从而延长房室结传导,故可有效转复房颤。本研究心电图结果显示,射频消融组及射频+胺碘酮组家兔F 波出现延长,房颤持续时间缩短。
心功能检测证实,与模型组比较,射频消融组及射频+胺碘酮组LVEF、LVFS升高,LVESD及LVEDD降低,说明射频消融及胺碘酮均可以改善房颤家兔心功能,且联合效果更佳。房颤可显著增加心室负担,心肌能量供需不平衡、氧化应激增加可导致心功能降低。射频消融作用与消融过程中必须要产生足够大的损伤区域从而彻底阻断异常点兴奋的传导路径而改善心脏功能相关[8]。射频消融术可以降低左心房的直径及容积,并且不降低左心房功能。接受射频消融的房颤患者,快速的心房率转变为规律的窦性心律,心房内压力及容积减少,失去对心肌细胞的过度牵拉作用,使左心房发生逆重构。胡金[15]研究了58 例行导管消融术的心衰合并房颤患者,入选患者的LVEF 值均<45%,对随访患者术后 1、3、6 个月及 12 个月时的 LVEF、左心室内径、症状改善情况、活动耐受力进行评价,平均随访(12±7)月后,78%的患者维持窦性心律,心功能、运动耐量、生活质量及症状都有显著改善。胺碘酮为临床常用的Ⅲ类广谱抗心律失常药物,对心肌中钾离子、钠离子、钙离子及β 受体具有不同程度的阻断作用,并可以显著延长心肌细胞中动作电位时程,缓解心动过速症状。另有研究显示,胺碘酮为苯呋喃衍生物,是多通道阻滞剂,可以改善心房肌及心室肌动作电位时程及有效不应期延长的作用[10]。谢虹等[11]研究显示,对房颤患者采用胺碘酮治疗后心功能显著改善,提示胺碘酮可以通过阻断钠通道而阻断快速心率,增加血流量、降低外周阻力、减少心肌耗氧量等作用。
本研究结果表明,H-E 染色及电镜观察显示房颤大鼠经射频消融治疗后心肌损伤加重,TUNEL法检测心肌细胞凋亡率升高,说明射频消融后心肌组织受损,导致心肌细胞凋亡;射频+胺碘酮治疗后心肌损伤及心肌细胞凋亡率均改善,说明胺碘酮对心具有保护作用。研究表明,射频消融过程中主要病理变化为孤立的、界限清楚的凝固性坏死,这与消融过程中导致的心肌组织多种酶活性改变,降低心肌细胞代谢能量需求导致细胞结构破坏和坏死凋亡相关[12]。射频消融术后患者心脏交感神经及迷走神经损伤,可加快心室重塑导致心肌组织缺血而促进心肌细胞凋亡。房颤患者行射频消融术后会损伤心肌细胞,心房的传导功能出现障碍,心房肌出现收缩不均一现象。虽然有窦性心律的维持,但是房颤消融术后发生心房顿抑,心房及心耳的机械功能下降,导致血流缓慢,因此左房易形成血栓,当血栓脱落时引起临床上一系列血栓栓塞事件。胺碘酮是一种轻度非竞争性的α 及β 肾上腺素受体阻滞剂,亲脂性较高,抗氧自由基能量较强。在犬分离出的心肌细胞中采用电子顺磁共振方法检测自由基,证实胺碘酮可以减少自由基导致的心肌细胞损伤,降低凋亡。Oswald 等[14]研究显示,射频消融过程中可增加局部组织炎症反应,主要表现为肿瘤坏死因子水平升高,并进一步加快氧化应激反应而诱导细胞损伤,但是在3 d 后心肌损伤可逐步改善。胺碘酮可减少氧自由基对细胞损伤,抑制细胞膜脂质过氧化,改善细胞内钙离子负荷,进而发挥抗心肌细胞凋亡的作用[15]。本研究结果表明,射频消融组家兔心肌组织中Bcl-2 降低,Bax、caspase-3及caspase-9 升高,与射频消融组对比,射频+胺碘酮组Bcl-2 升高,Bax、caspase-3 及caspase-9 降低,说明胺碘酮可以通过调节细胞凋亡相关信号通路而抑制心肌细胞凋亡。Bcl-2 家族在调节细胞活性中发挥重要作用[16]。Bax 是Bcl-2 成员之一,主要发挥加快细胞凋亡作用,作用机制在于与Bcl-2 形成同源二聚体,降低了Bcl-2 抗凋亡的同时还可以启动caspase 酶级联反应而上调caspase-3 及caspase-9活性共同发挥促凋亡作用[17-18]。胺碘酮在抗心肌缺血损伤中证实对Bcl-2/Bax 信号具有调节作用,机制可能在于胺碘酮可以调节Bcl-2/Bax 活性而降低心肌细胞凋亡,对心肌组织发挥保护作用[19]。胺碘酮有拮抗兔心肌凋亡的作用,已有研究表明与其可以上调Bcl-2 蛋白,下调Bax 及caspase-3 活性相关[20],本研究与之前研究结果相似。
综上所述,房颤家兔采用射频消融术后心电图及心功能改善,但是心肌组织损伤及心肌细胞凋亡加剧,胺碘酮导管灌注可以减少心肌组织射频损伤,降低心肌细胞凋亡率,具有保护心的作用。
