抗痹颗粒对糖尿病周围神经病变大鼠的疗效和氧化应激的影响
2023-08-12刘晓敏刘广洲张琦玮苏丽红刘志森
刘晓敏 刘广洲 张琦玮 苏丽红 刘志森
(吉林医药学院附属医院,吉林 吉林 132013)
抗痹颗粒为我院院内制剂,由黄芪、党参、当归、玉竹、天花粉、赤芍、桂枝、地龙、川芎、细辛、红花、桃仁、甘草组成,用于临床已有30余年。可以缓解糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)患者肢体麻木,痛觉减退,运动及感觉障碍,具有良好的治疗作用,但具体作用机制未明。因此,本课题拟采用DPN动物模型对抗痹颗粒治疗DPN的作用进行研究,初探其作用机制,为抗痹颗粒临床治疗DPN 奠定理论基础、提供依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SD雄性大鼠40只,体质量(240±20)g,SPF级[购于辽宁长生生物科技股份有限公司,许可证编号SCXK(辽)2021-0001]。
1.1.2 实验药物和试剂盒 抗痹颗粒(吉林医药学院附属医院自制);链脲佐菌素(streptozotocin,STZ,100 mg,sigama);超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、丙二醛(malondialde-hyde,MDA)和谷胱甘肽(glutathione,GSH)试剂盒(南京建成生物工程研究所)。
1.1.3 实验仪器 台式离心机 湖南恒诺仪器设备有限公司,全自动酶标仪BIO-RAD。
1.2 方法
1.2.1 模型制备 SD大鼠喂食40~50 kcal的高能饲料结合单剂量腹腔注射30 mg/kg STZ诱导糖尿病。用STZ后7 d,在禁食12 h后,大鼠尾静脉采血并使用血糖仪测定空腹血糖水平。血糖水平超过11.1 mmol/L的大鼠进入实验。
1.2.2 实验分组、给药 将进入实验的SD大鼠随机分为3组:模型组、抗痹颗粒高剂量组[3.24 g/(kg·d)]、抗痹颗粒低剂量组[0.81 g/(kg·d)],另取10只作为正常组。正常组和模型组给予等容积生理盐水灌胃,抗痹颗粒给药组按剂量灌胃给药,1次/d,给药8周。
1.2.3 检测指标 给予STZ的0、4、8周测量大鼠的体质量,同时在禁食12 h后,尾静脉采集血测定血糖水平。在实验第9周,处死大鼠,切取部分坐骨神经组织置于-80 ℃冰箱待测。按照试剂盒要求用分光光度计测组织内SOD、MDA、GSH、CAT活性水平。
1.2.4 统计学方法 采用SPSS 19.0软件进行统计分析。计量资料用()表示,组间比较采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 体质量 给药0周:与正常组比较,模型组和抗痹颗粒给药组体质量明显升高(P<0.01);与模型组比较,抗痹颗粒给药组体质量无明显差异(P>0.05)。给药4周:与正常组比较,模型组和抗痹颗粒给药组体质量明显升高(P<0.01);与模型组比较,抗痹颗粒低、高给药组体质量明显降低(P<0.05、P<0.01)。给药8周:与正常组相比,模型组体质量无明显差异(P>0.05),抗痹颗粒给药组体质量明显降低(P<0.01);与模型组比较,抗痹颗粒低、高给药组体质量明显降低(P<0.01)。见表1。
表1 各组大鼠体质量变化情况(g,)
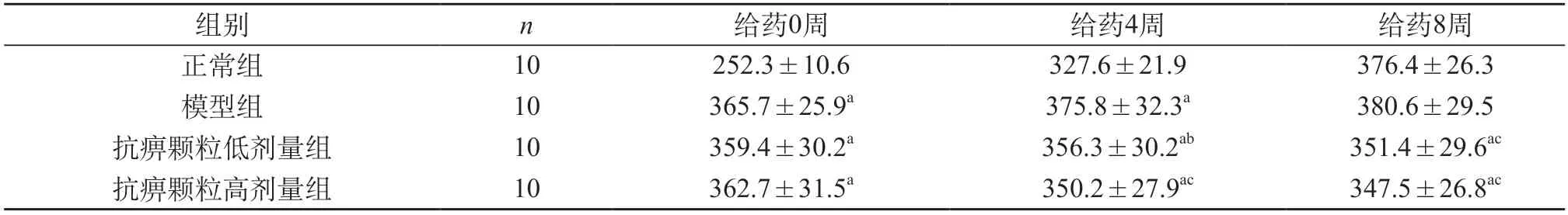
表1 各组大鼠体质量变化情况(g,)
注:与正常组比较,aP<0.01;与模型组比较bP<0.05,cP<0.01。
2.2 血糖 给药0周:与正常组比较,模型组和抗痹颗粒给药组血糖明显升高(P<0.01);与模型组比较,抗痹颗粒给药组血糖无明显差异(P>0.05)。给药4周:与正常组比较,模型组和抗痹颗粒给药组血糖明显升高(P<0.01);与模型组比较,抗痹颗粒低、高给药组血糖明显降低(P<0.05、P<0.01)。给药8周:与正常组相比,模型组和抗痹颗粒给药组血糖明显升高(P<0.01);与模型组比较,抗痹颗粒低、高给药组血糖明显降低(P<0.01)。见表2。
表2 各组大鼠血糖变化情况(mmol/L,)
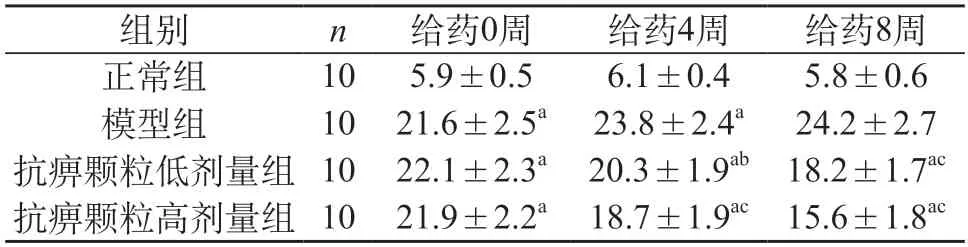
表2 各组大鼠血糖变化情况(mmol/L,)
注:与正常组比较,aP<0.01;与模型组比较bP<0.05,cP<0.01。
2.3 对SOD、MDA、GSH、CAT的影响 给药8周:与正常组比较,模型组和抗痹颗粒低、高剂量给药组SOD明显降低(P<0.01、P<0.05);与模型组比较,抗痹颗粒低、高剂量给药组SOD明显升高(P<0.05、P<0.01)。与正常组比较,模型组和抗痹颗粒低、高剂量给药组MDA含量明显升高(P<0.01);与模型组比较,抗痹颗粒低、高剂量给药组MDA明显降低(P<0.01)。与正常组比较,模型组和抗痹颗粒低、高剂量给药组GSH明显降低(P<0.01);与模型组比较,抗痹颗粒低、高剂量给药组SOD明显升高(P<0.01)。与正常组比较,模型组CAT水平明显降低(P<0.01),抗痹颗粒低、高剂量给药组CAT水平变化无统计学差异(P>0.05);与模型组比较,抗痹颗粒低、高剂量给药组CAT明显升高(P<0.01)。见表3。
表3 各组大鼠氧化应激指标变化情况()
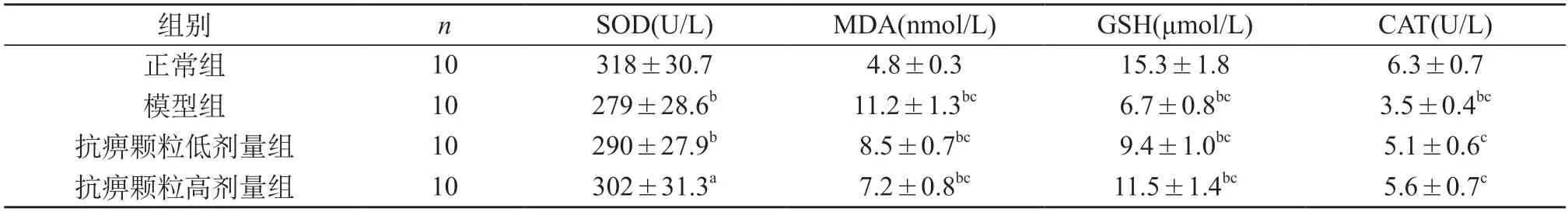
表3 各组大鼠氧化应激指标变化情况()
注:与正常组比较,aP<0.05,bP<0.01;与模型组比较cP<0.01。
3 讨论
DPN是糖尿病最常见的慢性并发症,发病率逐年增加。其主要临床特征为四肢远端感觉与运动障碍,表现为肢体麻木及肌肉无力等,发病机制复杂,至今未能完全明确。现代医学研究表明主要与高血糖引起的代谢紊乱如多元醇通路激活、非酶蛋白糖基化作用、糖基化终产物堆积、活性氧自由基过量累计等有关。其中活性氧自由基的过量累积会导致线粒体氧化应激,引发线粒体功能障碍,从而诱发DPN[1-2]。因此,减轻糖尿病患者的氧化应激对延缓DPN的发生发展具有重要作用。
抗痹颗粒为我院院内制剂,由黄芪、党参、当归、玉竹、天花粉、赤芍、桂枝、地龙、川芎、细辛、红花、桃仁、甘草组成。现代药理研究表明,君药黄芪的有效成分黄芪总苷有扩血管、改善微循环、调节免疫等作用,可明显改善局部血流动力学,减轻DPN[3]。其提取的高纯度活性成分单体黄芪甲苷有抑制氧化应激、细胞凋亡及减少炎症产生等作用[4]。党参发挥生物活性的重要物质基础之一党参多糖,具有抗氧化应激、抗肿瘤、调节免疫等作用[5-6]。当归的主要成分当归多糖有突出的补血活血、抗辐射、提高免疫、抗氧化等功效[7]。玉竹的主要成分玉竹多糖具有明显的抗氧化生物活性,它首先通过提高体内超氧化物歧化酶的活性,增强体内清除氧自由基的能力,进而抑制脂质过氧化,降低丙二醇含量,减少氧自由基对胰岛细胞的破坏,从而达到减轻胰腺组织损伤,维持及促进胰岛素的分泌,最终使糖代谢途径保持正常运行,产生降糖效果[8]。天花粉是在古今中药治疗糖尿病中应用十分广泛,为治疗糖尿病之要药[9]。其发挥药理活性的主要成分天花粉凝集素可显著改善糖尿病大鼠的血糖异常,增强大鼠抗氧化能力[10]。赤芍可能通过黄芩素、β-谷甾醇、鞣花酸、豆甾醇、(+)-儿茶素等活性成分调控PI3K-Akt、NF-κB和IL17等信号通路中的关键靶点AKT1、JUN、TP53、TNF、CASP3、IL6、RELA、NFKBIA、MMP9、HIF1A发挥抗氧化应激作用[11]。桂枝挥发油为桂枝的主要活性物质,在抗炎、抗病毒、抗肿瘤和抗菌等方面具有较好的药理活性。桂枝挥发油中的主要成分桂皮醛可增强高血糖条件下生成活性氧的抗氧化防御能力,保护胰岛β细胞免受丢失,产生降血糖作用[12]。红花具有扩张血管,降低机体炎性反应的作用,桃仁具有降低血流阻力、缓解患者机体炎性反应的作用,二者联合可有效改善患者机体血液循环状况,同时改善患者机体炎性反应引起的氧化应激损伤[13];甘草酸是甘草提取物,具有抗炎、抗氧化、抗肿瘤、抗病毒等生物活性[14]。本课题通过制作DPN大鼠模型,发现抗痹颗粒能明显降低模型组大鼠的体质量、血糖,对血糖具有明显的改善作用,同时能够明显升高模型大鼠的SOD、CAT活性,升高GSH含量,减少MDA含量。通过上面方剂成分的药理研究分析及本课题的数据分析,表明抗痹颗粒改善DPN大鼠的血糖,应该与其降低DPN大鼠氧化应激反应有关,发挥了中药方剂多成分、君臣佐使的特点,但抗痹颗粒的抗氧化应激作用是通过影响糖代谢途径、神经细胞因子凋亡,还是干预免疫调节[15]发挥作用未进行研究。
