右美托咪定对AECOPD序贯通气患者的膈肌功能及炎性反应的影响
2023-08-12龚志翔欧阳丽芬陈力颖何青云
龚志翔 欧阳丽芬 王 超 陈力颖 何青云
(江西省中西医结合医院重症医学科,江西 南昌 330006)
呼吸机治疗技术和抗感染是治疗慢性阻塞性肺疾病急性加重期(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)的核心[1]。多项研究表明,有创-无创序贯通气(以下简称序贯通气)可显著提高AECOPD的撤机成功率[2-3]。但是,针对序贯通气策略失败的原因,尤其是序贯通气中因“镇静不当”对机体的膈肌功能及炎性反应的影响的研究较少。右美托咪定(dexmedetomidine,DEX)是一种高选择性α2肾上腺素能受体激动剂,多项研究发现DEX不仅能有效镇静,抑制交感神经活性,还具有一定的抗炎作用[4]。本研究旨探讨DEX对AECOPD序贯通气患者膈肌功能及炎性反应的影响,报道如下。
1 资料与方法
1.1 一般资料 选择2022年2月25日至2022年11月30日在本院ICU病房诊治的符合纳入标准的AECOPD患者80例为研究对象。采用随机配对方法将患者分为A组和B组。A组40例,男24例,女16例,年龄为(75.5±4.93)岁;B组39例(1例因资料不完整而中途退出),男25例,女14例,年龄为(76.2±5.34)岁。两组患者或患者授权人签署知情同意书。两组患者基本资料无统计学差异(P>0.05),具有可比性。研究内容经医院伦理委员会批准。
1.2 纳入与排除标准 纳入标准:①参照中华医学会呼吸病学分会慢性阻塞性肺疾病学组2021年3月发布的《慢性阻塞性肺疾病诊治指南(2021年修订版)》的诊断标准[5],确诊为AECOPD的患者。②患者入科时动脉血气分析在静息状态、运动状态呼吸空气条件下,动脉血氧分压(arterial partial pressure of oxygen,PaO2)<60 mm Hg,同时伴二氧化碳分压(PaCO2)>50 mm Hg,符合有创正压通气指征。③经有创通气、抗感染等治疗后出现肺部感染控制时间窗(pulmonary infection control window,PIC-W),行无创序贯通气,具体表现如下。a.影像学浸润明显改善;b.痰液量及黏度明显下降;c.至少有一种伴随症状:体温<37.5 ℃,白细胞计数(2~10)×109/L或更低;d.呼吸机设置为PSV模式,支持水平为10~12 cm H2O。④患者年龄60~75周岁,患者或家属了解研究内容,自愿加入本试验,并签订《知情同意书》同意治疗方案。⑤医院医学伦理委员会审查并通过本研究方案。排除标准:①GOLD分级1~2级,无呼吸衰竭患者。②由结核、真菌、肿瘤、矽肺、过敏等已知因素引起的慢性咳嗽喘息者,或具有特征病理表现的气流受限疾病,如支气管扩张症、肺结核纤维化病变、肺囊性纤维化、弥漫性泛细支气管炎以及闭塞性细支气管炎等的患者。③合并心、肾、恶性肿瘤、造血系统等严重原发性疾病。④未签订知情同意书者。⑤不愿意提供病史资料或资料不完整的患者。⑥过敏体质或对本治疗药物过敏者。
1.3 方法
1.3.1 治疗方法 两组患者均采用序贯通气、抗炎、化痰及营养支持等常规治疗方案。A组镇静镇痛方案:咪达唑仑注射液、注射用盐酸瑞芬太尼。咪达唑仑注射液予0.03~0.1 mg/(kg·h)持续静脉泵注;注射用盐酸瑞芬太尼予0.5 μg/kg静脉泵注,10 min后以0.5~1.5 μg/(kg·h)的维持剂量持续泵入。B组在A组的基础上,加用盐酸右美托咪啶注射液,予0.5 μg/kg静脉泵注,10 min内泵注结束,再以0.2~0.7 μg/(kg·h)的维持剂量持续泵入。有创通气阶段维持RASS评分(Richmond躁动-镇静量表)在-2~0分,CPOT评分(重症监护患者疼痛评估)0~2分;序贯无创通气阶段,维持RASS评分在-1~1分,CPOT评分0~2分。咪达唑仑注射液、注射用瑞芬太尼购自宜昌人福药业,盐酸右美托咪啶注射液购自江苏恒瑞药业。
1.3.2 观察指标及观察节点 ①一般性指标:平均动脉压(mean arterial pressure,MAP)、心率(heart rate,HR)、急性生理与慢性健康评分(APACHEⅡ评分)、临床肺部感染评分(clinical pulmonary infection score,CPIS)、降钙素原(procalcitonin,PCT)、C反应蛋白(C reactive protein,CRP)、动脉血二氧化碳分压(arterial partial pressure of carbon dioxide,PaCO2)、PaO2和氧合指数(PaO2/FiO2,P/F)。②炎性指标:白细胞介素6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)。③监测膈肌功能:膈肌移动度(diaphragmatic excursion,DE)、膈肌增厚率(diaphragm thickening rate,DTF)。④预后评估:拔管再插管例数、机械通气时间、谵妄发生率。观察节点:T1(有创通气第1天),T2(有创通气结束前1小时),T3(无创通气开始第1天),T4(无创通气结束后24小时),T5(脱机后72小时)。在观察点,APACHEⅡ评分、MAP、HR和CPIS由课题组专人评估、记录,取当日3次评估平均值。
1.3.3 仪器和方法 次日清晨抽取桡动脉血1 mL和空腹静脉血4 mL待检。血气分析仪采用干化学法(深圳理邦,型号EDAN i15A),全自动化学发光法(深圳爱康全自动化学发光法仪,型号CLIA-mate)检测IL-6、TNF-α,采用干式荧光免疫法(杭州中泰干式荧光免疫分析仪,型号AFIAS-50)检测CRP。
1.3.4 膈肌功能评估 患者取平卧位,测量部位以右侧膈肌为主,将超声探头置于锁骨中线与腋前线之间的前胸壁肋间隙,在B型超声中可见高回声的胸膜层、无回声的膈肌层及高回声的腹膜层,膈肌显示在肺脏与肝脏之间(右侧),测量所得胸膜与腹膜之间的距离即为膈肌厚度。选择M型超声,将采样线垂直于膈肌,可以记录膈肌移动度。膈肌增厚率的计算公式为膈肌增厚率=[吸气末膈肌厚度-呼气末膈肌厚度]/呼气末膈肌厚度×100%。第一次取数据后在皮肤表面做定位标记,取3次测定的平均值。
1.4 统计学方法 采用SPSS24.0统计学软件进行数据分析,计量资料用()表示,组间比较使用t检验、单因素方差检验。计数资料用率(%)表示,组间比较使用卡方(χ2)检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般性指标 T1~T5时,同时间节点组间比较,两组的APACHEⅡ评分、P/F、PaCO2、PaO2和CPIS均无显著性差异(P>0.05);T1时,两组的MAP、HR无显著性差异(P>0.05),T2~T5时,同时间节点B组的MAP、HR较A组明显降低(aP<0.05或bP<0.01)。T1~T5时,同组内比较,A组或B组的APACHEⅡ评分、MAP、HR、P/F、PaCO2、PaO2和CPIS,均有显著性差异(cP<0.01)。见表1。
表1 两组一般性指标水平()
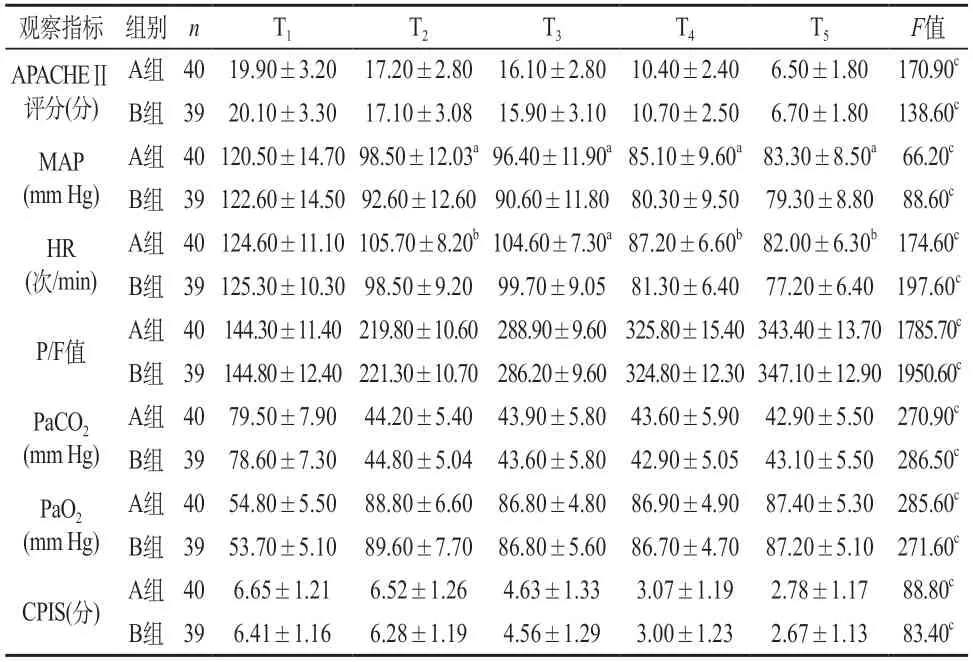
表1 两组一般性指标水平()
注:同时间节点,两组间比较aP<0.05,bP<0.01;不同时间节点,同组内比较cP<0.01。
2.2 炎性相关指标 T1时,两组的CRP、PCT、IL-6、TNF-α无显著性差异(P>0.05);T2~T5时,同时间节点组间比较,两组的CRP、PCT、IL-6、TNF-α均有显著性差异(aP<0.05或bP<0.01)。T1~T5时,同组内比较,A组或B组的CRP、PCT、IL-6、TNF-α均有显著性差异(cP<0.01)。见表2。
表2 两组炎性介质、免疫相关指标水平()
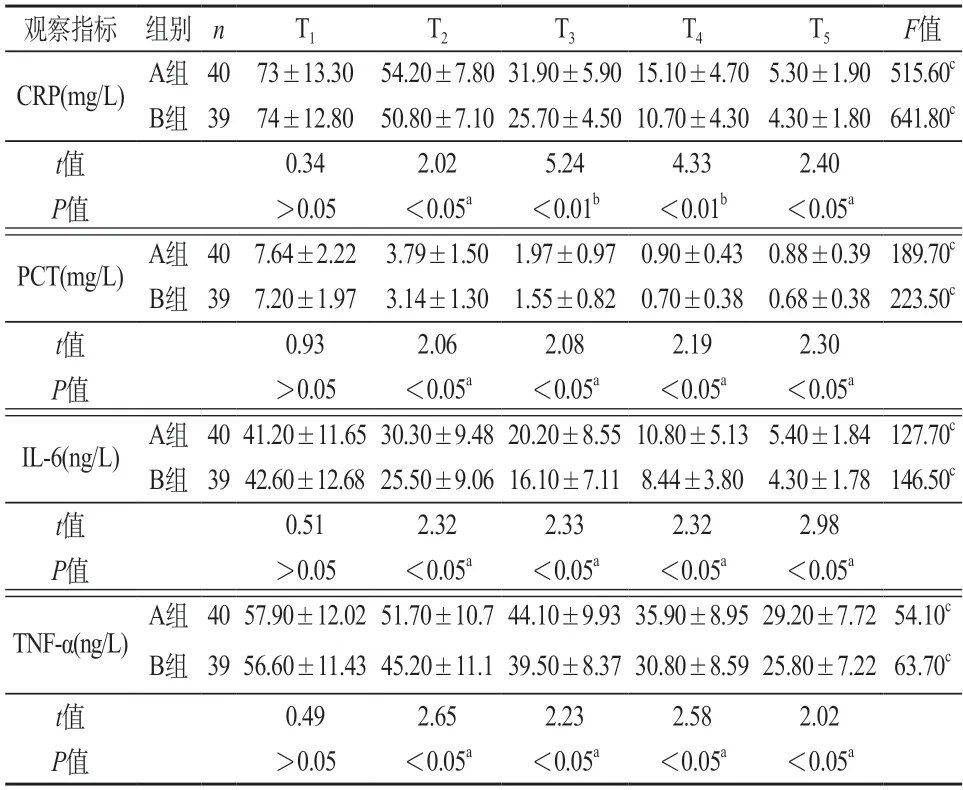
表2 两组炎性介质、免疫相关指标水平()
注:同时间节点,两组间比较aP<0.05或bP<0.01;同组内比较cP<0.01。
2.3 膈肌功能 T1、T2时,同时间节点组间比较,两组的膈肌移动度和膈肌增厚率无显著性差异(P>0.05);T3~T5时,两组的膈肌移动度和膈肌增厚率有显著性差异(aP<0.05或bP<0.01)。T1~T5时,同组内比较,A组或B组的膈肌移动度和膈肌增厚率,均有显著性差异(cP<0.01)。见表3。
表3 两组膈肌功能()
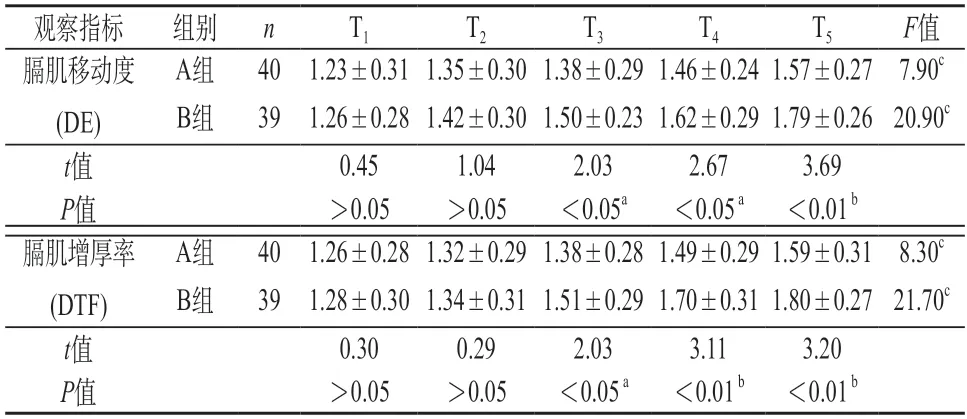
表3 两组膈肌功能()
注:同时间节点,组间比较a P<0.05或bP<0.01;组内比较cP<0.01。
2.4 预后评估 治疗后,两组拔管再插管率无显著性差异(P>0.05);B组在机械通气时间、谵妄发生率少于A组(P<0.05)。见表4。
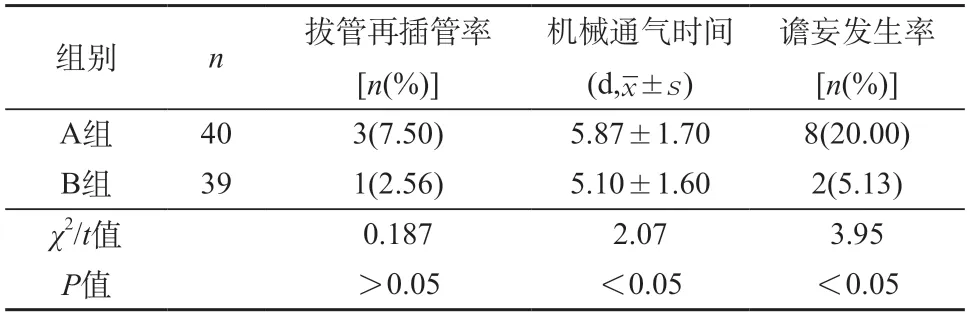
表4 两组拔管再插管率、机械通气时间、谵妄发生率
3 讨论
序贯通气是AECOPD转危为安的重要通气策略,把握好肺部感染控制时间窗,将其作为有创-无创通气的切换点,可有效维持患者的通气功能,缓解呼吸肌疲劳,还减少院内感染。经治疗,本研究中两组的P/F、PaCO2、PaO2等氧合指标均明显改善(P<0.01),APACHEⅡ评分和CPIS下降(P<0.01),说明序贯通气策略十分奏效。但机械通气状态下患者机体仍处于严重的应激反应,肺部感染控制不佳,咳嗽能力下降,痰液引流不畅,呼吸机诱导的膈肌损伤(ventilator-induced diaphragmatic damage,VIDD),仍是导致脱机失败的主要因素[6-7]。此外,PCT、CRP、白细胞介素家族、TNF-α等炎性因子介导的局部以及全身炎性反应,参与气道重塑,与AECOPD发生、发展有密切相关[8-9]。
目前多项研究提示DEX可影响相关炎性因子的表达,对肺、膈肌功能等起到保护作用[10-13],在前人研究的基础上,本研究的重点是观察DEX对AECOPD患者序贯通气策略下的膈肌功能及炎性反应的影响。本研究结果显示,T2~T5时B组的CRP、PCT、IL-6、TNF-α较A组明显降低(P<0.05或P<0.01),说明加用DEX明显减轻了患者机体的炎性反应的影响,减轻细胞毒性反应。在膈肌功能(膈肌移动度、膈肌增厚率)上,T3~T5时,B组改善程度较A组更优(P<0.05或P<0.01),且B组的机械通气时间短于A组(P<0.05),谵妄发生率明显低于A组(P<0.05),提示DEX明显减轻了序贯通气对患者膈肌功能的影响,缩短了机械通气时间,改善了患者预后。
DEX对患者肺保护机制尚不清楚,一般归纳为3点:①DEX具有抗炎、抗氧化应激作用。DEX阻断级联反应抑制炎性反应,降低炎性因子白细胞介素类、TNF-α等的释放,减轻细胞凋亡;DEX通过激活交感-肾上腺髓质系统,抑制中枢交感神经释放兴奋递质,减轻氧化应激反应,调控体内免疫系统。研究表明,围手术期输注DEX可抑制肾上腺素、去甲肾上腺素和皮质醇的释放,IL-6、TNF-α和CRP,CD4+/CD8+下降,减轻围手术期应激和炎性反应,保护手术患者的免疫功能[14]。②DEX能激活多个信号通路实现肺保护,如PI3K/AKT通路、蛋白激酶C/血红素加氧酶-1(PKC-ɑ/HO-1)通路等。研究发现DEX通过高迁移率族蛋白B1(HMGB1)介导的TLR4/NF-κB和PI3K/Akt/mTOR通路对脂多糖(LPS)诱导的急性肺损伤实现保护作用[15];Liang等[16]研究用无创血管钳夹住大鼠左肺门建立肺缺血模型,DEX预先给药后大鼠肺组织缺氧诱导因子(HIF-1a)、磷酸化蛋白激酶(p-Akt)、第三型硫胱胺酸蛋白酶(Caspase-3)和第九型硫胱胺酸蛋白酶(Caspase-9)的mRNA表达明显降低,提示DEX通过激活PI3K/Akt通路减轻大鼠肺缺血-再灌注损伤。DEX可激活PKC-α/HO-1通路调节线粒体融合和分裂,从而减轻内毒素诱导的急性肺损伤[17]。③DEX通过激动血管平滑肌上α2受体,增强缺氧性肺血管收缩,改善肺氧合能力[18]。目前尚无针对膈肌功能状态进行评价的特异性指标,床旁超声评估膈肌功能是临床重要工具。测量吸气末与呼吸末时膈肌厚度变化计算出膈肌增厚率,是反映膈肌收缩效能的可靠指标,膈肌增厚率大于30%预测机械通气患者脱机成功具有最佳的敏感度与特异度[19-20]。DEX对膈肌功能保护的具体机制尚不明确,推测它仍是通过减少机体器官的炎性反应,激活保护细胞免受损伤的抗凋亡信号通路来发挥作用[21]。
当然,DEX也存在相关药物不良反应,对HR、MAP产生一定的影响,在T2~T5时,B组较A组HR、MAP明显下降(P<0.01),这是因为DEX抑制了机体的交感神经,这与类似研究结果一致[22]。
综上所述,DEX明显减轻了AECOPD序贯通气患者机体应激反应,保护膈肌功能,减少谵妄发生,进一步缩短机械通气时间,改善患者的预后,效果良好,值得临床进行推广。当然,本课题设计样本量较小,且缺少DEX对膈肌功能分子机制的研究,后期仍需要进一步完善。
