虎杖调控脂质代谢治疗呼吸道合胞病毒感染肺纤维化小鼠模型的研究
2023-08-12陈佳斌张梦瑶王单黄同杏单进军杨珺超宋康林丽丽
陈佳斌,张梦瑶,王单,黄同杏,单进军,杨珺超,宋康,林丽丽
(1.浙江中医药大学第一临床医学院,浙江 杭州 310053;2.南京中医药大学中医儿科学研究所,江苏省儿童呼吸疾病(中医药)重点实验室,江苏 南京 210023)
呼吸道合胞病毒(Respiratory syncytial virus,RSV)是导致婴幼儿和老年人下呼吸道感染的最常见原因[1-2]。临床研究表明,慢性肺纤维化患者感染RSV易引起下呼吸道感染并导致肺功能恶化[3]。动物试验证实[4],RSV感染可加快肺纤维化进程、加剧肺部病理严重程度,其基本病理特征为肺泡结构遭到破坏,肌成纤维细胞过量活化增殖进而分泌大量细胞外基质,逐渐取代正常的肺组织,导致气道重塑。研究表明RSV感染加剧肺纤维化的过程包括病毒吸附、病毒复制、增殖等,涉及多种脂质代谢紊乱[5]。
中药虎杖是蓼科植物虎杖的干燥根茎和根,入肝、胆、肺经,具有利湿退黄,清热解毒,散瘀止痛,祛痰止咳等功效,临床中常被用于治疗肺纤维化。浙江省中医院宋康教授[6]结合多年临床实践经验,提出治疗肺纤维化处方中应重用虎杖(30 g),取其清热解毒兼活血祛瘀之功。动物实验亦证实,虎杖提取液可显著减少肺组织中羟脯氨酸的含量,参与调控肺组织炎症进程,改善模型大鼠肺纤维化病理损伤程度,对肺纤维化有一定的防治作用[7]。在此基础上,本研究基于脂质组学,进一步探讨虎杖对RSV感染肺纤维化小鼠模型肺组织脂质代谢及炎症过程的影响。
1 材料与方法
1.1 试剂
去离子水(美国Millipore公司);生理盐水(武汉普诺赛生命科技有限公司);甲醇、乙腈(纯度:99.8%,德国Merck公司,货号:I1150307122、I1176330413);甲酸、异丙醇、甲酸铵、乙酸铵(纯度:99%,美国ROE公司,货号:F61240500、I1161140133、21E6613、21D5452);甲基叔丁基醚(纯度:99%,美国Tedia公司);脂质内标lyso PE(17∶1)、PE(17∶0/17∶0)(纯度:99%,美国Avanti Polar Lipids公司,货号:LM171LPE-11、LM170PE-19);羟脯氨酸ELISA试剂盒(江苏华美生物技术有限公司,货号:CSB-E08839);IL-6、TNF-α ELISA试剂盒(南京建成生物工程研究所,货号:H007-1-2、H052-1-2);Gibco胎牛血清(美国Thermo Fisher公司,货号:10099-141);DMEM培养基、0.25%胰蛋白酶(含0.1%EDTA)、青霉素-链霉素混合液(100×)、磷酸缓冲液(上海源培生物科技有限公司)。
1.2 仪器
3110型二氧化碳培养箱(美国Thermo Fisher公司);AC2-3SI型生物安全柜(新加坡Esco生物公司);CPA225D型十万分之一电子天平(德国Sartorius公司);BX43型荧光显微镜(日本Olympus公司);MM400型混合球磨仪(德国RETSCH公司);Allegra 64R型高速冷冻离心机(美国Beckman Coulter公司);Vortex-Genie 2型涡旋振荡器(美国Thermo Fisher公司);Savant SPD1010型真空离心浓缩仪(美国Thermo Fisher公司);THZ-C型恒温震荡仪(太仓市强乐实验设备有限公司);KQ-500B型超声波清洗器(昆山市超声仪器有限公司);U3000型高效液相色谱仪(美国Dionex公司);Q-Exactive型四极杆-静电场轨道阱高分辨质谱仪、Xcalibur2.1软件(美国Thermo Fisher公司)。
1.3 实验动物
SPF级C57BL/6雄性健康小鼠,24只,体质量18~22 g,6周龄,购于上海计划生育研究所实验动物经营部,动物合格证号:SCXK(沪)2018-0006。将其适应性饲养3 d后,开始进行动物实验。饲养条件:室温22~26 ℃,相对湿度52%~56%,12 h光暗昼夜循环,分笼饲养,自由摄食饮水。本实验经南京中医药大学动物实验伦理审查通过,伦理号:202201A015。
1.4 RSV扩增
RSV病毒(A株)、Hela细胞采购自中国典型培养物保藏中心(武汉大学)。Hela细胞为RSV繁殖细胞,使其细胞贴壁生长12~24 h,达到60%单层。之后弃培养基,采用无血清培养基洗涤细胞1次,而后加入1 mL无血清培养基。接种RSV-A2标准株病毒液500 μL[5×106病毒毒力(TCID50)],混匀使病毒吸附2 h,以含2%胎牛血清的DMEM为RSV维持液,使T25培养瓶中液体达到5 mL。于37 ℃、5%CO2培恒温培养箱下扩增,并每日观察;待细胞出现80%以上的病变时,将细胞反复冻融3次以上,以3 000 r·min-1,4 ℃离心15 min,取上清液,采用Reed-Muench公式计算TCID50后,收集上清并分装保存于-80 ℃超低温冰箱,备用。
1.5 药品
注射用盐酸博来霉素(瀚晖制药有限公司,货号:H20055883)。中药虎杖(铜陵禾田中药饮片股份有限公司,货号:20181115)。称取虎杖30 g,加水煎煮2次,第1次11倍量水,煎煮1.5 h;第2次7倍量水,煎煮1.0 h,滤过,滤液减压浓缩至约200 mL虎杖(4.55 g·kg-1·d-1)水煎液,并经过标准化质控流程鉴定大黄素甲醚、白藜芦醇、虎杖苷、大黄素-8-O-β-葡萄糖苷4种指标成分。
1.6 实验分组及给药方案
24只SPF级雄性C57BL/6小鼠随机分为4组,每组6只。分别为空白组、博来霉素诱导肺纤维化组、RSV感染肺纤维化组、虎杖(4.55 g·kg-1·d-1)治疗组。肺纤维化模型采用单次气管内注射50 μL博莱霉素(2 mg·mL-1,生理盐水稀释)和50 μL Hela细胞上清接种液。RSV感染肺纤维化组小鼠气管内注射50 μL博莱霉素(2 mg·mL-1,生理盐水稀释)和50 μL RSV病毒液(4×106PFU·mL-1),空白组采用同等剂量生理盐水及Hela细胞上清接种液气管内注射。造模后次日,治疗组予虎杖(4.55 g·kg-1·d-1)水煎液进行灌胃,临床等效剂量为30 g,药物剂量参照实验小鼠与人临床用药剂量进行换算[8],其余各组分别给予生理盐水灌胃,连续灌胃给药21 d后处死小鼠,取肺组织,经液氮快速冷冻后移至-80 ℃超低温冰箱保存备用。
1.7 肺组织病理切片处理
取右肺中叶置于4%多聚甲醛中固定;固定后样品经乙醇梯度脱水,2次二甲苯透明,石蜡包埋后常规切片,进行苏木精-伊红(HE)染色及Masson染色,通过光镜观察肺组织病理形态。
1.8 羟脯氨酸及炎症因子含量测定
根据羟脯氨酸、IL-6、TNF-α ELISA试剂盒的说明书进行检测。
1.9 脂质组学样本提取
称取肺组织约20 mg于2 mL离心管中,加入超纯水200 μL,球磨机上匀浆10 min。取组织匀浆液20 μL于1.5 mL EP管中。加入225 μL预冷甲醇溶液,甲醇溶液内含混合内标[LPE(17∶1),PE(17∶0/17∶0)的质控混合物],内标混合物终浓度为10 μg·mL-1。在涡旋10 s后加入750 μL甲基叔丁基醚(MTBE),4 ℃震荡10 min,再加入188 μL室温条件下的双蒸水并涡旋20 s,4 ℃条件下17 000 r·min-1离心10 min后,样本分层,取上清液350 μL至新的1.5 mL离心管里,上层浓缩物予200 μL(甲醇∶甲苯=9∶1)混合液复溶,水浴超声10 min,18 000 r·min-1离心10 min,取上清液100 μL待测。
1.10 色谱条件
采用ACQUITY UPLC®CSHTMC18柱(1.7 μm,2.1 mm×100 mm,美国Waters公司)。流动相A:含0.1%甲酸和10 mmol·L-1甲酸铵的乙腈/水溶液(60∶40,V/V),流动相B:含0.1%甲酸和10 mol·L-1甲酸铵的异丙醇/乙腈溶液(90∶10,V/V)。梯度洗脱程序:0~2 min,15%~30%B;2~2.5 min,30%~48%B;2.5~11 min,48%~82%B;11~11.5 min,82%~99%B;11.5~12 min,99%B;12~13 min,15%B;13~15 min,15%B,流速0.6 mL·min-1;柱温:65 ℃;正离子模式下进样量为2 μL,负离子模式下进样量为5 μL。
1.11 质谱条件
四极杆-静电场轨道阱高分辨质谱仪(Q-Exactive),扫描模式为正(+)/负(-)离子2种模式。电离源:HESI;喷雾电压分别为3.5 kV(+),3.0 kV(-),离子源温度分别为306 ℃(+),325 ℃(-),鞘气、辅助气均为氮气,鞘气流:75 kPa,辅助气流:104 kPa,毛细管温度:300 ℃,S-lens:50,扫描范围:m/z215~1 800。
1.12 数据处理及统计方法
Xcalibur软件采集样品的原始图谱信息,使用ABF converter软件将原始图谱转换为ABF格式,导入MS-DIAL软件,使用软件内置的LipidBlast library对数据进行预处理。脂质鉴定过程是将一级和二级碎片离子和LipidBlast数据库匹配,通过峰提取、物质鉴定、峰对齐,得到三维矩阵数据集,坐标分别为:化合物名称、保留时间、保留指数及根据峰高提取的峰面积。对矩阵数据集进行PQN归一化及Pareto校准后(Pareto scalling),采用Metaboanalyst 5.0进行主成分分析(PCA)[9]。将归一化的数据进行单因素方差分析(ANOVA)及非参数检验法(Kruskal-Wallistest),根据差异倍数(Fold change,FC)、P值及错误发现率(False Discovery Rate,FDR)值筛选差异性代谢物,FDR采用Benjamini&Hochberg检验法。选取P<0.05或FDR<0.05,当FC>1.2或FC<0.83,提示该代谢物具有统计学意义。所有的统计分析均采用Metaboanalyst 5.0(https://www.metaboanalyst.ca/)和Prism 8(version 8.0.2, GraphPad, LaJolla, CA)。
2 结果
2.1 小鼠肺组织病理学观察
HE染色观察肺泡炎症程度,Masson染色观察肺纤维化程度(图1)。空白组未见炎性细胞浸润及蓝色胶原沉积;与空白组相比,博来霉素诱导肺纤维化组小鼠肺泡间质及肺泡腔出现炎性细胞浸润及蓝色胶原沉积;与博来霉素诱导肺纤维化组相比,RSV感染肺纤维化组小鼠肺泡间质及肺泡腔出现炎性细胞浸润及蓝色胶原沉积明显增多;与RSV感染肺纤维化组相比,经虎杖(4.55 g·kg-1·d-1)治疗后,小鼠肺组织炎症和胶原沉积明显改善。

图1 各组病理HE、Masson染色结果(×200)
2.2 小鼠肺组织肺纤维化程度观察
羟脯氨酸为胶原纤维特有的主要成分之一,因此可作为肺纤维化的评价指标[10]。肺组织ELISA结果表明,与空白组相比,博来霉素诱导肺纤维化组羟脯氨酸含量明显升高(P<0.01),与博来霉素诱导肺纤维化组相比较, RSV 感染肺纤维化组小鼠肺组织羟脯氨酸含量进一步升高(P<0.05)。与RSV感染肺纤维化组相比,虎杖(4.55 g·kg-1·d-1)治疗组肺组织羟脯氨酸含量明显降低(P<0.001)(图2)。

注:与空白组比较,**P<0.01;与博来霉素诱导肺纤维化组比较,#P<0.05;与RSV感染肺纤维化组比较,△△△P<0.001。
2.3 小鼠肺组织炎症因子分析
结果见图3。与空白组比较,博来霉素诱导肺纤维化组中炎症因子IL-6、TNF-α水平显著上调(P<0.05,P<0.001)。与博来霉素诱导肺纤维化组相比较,RSV感染肺纤维化组IL-6、TNF-α水平有上调趋势(P=0.40,P=0.14),但无统计学差异,此结果多考虑为RSV造模时间过长,RSV感染21 d后小鼠肺组织炎症水平具有一定程度的自限性。

注:与空白组比较,*P<0.05,***P<0.001;与RSV感染肺纤维化组比较,△P<0.05,△△△P<0.001。
虎杖能有效下调RSV感染肺纤维化组小鼠肺组织中高水平的促炎细胞因子IL-6、TNF-α水平(P<0.001,P<0.05)。结合HE、Masson染色切片显示的组织形态(图1),虎杖提取液可显著改善RSV感染后肺纤维化模型肺部炎症及胶原沉积。
2.4 非靶标脂质组学分析
进样前先采用3~5针QC稳定流动相及仪器,进样过程中监测内标在所有样本中的峰高值,并计算其变异度(RSD);每进8针实验样本进1针空白溶剂样本和QC样本,将QC样本与各组样本绘制主成分分析PCA图,观察QC样本在PCA图中是否集中来检测仪器的重复性和可靠性。经计算,正离子模式下肺组织QC样品的2个内标RSD均为2%,负离子模式下肺组织QC样品的2个内标RSD分别为2%,6%,RSD均小于10%,且PCA图显示QC集中于一点,表明本实验操作与仪器条件相对稳定(图4)。
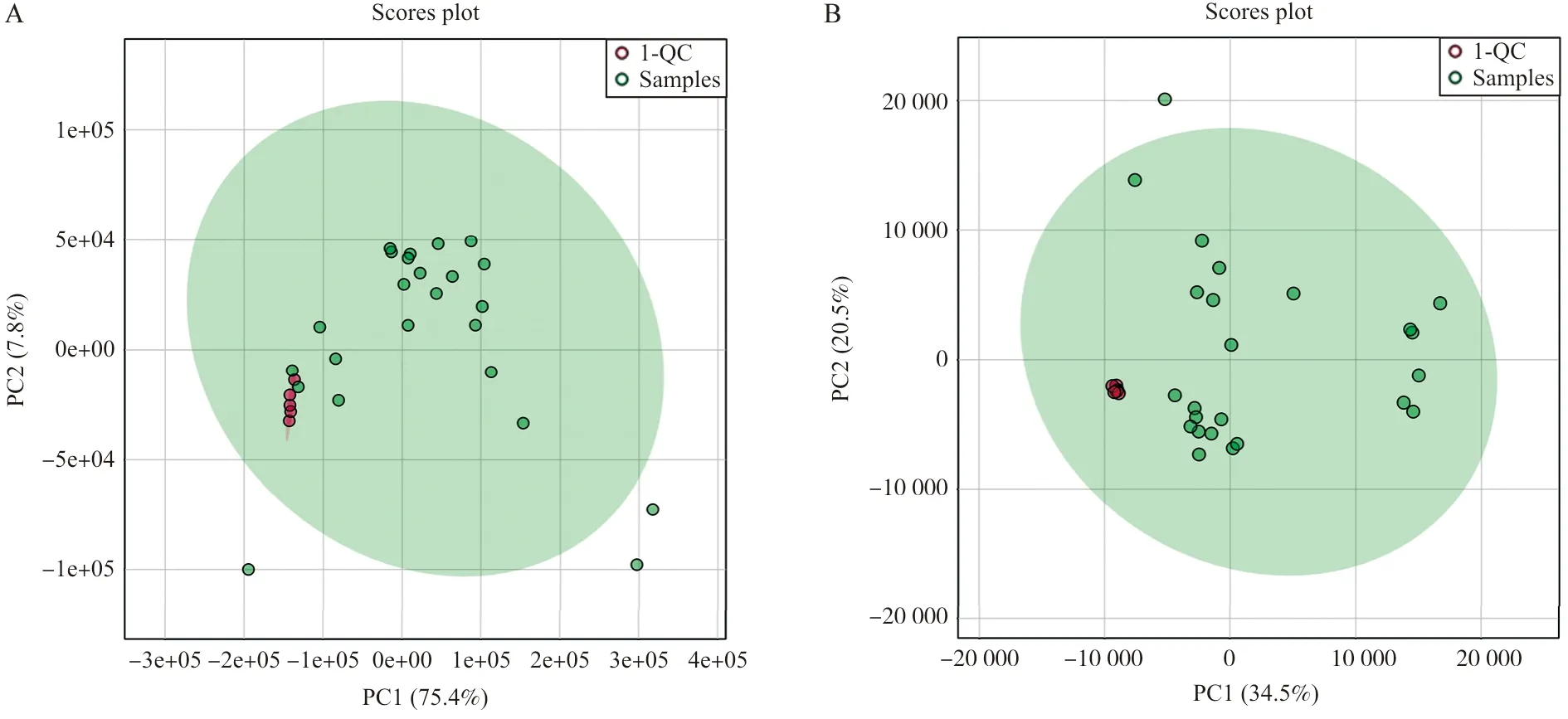
注:A.正离子模式;B.负离子模式
汇总正、负离子模式下4组中鉴定的脂质代谢物,详见总离子流图5A~B。用正、负离子模式下各组数据集绘制PCA图,图6中每个点代表一个样本,空白组、博来霉素诱导肺纤维化组、RSV感染肺纤维化组这3组两两之间具有较好的区分度,提示这3组小鼠肺组织存在差异性脂质;虎杖(4.55 g·kg-1·d-1)治疗组与RSV感染肺纤维化组有很好的区分,提示虎杖对RSV感染肺纤维化组小鼠肺组织脂质具有一定的调节作用。

注:A.正离子模式;B.负离子模式

注:C.空白组;BL.博来霉素诱导肺纤维化组;RB.RSV感染肺纤维化组;RBH.虎杖(4.55 g·kg-1·d-1)治疗组
2.5 RSV感染对肺纤维化小鼠肺组织脂质代谢影响
根据P<0.05及FC>1.2或FC<0.83标准,寻找差异性脂质。与空白组相比,博来霉素诱导肺纤维化组有32个差异性脂质,正离子模式下包括甘油二酯(DG)、甘油三酯(TG)、溶血磷脂酰乙醇胺(LPE)、酰基乙醇胺(NAE)、磷脂酰胆碱(PC)、磷脂酰肌醇(PI)、鞘磷脂(SM);负离子模式下,包括心磷脂(CL)、脂肪酸(FA)、磷脂酰乙醇胺(PE)、磷脂酰肌醇(PI),其中16个脂质呈上调趋势,16个脂质呈下调趋势。在此基础上,进一步筛选RSV感染肺纤维化组与博来霉素诱导肺纤维化组之间的差异性脂质,与博来霉素诱导肺纤维化组相比较,RSV感染肺纤维化组11个脂质与博来霉素诱导肺纤维化组具有一致趋势,主要为PC 14∶0_16∶0、PI 38∶6、PI 18∶0_18∶2、PI 16∶0_22∶6、PE 18∶0_22∶6、PE O-20∶1_22∶5、PE O-18∶1_20∶3等,RSV感染肺纤维化组21个脂质与博来霉素诱导肺纤维化组具有相反趋势,主要为FA、SM、DG、NAE、LPE、TG、CL等,详见热图(图7)及表1。

表1 RSV感染肺纤维化小鼠肺组织差异性脂质
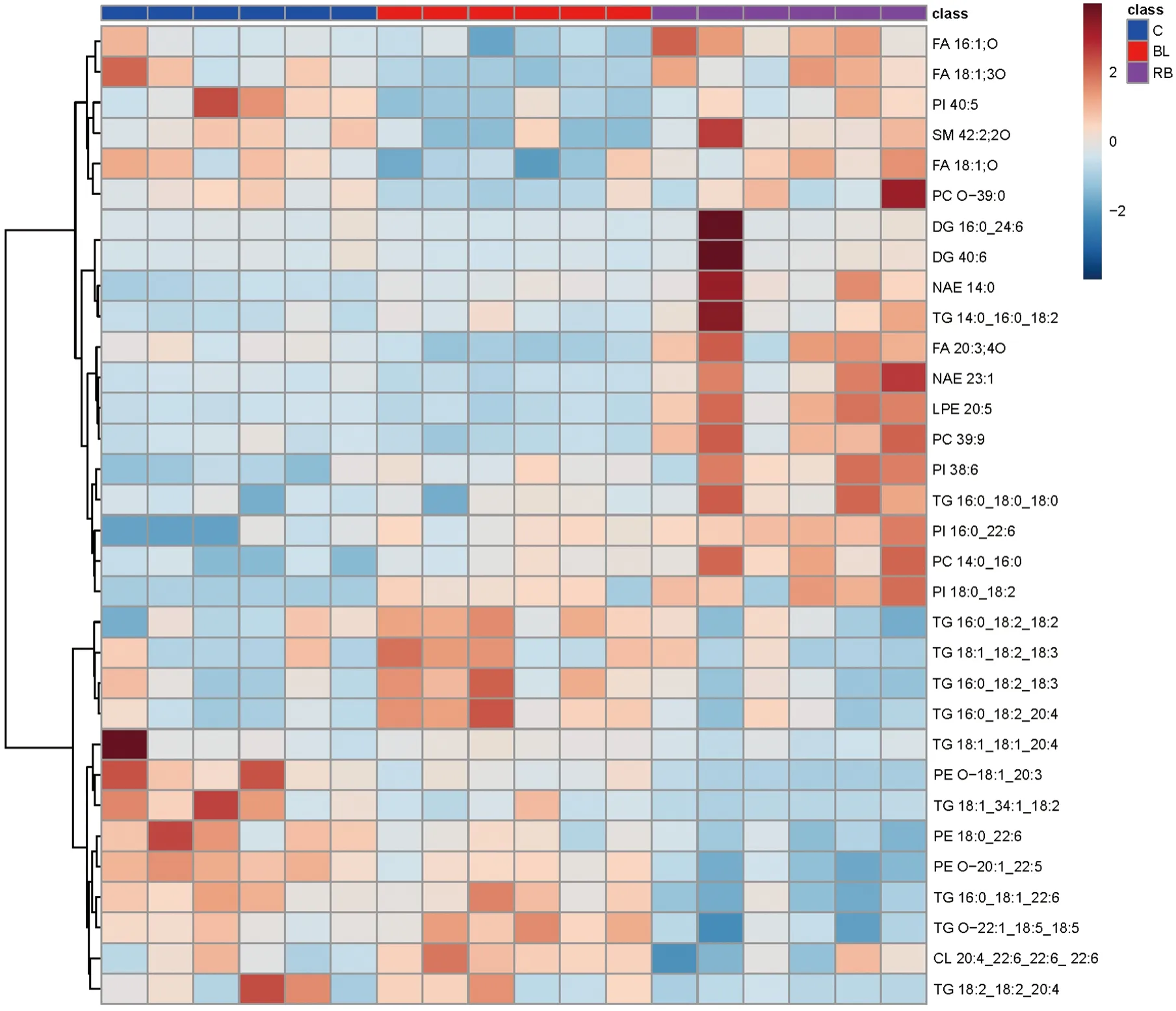
注:热图中红色代表上调趋势;蓝色代表下调趋势;C.空白组;BL.博来霉素诱导肺纤维化组;RB.RSV感染肺纤维化组
2.6 虎杖对RSV感染肺纤维化小鼠肺组织脂质代谢的调控作用
根据FDR<0.05及FC>1.2或FC<0.83标准,寻找差异性脂质。空白组、RSV感染肺纤维化组、虎杖(4.55 g·kg-1·d-1)治疗组小鼠肺组织存在74种差异性脂质。与空白组相比,RSV感染肺纤维化组55种脂质呈上调趋势,包括双/单油酰甘油磷酸酯(BMP)、神经酰胺(Cer)、己糖神经酰胺(HexCer)、CL、DG、LPC、LPE、NAE、PC、PE、酰基甘氨酸(NAGly)、PI、SM等。然而19种脂质呈下调趋势,包括甘油磷酰乙醇胺(PE-O)、磷脂酰甘油(PG)、磷脂酰丝氨酸(PS)、TG等。经虎杖(4.55 g·kg-1·d-1)治疗后,上述脂质中96%(71/74)脂质呈明显回调趋势(图8),详见表2。

表2 虎杖干预后RSV感染肺纤维化小鼠肺组织差异性脂质

注:红色代表上调趋势;蓝色代表下调趋势;C.空白组;RB.RSV感染肺纤维化组;RBH.虎杖(4.55 g·kg-1·d-1)治疗组
3 讨论
肺纤维化是以纤维母细胞灶、肺泡蜂窝状、持续性纤维化为主要特征,导致肺组织结构破坏,引起暴发性呼吸衰竭的渐进性、致命性间质性肺疾病[11]。目前肺纤维化发病机制主要是肺泡上皮细胞损伤,释放大量炎症因子,激活肺成纤维细胞,诱导细胞外基质(Extracellular matrix,ECM)的大量分泌,ECM包括纤维蛋白(主要是胶原蛋白)和蛋白多糖(肝素、透明质酸)以及其他糖基化蛋白(如纤连蛋白、层黏连蛋白和骨桥蛋白等)过度沉积,最终导致肺重塑和瘢痕肺[12]。
本研究将RSV联合博莱霉素与博莱霉素单独诱导的肺纤维化动物模型相比,RSV感染肺纤维化组小鼠肺组织中羟脯氨酸含量明显升高,提示胶原沉积加剧,同时伴促炎细胞因子IL-6、TNF-α释放增加,说明RSV感染可加剧肺组织纤维化,且持续时间更长,但RSV感染21 d后小鼠肺组织炎症水平具有一定程度的自限性。结合文献研究发现,急性期RSV大量进入机体后,肺巨噬细胞经刺激后释放TNF-α、IL-6等炎症因子,并产生炎症反应[13],损伤肺组织,从而加剧肺纤维化进程。
肺表面活性物质中约90%为脂质,脂质是细胞的重要组成物质,参与机体的生命活动,并为机体提供能量[14]。研究表明肺部脂质包括磷脂、鞘脂、FA、TG等,在肺纤维化的发病过程中发挥着重要作用,主要参与ECM的沉积、成纤维细胞的激活、肺结构的重塑和纤维化等过程[15]。
磷脂包括PC、PE、LPE、PI等,与ECM沉积过程密切相关[16]。PC、PE、PI等都可以转化为溶血磷脂。溶血磷脂如LPE、LPA等可作为生物活性脂质,在病理条件下转录并激活来调节肺组织ECM(胶原蛋白、纤连蛋白)的产生[17]。
鞘脂包括Cer、HexCer、SM等在肌成纤维细胞的激活及其促纤维化进程中发挥作用。鞘氨醇-1-磷酸(Sphingosine-1-phosphate,S1P)是鞘脂代谢的关键活性成分,在小鼠成纤维细胞中,抑制S1P生成可显著延缓博来霉素诱导的纤维化进程[18],其机制为SIP生成的减少可阻断成纤维细胞中TGF-β1、YAP等信号通路的激活[17]。
FA、DG、TG在肺纤维化过程中充当介质,介导旁分泌和内分泌细胞间的通讯,为重要的活性脂质的前体,也是肺脂质转运合成的重要来源[19]。在肺纤维化过程中,FA、TG等作为能量供给促进TGF-β/Smad信号传导和细胞活化,同时还可激活胶原蛋白和其他ECM成分[16]。
本研究通过动物实验进一步发现,PC、PE、LPE、PI、SM、TG、DG、FA等在博来霉素诱导肺纤维化组、RSV感染肺纤维化组中出现代谢紊乱,虎杖提取液可调控以上差异性脂质代谢水平,减轻RSV感染的肺纤维化小鼠的炎症反应和肺组织胶原沉积,改善小鼠肺组织纤维化进程,为虎杖更好地运用于肺纤维化的治疗提供了代谢层面的依据。
