一株低温蛋白酶产生菌的分离及该酶的鉴定与酶学性质表征
2023-08-12张军朱檬汤伟李佳欣乔晓妮孙晓雯唐涛何增国
张军,朱檬,汤伟,3*,李佳欣,乔晓妮,孙晓雯,唐涛,3,何增国
(1.中国海洋大学医药学院,山东 青岛 266000;2.青岛百奥安泰生物科技有限公司,山东 青岛 266000;3.青岛海洋生物医药研究院,山东 青岛 266000)
低温蛋白酶又称适冷性蛋白酶或冷活性蛋白酶,是在低温条件下能够催化底物水解的一类蛋白酶。相较于普通蛋白酶,低温蛋白酶具有天然的催化特性:低温下的高活性,有效降低了酶促反应热处理的成本;高温下的低稳定性,极大方便了酶促反应的控制[1-2]。近年来,低温蛋白酶在洗涤、制革、食品加工、环境治理中具有广泛应用,低温蛋白酶资源的发掘成为新的研究热点。
在地球生态圈中约80%的区域常年处于5 ℃或5 ℃以下的低温环境,在其中孕育的生物,特别是微生物,为低温蛋白酶资源的挖掘和筛选提供了重要来源[3-4]。来源于深海、极地、冰川、冻土等低温环境中的嗜冷菌(Psychrophiles)和耐冷菌(Psychrotrophys)逐渐成为低温蛋白酶的主要来源[5]。然而,使用低温微生物规模化生产低温蛋白酶存在技术瓶颈,且目前对低温微生物在低温条件下产酶所需的营养成分和培养条件的研究较少,因此尚未见公认的适用于低温蛋白酶生产的培养基和发酵工艺[6]。受此限制,目前真正实现规模化生产的低温蛋白酶产品并不多见,可检索到添加有低温蛋白酶的市售产品仅有KanaseR、PolarzymeR、Pura fectR、PropertaseR和ExcellaseR等[7-9]。
本课题组从低温土壤样品中筛选得到1 株乙酰微小杆菌YD37(Exiguobacterium acetylicum YD37),该菌株可在低温下生长,并具有水解蛋白活性。目前E.acetylicum 产蛋白酶的研究鲜见,本研究主要对E.acetylicum YD37 产低温蛋白酶进行鉴定和对其酶学性质进行研究,同时开展该菌株产低温蛋白酶的工程化发酵,以期为低温蛋白酶的进一步研究和应用奠定基础。
1 材料与方法
1.1 材料与试剂
样品采集自江苏省盐城市沿海的水产养殖塘口池底的土壤样品。
苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)、N-(对甲苯磺酰基)-L-苯丙氨酰甲基氯酮(1-tosylamido-2-phenylethyl chloromethyl ketone,TPCK)、细菌基因组提取试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)试剂盒、引物:生工生物工程(上海)股份有限公司;透析袋(截留1 kDa)、磷酸盐缓冲液(phosphate buffer saline,PBS):北京索莱宝科技有限公司;离子交换层析填料(DEAE-80S):苏州纳微生物科技股份有限公司;超滤管(截留1 kDa):美国Millipore 公司;蛋白Marker:上海碧云天生物技术有限公司;蛋白胨、酵母提取物、胰蛋白胨、酵母浸粉:北京双旋微生物制品有限公司;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、十二烷基苯磺酸钠(sodium dodecyl sulfate,SDS)、吐温20、吐温80、曲拉通X-100、双氧水:国药集团化学试剂有限公司。以上化学试剂均为分析纯。
1.2 培养基配制
脱脂奶粉筛选培养基:脱脂奶粉20 g/L,琼脂20 g/L,115 ℃灭菌10 min。
LB 培养基:蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,琼脂20 g/L,121 ℃灭菌20 min。
发酵培养基:玉米粉20 g/L,NaCl 7 g/L,胰蛋白胨6 g/L,酵母浸粉2 g/L,KCl 74.5 mg/L,121 ℃灭菌20 min。
1.3 仪器设备
紫外可见分光光度计(UV-9000S):上海元析仪器有限公司;蛋白纯化仪(HD-1):上海沪西分析仪器有限公司;PCR仪(C1000):美国BioRad 公司;真空冷冻干燥机(Alpha1-2):德国Crist 公司;发酵罐(FZ-EI):江苏丰泽生物工程设备制造有限公司。
1.4 试验方法
1.4.1 低温蛋白酶产生菌株筛选
取采集样品在无菌水中进行10 倍梯度稀释,选取合适的稀释度,取100 μL 涂布于脱脂奶粉筛选培养基上,20 ℃培养24 h。筛选蛋白水解圈/菌落直径比值较大的菌株作为复筛备选菌株。将备选菌株接种于LB培养基中,20 ℃180 r/min 培养24 h,10 000 r/min 离心10 min,取培养物上清液测定酶活,筛选出酶活最高的菌株,保藏于甘油管中以待进一步研究。
酶活测定:参考GB/T 23527—2009《蛋白酶制剂》中的福林酚法测定酶活。20 ℃条件下,1 mL 酶液每分钟水解酪蛋白产生1 μg 酪氨酸,定义为一个酶活单位(U)。
1.4.2 低温蛋白酶产生菌株鉴定
将YD37 在LB 平板上划线培养24 h,观察其菌落形态特征,透射电镜(transmission electron microscope,TEM)观察其菌体形态特征。采用基因组提取试剂盒提取YD37 基因组DNA,使用通用引物27 F 和1492 R扩增YD37 的16S rRNA 基因序列。产物测序后,结果在NCBI 数据库中进行Blast N 比对,用MEGA 10.0 软件(Neighbor-Joining 法)构建系统发育树。同时,参照《常见细菌系统鉴定手册》对YD37 的生理生化特征进行鉴定。
1.4.3 低温蛋白酶的分离纯化与鉴定
将保存的YD37 菌液按1%的接种量接于10 mL LB 培养基中,28 ℃、180 r/min 培养6 h。取2 mL 培养物转接到200 mL 发酵培养基中,20 ℃、180 r/min 培养24 h。离心收集上清液,采用硫酸铵沉淀法纯化目的蛋白,用PBS(0.1 mol/L)复溶沉淀。采用底物浸泡酶谱法[10],测定蛋白电泳凝胶中目标条带的位置,进一步采用阴离子交换柱DEAE-80S(苯基)纯化冻干样品,超滤除盐冻干后作为粗酶,并进行蛋白电泳检测。
将电泳凝胶上的粗酶条带切下,进行串联质谱检测。在已公布的E.acetylicum 基因组对应的蛋白序列中检索,获得该低温蛋白酶对应的基因序列。以该基因序列为基础设计引物,以YD37 的基因组为模板进行PCR,测序获得该低温蛋白酶的基因序列。采用Translate(https://web.expasy.org/translate/)、SignalP(https://services.healthtech.dtu.dk)、BlastP(https://www.uniprot.org/blast)、ClustalW(https://www.ebi.ac.uk/Tools/msa/clustalo/)、InterPro(http://www.ebi.ac.uk/interpro/)等一系列生物信息学工具对序列进行预测。
1.4.4 菌株YD37 产低温蛋白酶的液体深层发酵
对YD37 生长和产酶的温度进行测定,在前期单因素和响应面优化试验的基础上,进行50 L 规模的中试产酶工艺研究。采用发酵培养基,发酵条件设定为装料量50%、初始pH6.5、温度20 ℃发酵培养24 h。发酵结束后,检测发酵液的酶活。
1.4.5 低温蛋白酶的表征
1.4.5.1 低温蛋白酶结构预测
采用ProtParam 工具对低温蛋白酶序列的一级结构进行分析(https://web.expasy.org/protparam/)。采用Phyre2 工具对序列进行同源模建(http://www.sbg.bio.ic.ac.uk/phyre2/),并利用Swiss-PdbViewer 4.0 程序对预测结构进行分析(https://spdbv.unil.ch/)。
1.4.5.2 温度对酶活的影响
将粗酶液与酪蛋白溶液分别在10、20、30、35、40、50 ℃条件下反应后,测定酶活,确定最适酶催化温度。将粗酶液在10、20、30、40、50 ℃条件下水浴90 min,再与酪蛋白反应测定酶活,研究不同温度处理对酶活的影响,将10 ℃下的酶活设为100%,其它处理组用相对酶活表示。
1.4.5.3 pH 值对酶活的影响
将粗酶液与酪蛋白分别在pH6.0、7.0、8.0 和9.0条件下反应后,测定酶活,确定最适催化pH 值。将粗酶液在pH4.0、5.0、6.0、7.0、8.0、9.0 和10.0 条件下水浴90 min,再与酪蛋白反应测定酶活,研究不同pH 值处理对酶活的影响,将pH7.0 下的酶活设为100%,其它处理组用相对酶活表示。
1.4.5.4 金属离子对酶活的影响
在粗酶液中分别加入终浓度1 mmol/L 的Cu2+、Fe2+、Mn2+、Ca2+、Mg2+、Co2+和Zn2+溶液,孵育90 min 后,在最适温度和pH 值下,测定残余酶活。以不加金属离子的粗酶液为对照。
1.4.5.5 蛋白酶抑制剂和有机试剂对酶活的影响
在粗酶液中分别加入终浓度5 mmol/L 的SDS、PMSF、TPCK 和EDTA 等蛋白酶抑制剂,在粗酶液中分别加入终浓度1%的吐温20、吐温80、曲拉通X-100和双氧水,孵育90 min,在最适酶反应温度和pH 值下,测定残余酶活。以不加蛋白酶抑制剂和有机试剂的粗酶液为对照。
1.4.5.6 酶促反应动力学测定
参考Farooq 等[11]的方法进行动力学常数的测定。在最适反应温度和pH 值条件下,将粗酶液与不同浓度(0%、0.1%、0.2%、0.3%、0.4%、0.6%和0.8%)的酪蛋白溶液,反应10 min,于680 nm 处测量其吸光值,根据米氏方程计算米氏常数Km和最大反应速率Vmax。
1.4.6 统计分析
数值用平均值和标准差表示,受试组和对照组间的比较用SPSS 25.0 统计软件中的单因素ANOVA 检验进行方差分析,并用邓肯氏进行多重比较,P<0.05被认为具有统计学意义。
2 结果与分析
2.1 菌株的筛选与鉴定
初筛低温蛋白酶产生菌株及目标菌株的菌落和菌体形态特征见图1。
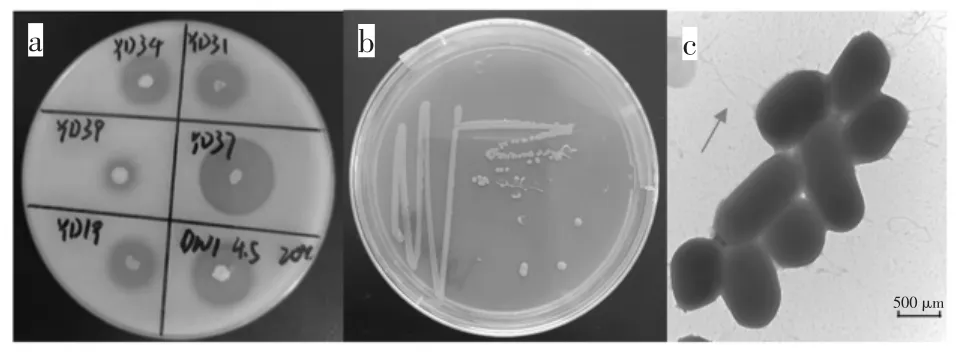
图1 低温蛋白酶产生菌株的筛选Fig.1 Screening of the strain producing cold-adaptive protease
初筛得到产蛋白酶的菌株32 株,通过图1a 比较蛋白水解圈/菌落直径比值,并在LB 中进行产酶活性复筛,发现编号YD37 菌株发酵液上清液酶活最大,可达33.1 U/mL。YD37 在LB 平板上的菌落直径为2~3 mm,呈黄色、不透明(图1b)。在TEM 下菌株有短杆状和球状两种形态,细胞大小约0.5~1.5 μm,有鞭毛(图1c,箭头处)。
YD37 的16S rRNA 基因序列在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库进行Blast N 比对,选择相应模式菌株构建系统发育树,结果如图2 所示。
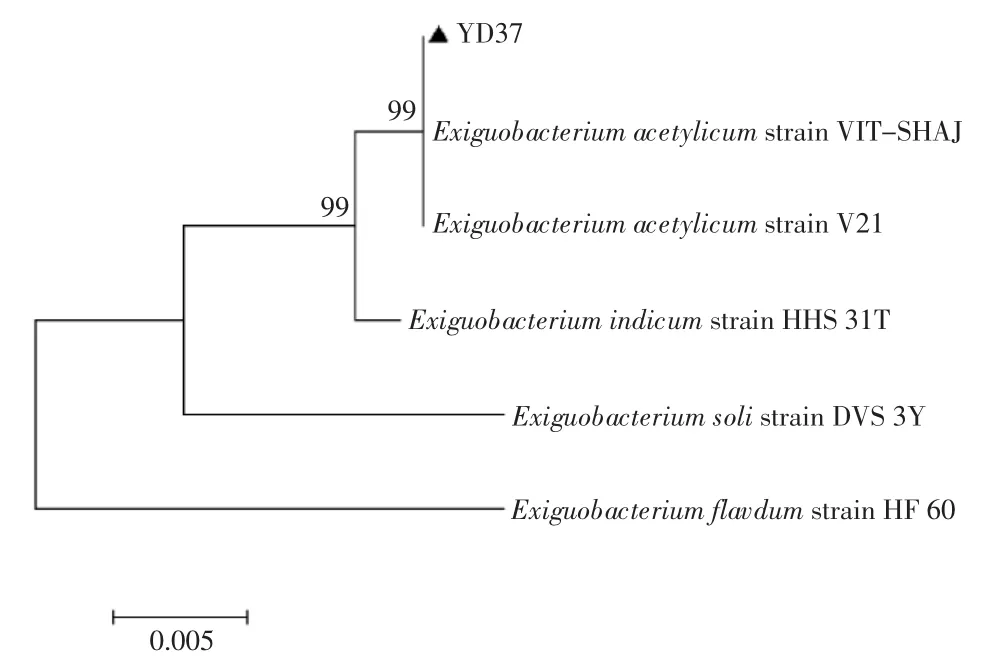
图2 YD37 的16S rRNA 基因系统发育树Fig.2 Phylogenetic tree based on 16S rRNA sequence of YD37 strain
由图2 可知,YD37 与2 株乙酰微小杆菌(E.acetylicum)聚类到一个进化分支上,其相似性达99%。因此,初步判断YD37 为E.acetylicum。将YD37 的16S rRNA 基因序列数据上传到国家微生物科学数据中心(National Microbiology Data Center,NMDC),获得序列号:NMDCN0000RC2。
YD37 菌株的理化性质试验结果见表1。

表1 菌株YD37 生理生化特性Table 1 Physiological and biochemical properties of YD37 strain
表1 的结果与《Bergey's Manual of Systematic Bacteriology(Second Edition)》中对E.acetylicum 的描述一致,进一步确定YD37 为E.acetylicum,将其命名为E.acetylicum YD37。同时《Bergey's Manual of Systematic Bacteriology(Second Edition)》认为E.acetylicum 具有短杆状和球状两种形态,一般年幼细胞一般为短杆菌状,年老之后则退化成球状,同样见于图1c。Exiguobacterium 属微生物分布极为广泛,在深海、永久冻土和海鲜加工厂等低温环境中均有发现[12]。其中,E.acetylicum 是近年来发现的一种极具应用价值的益生菌,其菌落呈黄色,色素至少包含了6 种胡萝卜素,且在抗炎、抗肿瘤和抗氧化方面表现出应用潜能[13]。
2.2 YD37 产低温蛋白酶的分离纯化与鉴定
YD37 发酵液离心后的上清液经不同饱和度硫酸铵沉淀后上清液中残余的酶活见图3。

图3 不同硫酸铵沉淀后上清液中相对残余酶活Fig.3 Relative activity of enzyme in the supernatant after precipitation with ammonium sulfate
由图3 可知,60%饱和度硫酸铵沉淀后的上清液中残余酶活仅为3.2%,表明该浓度下可实现96.8%低温蛋白酶的有效沉淀。
硫酸铵沉淀后的蛋白电泳及酶谱试验结果见图4。

图4 沉淀蛋白的SDS-PAGE 及底物浸泡酶谱分析Fig.4 Electrophoresis and zymography of the precipitated protein
由图4 可知,60%饱和度硫酸铵沉淀中主要存在两条蛋白条带,位于约30~45 kDa 之间。有报道显示,不同微生物来源的低温蛋白酶的分子量差异极大,从23 kDa 到115 kDa 不等[1]。采用底物浸泡酶谱法可在蛋白凝胶上定位低温蛋白酶的位置[14-15]。底物浸泡酶谱法结果显示45 kDa 处条带出现具有明胶水解区域,表明该处条带具有低温蛋白酶活性。
用DEAE-80S 进一步纯化低温蛋白酶后的蛋白电泳及电泳条带的质谱鉴定结果分别如图5 和表2所示。
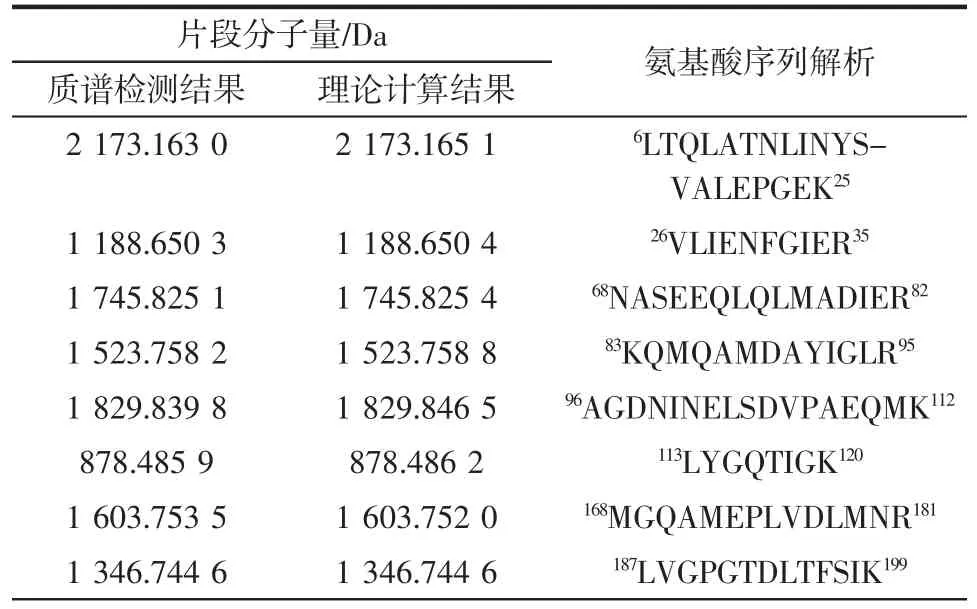
表2 蛋白酶的肽指纹图谱验证Table 2 Identification of protease by peptide mass fingerprinting
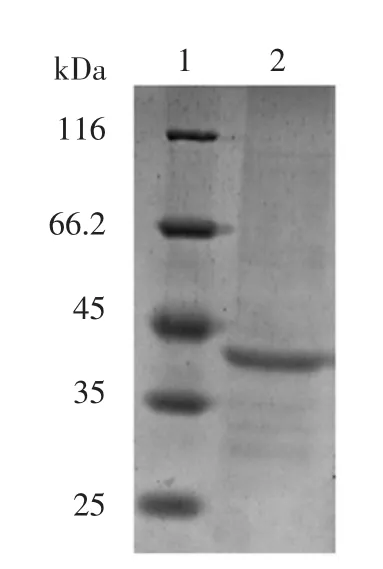
图5 DEAE 层析柱纯化的蛋白电泳分析Fig.5 Electrophoresis of the protease purified by DEAE column
由图5 可知,45 kDa 处的目的条带位于0.3 mol/L的NaCl 洗脱组分中。由表2 可知,蛋白条带水解后,共解析出13 条肽段。将各肽段与E.acetylicum 基因组推导出的蛋白序列比对,发现所有序列可匹配到一条氨肽酶上(登录号:WP_149427726.1)。因此,初步判断该低温蛋白酶可能是来源于E.acetylicum 的一种氨肽酶。
从E.acetylicum YD37 的基因组中克隆出氨肽酶基因,将克隆的该低温蛋白酶基因及翻译后的蛋白序列上传到NMDC,获得相应的序列号:NMDCN-00011VG(核酸序列)和NMDCP0000001(蛋白序列)。该核酸序列含有1 110 bp 个碱基,编码一条由370 个氨基酸残基组成的蛋白序列。进一步的生物信息学分析发现,其属于Peptidase M29 家族,且不存在信号肽序列。在UniProt 数据库中对目的蛋白酶序列进行Blast N 分析,发现同源性最高的4 条序列均注释为金属氨肽酶。
E.acetylicum YD37 氨肽酶序列其他微生物来源的4 条金属氨肽酶序列对齐结果见图6。

图6 不同微生物来源的金属氨肽酶氨基酸序列比对Fig.6 Amino acid sequence alignment of aminopeptidases from microorganisms
由图6 可知,对上述5 条序列进行对齐后,其结合金属离子结合位点的氨基酸残基E216、E281、E301、H308、H327 和D329 高度保守。综上所述,本研究从E.acetylicum YD37 中分离的低温蛋白酶属于金属氨肽酶。之前,有低温环境中的Psychrophiles 产低温氨肽酶的研究[15-16],但尚未发现E.acetylicum 产氨肽酶的报道。
2.3 YD37 产酶的发酵工艺研究
温度对E.acetylicum YD37 生长和产酶的影响见图7。

图7 温度对YD37 生长和产酶的影响Fig.7 Effects of temperature on the growth and enzyme production of YD37
由图7 可知,E.acetylicum YD37 的最适生长温度为25 ℃(OD 值14.4,酶活63.3 U/mL),而最适产酶温度则为20 ℃(OD 值12.3,酶活85.0 U/mL)。胞外酶产生菌的热抑制是低温微生物的普遍特征,其最适生长温度常常高于最适产酶温度[17]。类似的研究显示,Chryseobacterium sp.和Planococcus sp.的最适生长温度菌均高于最适产低温蛋白酶的酶温度[18-19]。通过前期单因素和响应面优化研究,在50 L 规模的发酵罐中,对E.acetylicum YD37 产酶的中试工艺进行研究,发酵24 h 后,经检测上清中酶活达到273.5 U/mL,较摇瓶水平的33.1 U/mL,提高了8.26 倍。通过优化提高低温蛋白酶产量的研究也见于相关报道,Wang 等[6]和Białkowska 等[20]分别通过优化使菌株Colwellia sp.NJ341 和Sporobolomyces roseus LOCK 1 119 合成低温蛋白酶的产量分别提高了3 倍和4 倍。极端微生物通常难以培养,未来低温蛋白酶的规模化应用,需要在极端微生物发酵工艺方面有所突破[9]。另一方面,使用基因工程菌对低温蛋白酶进行异源表达,可能也代表了低温蛋白酶规模化生产的方向[1,9]。目前已有关于构建低温酶表达的基因工程菌的初步研究[8,21-22]。
2.4 低温氨肽酶的表征
2.4.1 低温氨肽酶的结构预测
E.acetylicum YD37 产低温氨肽酶的一级结构,分子量和等电点分别为41 521.96 Da 和4.66。之前有研究对低温酶结构特征归纳,其序列中含有较多甘氨酸、丙氨酸等短侧链氨基酸残基,为构象提供了更大的灵活性,而具有刚性结构的脯氨酸则含量较低,同时三级结构表面的亲水性由带负电荷的氨基酸提供[1,8,15]。本研究分离的低温氨肽酶氨基酸序列中甘氨酸和丙氨酸残基占比达14.9%,脯氨酸含量仅有4.9%,带负电荷氨基酸残基占比高达15.4%。
通过序列比对发现,该酶缺乏已知结构的同源蛋白(相似性均小于30%),因此采用线串法模拟结构。E.acetylicum YD37 产低温氨肽酶的结构预测结果见图8。

图8 氨肽酶的三维结构模拟Fig.8 Three-dimensional structure modeling of the aminopeptidase
由图8a 可知,待测序列同来源于肺炎链球菌(Streptococcus pneumoniae)的氨肽酶同源性最高[23],基于该模板预测350 个氨基酸残基(95%的序列)已被模建,可信度为100%,结构中包含了14 个α-螺旋结构,19 个β-折叠结构。由图8b 可知,三级结构被负电荷表面覆盖(红色区域)。由图8c 可知,空间结构C 端有两个较大的空腔,空腔周围存在较多短侧链和亲水性氨基酸残基。作为可能的底物结合位点,低温酶空腔周围的短侧链和亲水性氨基酸残基多于中温酶,可为其提供更高的构象动力学,进而增强了其在低温下的酶活[8,15]。
2.4.2 温度、pH 值、金属离子、有机试剂及蛋白酶抑制剂对低温氨肽酶粗酶酶活的影响
温度、pH 值、金属离子、有机试剂及蛋白酶抑制剂对低温氨肽酶粗酶酶活的影响见图9。
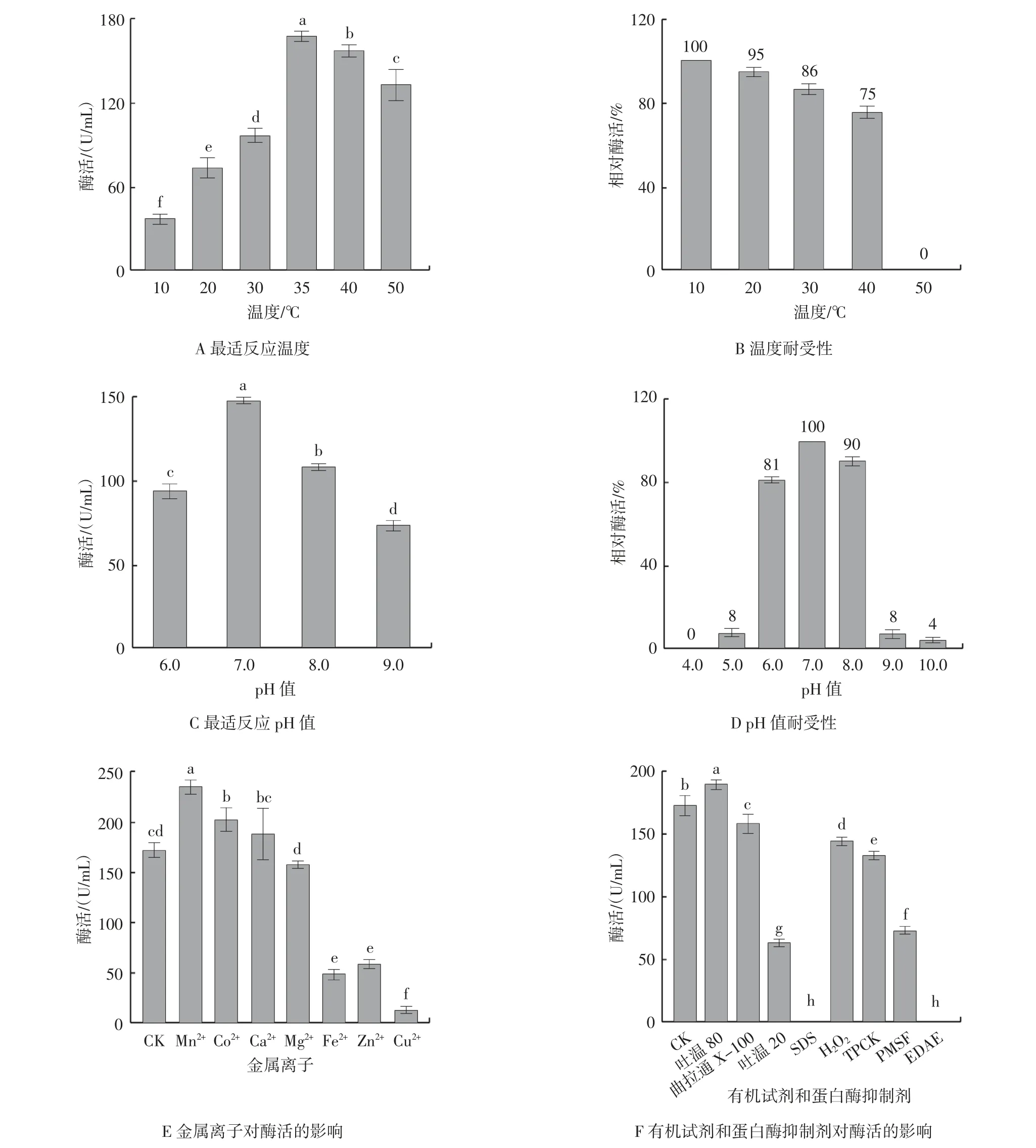
图9 温度、pH 值、金属离子、有机试剂及蛋白酶抑制对酶活的影响Fig.9 Effects of temperature,pH,metal ions,surfactant,and inhibitors on enzyme activity
由图9A 可知,35 ℃酶活最高,为167.46 U/mL,在10 ℃和20 ℃的低温条件下仍具有酶活,分别为36.9、73.0 U/mL,且不同温度下酶活差异均达到显著水平(P<0.05)。低温下具有较高酶活是低温蛋白酶最主要的特征,据报道低温蛋白酶温度的作用范围为10~60 ℃[1]。由图9B 可知,随着温度升高,相对酶活逐渐降低,50 ℃处理组相对酶活完全丧失,表明该酶的温度耐受性较差。研究表明,低温蛋白酶难以耐受50 ℃以上的高温环境[13,16,24]。对于高温环境的不耐受是低温蛋白酶的普遍特征,利用这一特性,通过热处理可实现酶促反应的有效控制[10]。由图9C 可知,该酶最适pH 值为7.0,此时酶活达到147.33 U/mL,属中性蛋白酶,不同pH 值的酶活差异均达到显著水平(P<0.05)。由图9D 可知,该酶在pH6.0~8.0 内孵育90 min,相对酶活均能保持在75%以上。但是当pH 值小于6.0 或大于9.0 时,相对酶活急剧下降,表明该酶pH 值耐受范围较窄。上述结果表明,低温蛋白酶在低温下保持酶活,可能需要牺牲其结构稳定性。Huston 等[24]研究表明产自Colwellia psychrerythraea 34H 的低温蛋白酶对温度(<45 ℃)和pH 值(6.0~8.5)耐受范围同样较窄。由图9E 可知,酶活显著受到Mn2+和Co2+激活,而Zn2+、Fe2+和Cu2+则表现出对酶活的抑制作用(P<0.05),Ca2+和Mg2+对酶活的影响则不显著(P>0.05)。据报道,在已知的15 个氨肽酶家族中,M24 家族中常以Mn2+和Co2+作为活性中心[23]。因此本研究分离出的低温氨肽酶可能属于该家族。由图9F 可知,粗酶在吐温80 和曲拉通X-100 及漂白剂H2O2中酶活均保持83%以上;表明该酶在洗涤剂中具有应用潜能[11]。SDS 对酶活抑制作用最强,达100%(P<0.05);表明氢键在酶促反应中具有重要作用[25]。丝氨酸蛋白酶抑制剂PMSF 和TPCK 对酶活表现出一定的抑制作用(P<0.05);表明该酶可能具有丝氨酸蛋白酶的某些特征[2]。金属离子螯合剂EDTA的抑制作用最强,直接导致酶活丧失,进一步表明该酶发挥作用需要金属离子参与[24]。
2.4.3 低温氨肽酶的动力学常数
Km和Vmax是酶促反应的基本动力学常数,是酶催化效率的重要指标。以不同浓度的酪蛋白为底物,采用Lineweave-Burk 双倒数法作图,得到蛋白吸光度标准曲线回归方程为Y=0.313 8X+0.226 7,R2=0.998 8,经计算低温蛋白酶的动力学常数Km为1.38 mg/mL,Vmax为4.41 mg/(mL·min)。
3 结论
本研究从江苏沿海地区的低温土样中分离得到1株能够产低温蛋白酶的E.acetylicum YD37。经鉴定,该低温蛋白酶属于氨肽酶家族,该酶由370 个氨基酸残基组成,氨基酸残基组成和空间结构模拟表明其符合低温蛋白酶的一般特征。通过对E.acetylicum YD37产酶的工艺研究,酶活提高了8.26 倍。对该酶特征研究表明,酶活性依赖于Mn2+和Co2+;最适作用温度为35 ℃,20 ℃仍有43.6%的活性,而50 ℃处理90 min 酶活则完全丧失;最适pH 值为6.0,仅可耐受pH6.0~8.0环境条件。因此,本研究分离的低温蛋白酶可满足洗涤、制革、食品加工和环境治理中对低温环境的需求,同时高温环境的不耐受和较窄的pH 值耐受范围极大地方便了对酶促反应的控制,使其具备了良好的应用前景。
