微生物降解制备水溶性茯苓多糖及其抗氧化活性
2023-08-12张熠璇雷敏黄家浩蔡俊
张熠璇,雷敏,黄家浩,蔡俊
(湖北工业大学,湖北 武汉 430068)
茯苓(Poria cocos)隶属于真菌门(Eumycophyta)、担子菌亚门(Basidiomycotina)、层菌纲(Hymenomycetes)、非褶菌目(Aphyllophorales)、多孔菌科(Polyporaceae)、茯苓属(Wolfiporia),又名茯灵、茯菟、松柏芋等[1]。茯苓具有镇定安神[2]、健脾利尿的功效[3],具有一定的食养特性。多糖是茯苓中的主要成分,其中约80%以上为水不溶性多糖,这种水不溶性多糖已被证实是一种含有少量β-(1,6)支链的β-(1,3)-葡聚糖[4],由于该多糖不溶于水,几乎没有生物活性,需要对其进行结构修饰以达到提高溶解度和生物活性的目的。
近年来,对茯苓多糖(Poria cocos polysaccharides,PCP)的增溶改性主要通过化学法引入官能团对其进行结构修饰,如羧甲基化[5]、硫酸酯化[6]、磷酸化[7]等。但化学法存在高耗能和溶剂残留的缺点,探索生物过程作为修饰多糖结构的替代方法是十分必要的。生物修饰大多通过酶降解多糖制备低聚糖[8-9],Bian 等[10]利用水解酶定向切除糖苷键,使分子量降低,得到水溶性茯苓多糖。目前大多是利用微生物发酵作为提高多糖提取率的一种前处理方法,利用微生物发酵法直接降解多糖的研究鲜有报道[11-13]。微生物发酵利用完整的微生物细胞作为生物催化剂对外源化合物进行催化转化,使发酵产酶的过程与酶作用过程合二为一,能够缩短生产周期,降低生产成本[14]。
本文利用先前筛选出的一株能够高效降解不溶性茯苓多糖的琉球曲霉,对其降解多糖的发酵条件进行优化,对降解后得到的水溶性茯苓多糖进行分离纯化,得到单一组分的水溶性茯苓多糖,并进行红外光谱分析、分子量的测定和抗氧化活性的评价。利用微生物发酵法,以绿色环保的方式对不溶性茯苓多糖进行降解,提高生物活性,对于拓展其在食品、医药领域的应用具有重要意义。
1 材料与方法
1.1 材料与试剂
茯苓:产自湖北英山;琉球曲霉:湖北工业大学发酵工程教育部重点实验室保藏菌株;葡萄糖、硫酸铵、氯化钠、苯酚、硫酸、硝酸钠、无水乙醇、硫酸亚铁、铁氰化钾、三氯化铁、正丁醇、三氯甲烷(均为分析纯):国药集团化学试剂有限公司;蛋白胨(生物试剂):北京双旋微生物培养基制品厂;透析袋(截留量1000 Da)、DEAE-52 纤维素:上海源叶生物科技有限公司;Sephadex G-100 葡聚糖凝胶填料:美国Pharmacia 公司。
1.2 仪器与设备
酶标仪(SYNERGY2):美国BioTek 公司;全自动生化培养箱(ZSD-1270):上海智城分析仪器有限公司;高速冷冻离心机(3K15):德国Sigma 公司;高效液相色谱仪(LD-20 AD):日本Shimadzu 公司;水浴锅(HH-S):巩义市予华仪器有限责任公司。
1.3 培养基
种子培养基:葡萄糖40 g/L,蛋白胨10 g/L,pH自然。
斜面培养基:葡萄糖40 g/L,蛋白胨10 g/L,琼脂20 g/L,pH 自然。
发酵培养基:不溶性茯苓多糖10 g/L,(NH4)2SO45 g/L,NaCl 3 g/L,pH 自然。
1.4 方法
1.4.1 不溶性茯苓多糖的制备
向茯苓粉末中加入适量体积的无水乙醇,浸泡并搅拌12 h,重复操作2 次,40 ℃烘干,得到脱脂茯苓粉末。称取适量干燥的脱脂茯苓粉末,按料液比1∶20(g/mL)加入超纯水,沸水浴提取2 h,过滤,弃去滤液,收集残渣重复提取2 次。向滤渣中按料液比1∶40(g/mL)加入0.5 mol/L NaOH 溶液,在4 ℃冰箱中静置12 h,8 000 r/min 离心20 min,收集上清液,向上清液中加入冰醋酸,调节pH 值至7 左右,离心并收集胶状沉淀,用超纯水洗涤沉淀,真空冷冻干燥,得到不溶性茯苓多糖。
1.4.2 微生物降解不溶性茯苓多糖条件优化
将琉球曲霉接种于斜面培养基,30 ℃活化48 h,将活化好的菌种接种于种子培养基,30 ℃培养36 h,作为种子液备用。以发酵时间、发酵温度、初始发酵pH值、转速、接种量为影响因子进行单因素试验。固定发酵条件为发酵时间48 h、发酵温度30 ℃、初始发酵pH自然、转速180 r/min,接种量10%。分别考察发酵时间(0、12、24、36、48、60、72 h)、发酵温度(22、26、30、34、38 ℃)、初始发酵pH 值(4、5、6、7、8、9)、转速(140、160、180、200、220 r/min)、接种量(2%、4%、6%、8%、10%)对不溶性茯苓多糖降解率的影响。采用苯酚-硫酸法测定多糖含量,根据下列公式计算不溶性茯苓多糖降解率。
式中:D 为不溶性茯苓多糖降解率,%;m1为发酵液中水溶性茯苓多糖含量,g;m2为不溶性茯苓多糖质量,g。
1.4.3 水溶性茯苓多糖的纯化
发酵结束后,8 000 r/min 离心20 min,收集上清液,浓缩。向浓缩后的发酵液中加入1/4 体积的Sevage试剂,重复脱蛋白3 次。将脱除蛋白后的粗多糖溶液醇沉,透析,冻干,得到粗水溶性茯苓多糖。
DEAE-52 离子交换柱层析:称取粗水溶性茯苓多糖120 mg,溶于3 mL 超纯水中,经0.45 μm 滤膜过滤后上样至已处于平衡状态的DEAE-52 纤维素层析柱(规格2.6 cm×40 cm)中,分别用0.1、0.3、0.5 mol/L NaCl和超纯水洗脱,流速0.5 mL/min,自动部分收集器收集,收集速度10 min/管,苯酚-硫酸法跟踪检测,收集洗脱液,透析,冻干。
Sephadex G-100 凝胶柱层析:称取经离子交换柱层析分离得到的茯苓多糖样品,加入适量超纯水溶解,经0.45 μm 滤膜过滤后上样至Sephadex G-100 凝胶层析柱(规格1.0 cm×40 cm)中,超纯水为洗脱液进行洗脱并收集,流速0.3 mL/min,收集速度10 min/管,苯酚-硫酸法跟踪监测,收集洗脱液,旋蒸浓缩,透析,真空冷冻干燥,得到纯化的单一组分的水溶性茯苓多糖,命名为WPCP。
1.4.4 红外光谱测定
采用KBr 压片法进行水溶性茯苓多糖红外光谱测定。称取适量干燥的水溶性茯苓多糖,加入KBr 后在玛瑙研钵中充分研磨,压片,在4 000~400 cm-1范围内进行红外扫描。
1.4.5 分子量测定
采用高效凝胶渗透色谱法(high performance gel permeation chromatography,HPGPC)测定水溶性茯苓多糖WPCP 分子量。称取水溶性茯苓多糖10 mg,用0.1 mol/L 硝酸钠溶液配制成1.0 mg/mL 的样品溶液,0.22 μm 滤膜过滤后进行HPGPC 分析,每个样品平行进样3 次,记录保留时间,按标准曲线计算相对分子质量。分子量标准曲线的回归方程为y=-0.462 2x+10.137,R2=0.991 7。
HCGPC 条件:示差折光检测器,WelchXtimateSEC-500 柱(7.8 mm×300 mm,5 μm),流动相为0.1 mol/L 硝酸钠溶液,流速0.8 mL/min,进样量20 μL。
1.4.6 抗氧化活性测定
配制不同浓度的水溶性茯苓多糖样品溶液,按照参考文献[15-17]中的方法,分别测定其对DPPH 自由基清除率、羟自由基清除率和超氧阴离子自由基清除率。
1.5 数据处理
取3 次试验数据的平均值并计算其误差,用Origin 8.0 软件作图。
2 结果与分析
2.1 微生物降解不溶性茯苓多糖条件优化结果
不同发酵时间、发酵温度、初始发酵pH 值、转速及接种量对不溶性茯苓多糖降解率的影响见图1~图5。
由图1 可知,随着发酵时间的延长,不溶性茯苓多糖的降解率逐渐提高,当发酵时间为36 h 时,菌株对不溶性茯苓多糖的降解率最高,达到53.97%,继续延长发酵时间,多糖降解率变化不明显,故选择36 h 作为菌株的发酵时间。
由图2 可知,随着发酵温度的升高,不溶性茯苓多糖的降解率先升高后降低。当发酵温度为26 ℃时,不溶性茯苓多糖的降解率最高,为56.88%,随着温度的进一步升高,不溶性茯苓多糖的降解率逐渐下降,推测是由于温度较高影响了菌株的生长代谢,从而影响了多糖降解效率,故选择26 ℃作为不溶性茯苓多糖降解的最适发酵温度。
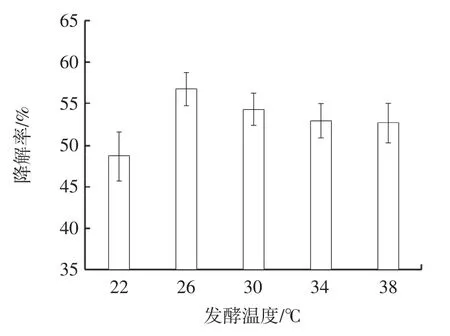
图2 发酵温度对不溶性茯苓多糖降解率的影响Fig.2 The effect of fermentation temperature on degradation rate of insoluable PCP
由图3 可知,初始发酵pH 值为4~7 时,随着初始发酵pH 值的逐渐升高,不溶性茯苓多糖的降解率逐渐提高,当初始发酵pH 值为7 时,不溶性茯苓多糖的降解率最高,为57.46%,当pH 值继续升高,不溶性茯苓多糖的降解率开始下降。说明在中性条件下,有利于菌株生长代谢,过酸或过碱的条件均不利于菌株生长代谢并降解不溶性茯苓多糖,故选择pH 值为7 作为初始发酵pH 值。

图3 初始发酵pH 值对不溶性茯苓多糖降解率的影响Fig.3 The effect of primary medium pH on degradation rate of insoluable PCP
由图4 可知,随着转速的提高,不溶性茯苓多糖的降解率先升高后降低。当转速为160 r/min 时,不溶性茯苓多糖的降解率最高,为58.27%,当转速继续增加时,产生过大的剪切力不利于菌丝体生长,不溶性茯苓多糖的降解率随之下降,故选择转速为160 r/min。
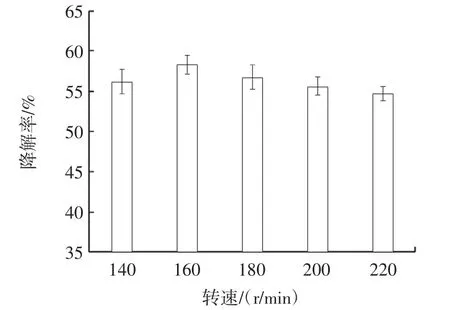
图4 转速对不溶性茯苓多糖降解率的影响Fig.4 The effect of rotation speed on degradation rate of insoluable PCP
由图5 可知,接种量为2%~8%,随着接种量的增加,不溶性茯苓多糖的降解率逐渐增加,接种量为8%时,不溶性茯苓多糖的降解率最高,为60.25%,当接种量继续增加时,不溶性茯苓多糖的降解率明显下降,故选择8%作为发酵降解不溶性茯苓多糖的最适接种量。

图5 接种量对不溶性茯苓多糖降解率的影响Fig.5 The effect of inoculation volume on degradation rate of insoluable PCP
2.2 水溶性茯苓多糖纯化结果分析
水溶性茯苓多糖经DEAE-52 离子交换柱层析分离后的洗脱曲线如图6 所示。
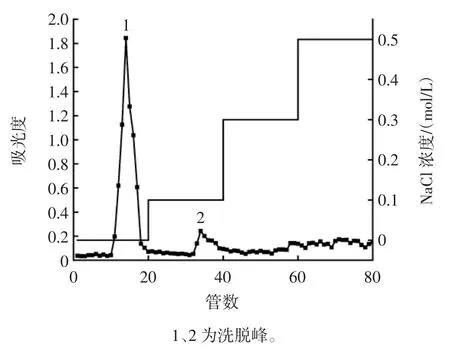
图6 DEAE-52 离子交换柱层析洗脱曲线Fig.6 Elution profiles of DEAE-52 cellulose column
由图6 可知,经超纯水、0.1、0.3、0.5 mol/L NaCl 洗脱后,得到2 个洗脱峰,经超纯水洗脱得到洗脱峰1,经0.1 mol/L NaCl 洗脱得到洗脱峰2,洗脱峰峰形较为对称,表明分离效果较好。由于洗脱峰2 中多糖含量较少,故选择洗脱峰1 进行后续研究。
组分1 经Sephadex G-100 凝胶柱层析分离后的洗脱曲线如图7 所示。

图7 Sephadex G-100 凝胶柱层析洗脱曲线Fig.7 Elution profiles of Sephadex G-100 column
由图7 可知,经葡聚糖凝胶层析柱分离后得到洗脱峰1-1,该洗脱峰高且对称,表明分离效果较好,将洗脱液收集并冻干,得到相对均一的水溶性茯苓多糖(WPCP)组分。
2.3 红外光谱结果分析
水溶性茯苓多糖WPCP 的红外光谱如图8 所示。

图8 水溶性茯苓多糖WPCP 的红外光谱Fig.8 The FT-IR spectrum of WPCP
由图8 可知,3 384.5 cm-1处是非游离O-H 键的伸缩振动,2 929.3 cm-1处是糖类甲基、亚甲基C-H 键的伸缩振动,1 068.3 cm-1和1 035.6 cm-1处的吸收峰为C-O-C 键和C-OH 键的伸缩振动,869.1 cm-1处是β-D 糖苷键的特征吸收[10,18-19]。以上结果表明,水溶性茯苓多糖WPCP 具有一般糖类物质的特征结构。
2.4 分子量测定结果
水溶性茯苓多糖(WPCP)的凝胶渗透色谱图如图9 所示。
由图9 可知,该样品具有一个单一的对称峰,说明仅含有一种分子量分布的多糖,其保留时间为13.256 min,根据标准曲线计算可知,该多糖的相对分子质量为1.51×104Da,本试验制得的不溶性茯苓多糖利用黏度法测得的分子量为51.29×104Da,与不溶性茯苓多糖相比,WPCP 的分子量有了明显下降。
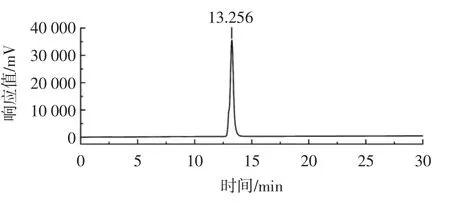
图9 水溶性茯苓多糖WPCP 的凝胶渗透色谱图Fig.9 Gel permeation chromatography of WPCP
2.5 水溶性茯苓多糖抗氧化活性分析
2.5.1 DPPH 自由基清除能力分析
水溶性茯苓多糖(WPCP)对DPPH 自由基的清除能力如图10 所示。

图10 WPCP 对DPPH 自由基清除能力Fig.10 Scavenging ability of DPPH radical on WPCP
由图10 可知,随着WPCP 浓度不断增加,其对DPPH 自由基的清除率也逐渐提高,但对DPPH 自由基的清除能力小于VC,未降解的不溶性茯苓多糖(PCP)对DPPH 自由基几乎不具有清除能力。当WPCP 的浓度为4 mg/mL 时,其对DPPH 自由基的清除率达到了59.10%,WPCP 的IC50为3.79 mg/mL,说明降解后的WPCP 活性基团暴露,可以作为供氢体清除DPPH 自由基[20]。
2.5.2 羟自由基清除能力分析
水溶性茯苓多糖(WPCP)对羟自由基的清除能力如图11 所示。

图11 WPCP 对羟自由基清除能力Fig.11 Scavenging ability of hydroxyl radical on WPCP
由图11 可知,随着WPCP 浓度的增加,其对羟自由基的清除率逐渐提高,具有一定的浓度相关性,在8 mg/mL 时,PCP、WPCP、VC对羟自由基的清除率分别为1.32%、57.1%、99.41%,其中,WPCP 的IC50为6.10 mg/mL。试验结果表明,多糖的溶解性对抗氧化功能的提高至关重要,多糖溶解性提高有利于抑制羟自由基的产生[21]。
2.5.3 超氧阴离子自由基清除能力分析
超氧阴离子自由基的化学性质非常活泼,在生物体内,超氧阴离子自由基容易转化为羟自由基、过氧化氢、单线态氧等,产生氧化应激损伤[22-23]。WPCP 对超氧阴离子自由基的清除能力如图12 所示。
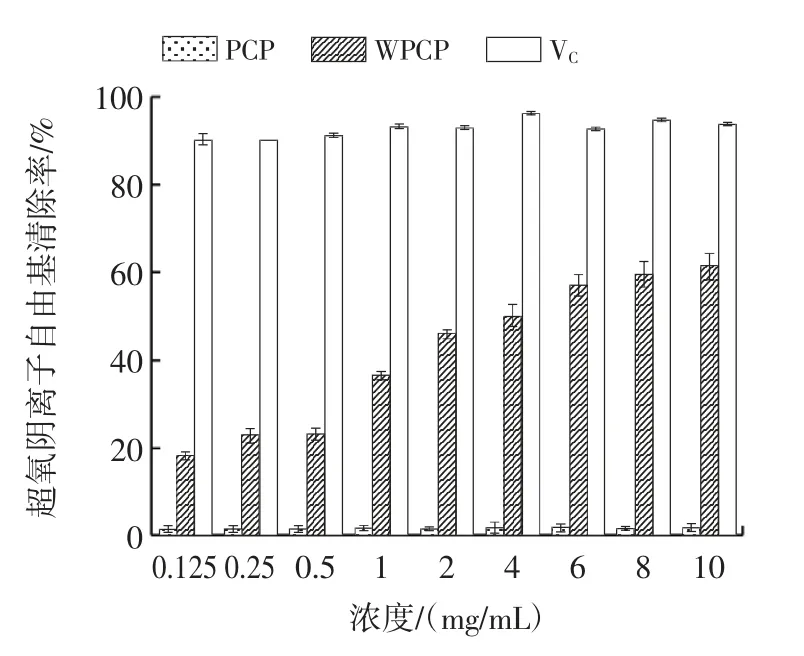
图12 WPCP 对超氧阴离子自由基清除能力Fig.12 Scavenging ability of superoxide anion free radical on WPCP
由图12 可知,WPCP 对超氧阴离子自由基的清除能力随浓度的增加而增加。当浓度为4 mg/mL 时,PCP、WPCP、VC对超氧阴离子自由基的清除率分别为1.53%、50.16%、96.56%,其中,WPCP 的IC50为3.99 mg/mL。试验结果表明,多糖溶解性的提高对抑制超氧阴离子自由基的产生具有促进作用,且具有一定的浓度相关性。
3 结论
本文利用琉球曲霉对不溶性茯苓多糖进行发酵降解,通过单因素试验获得最佳发酵条件为发酵时间36 h、发酵温度26 ℃、初始发酵pH 值7、转速160 r/min、接种量8%,在最佳发酵条件下,不溶性茯苓多糖的降解率为60.25%。通过分离纯化,得到一种相对分子质量为1.51×104Da 的水溶性茯苓多糖,与不溶性茯苓多糖相比,该多糖分子量降低,溶解性提高,抗氧化能力得到改善。
