芝麻分离蛋白制备及其白蛋白乳液的稳定性质
2023-08-12王一丹孙烨罗水忠
王一丹,孙烨,罗水忠
(合肥工业大学食品与生物工程学院,安徽 合肥 230009)
芝麻蛋白的氨基酸种类和含量十分丰富,且含硫氨基酸含量较高,有利于人体消化和吸收。榨油后的芝麻粕是一种优良的植物蛋白资源。开展芝麻粕中芝麻蛋白的研究,不仅有利于芝麻粕的加工应用,而且有助于提高添加芝麻蛋白食品的营养价值[1-2]。
蛋白质属于两亲性生物大分子,可以在油水界面上吸附,并在界面上展开,使系统在热力学上更加稳定,是制作酱料、奶油、甜点、肉制品和饮料等食品的重要乳化剂[3]。Zaghloul 等[4]和Khalid 等[5]研究了芝麻浓缩蛋白、芝麻分离蛋白的理化性质和功能活性,并将其作为营养补充剂用于饮料制作,获得了良好的乳化稳定效果[6]。根据芝麻蛋白的溶解性差异,可将其分为水溶性白蛋白、盐溶性球蛋白、溶于醇/水混合物的醇溶蛋白和溶于稀碱的谷蛋白4 类。Rivas 等[7]研究发现芝麻粕中蛋白质组成分别为白蛋白8.6%、球蛋白67.3%、醇溶蛋白1.4%和谷蛋白6.9%。虽然已有对芝麻蛋白的提取工艺、蛋白亚基组成、理化性质以及加工特性(如保水性、保油性、发泡性和乳化性)等方面的研究[8-9],但对芝麻蛋白的深加工应用的研究较少。
本文采用Osborne 法[10]提取脱脂芝麻粕中的白蛋白、球蛋白、醇溶蛋白和谷蛋白等芝麻分离蛋白组分,评价芝麻分离蛋白及其组分的理化性质、加工性能和乳化潜力,并探究油相体积分数、蛋白质浓度和离子强度对芝麻白蛋白乳液性质的影响,以期对高效利用芝麻粕、提高芝麻蛋白的深加工水平、拓展芝麻分离蛋白的应用领域提供参考。
1 材料与方法
1.1 材料与试剂
白芝麻籽:市售;大豆分离蛋白(soybean protein isolate,Soy-PI)(蛋白质含量≥95%):上海源叶生物技术有限公司;山茶油:金龙鱼益海嘉里(中国)有限公司;预染低分子量Marker(14.4~97.4 kDa)、尼罗红(N3013)、尼罗蓝(N0766):上海生工生物工程技术服务有限公司。
1.2 仪器与设备
MA-S1 威旗家用榨油机:中山市麦尔尼电器制造有限公司;UDK-142 全自动凯氏定氮仪:香港嘉盛科技有限公司;FD-1B-50 冷冻干燥机:北京博医康实验仪器有限公司;DYC-MINI4 电泳仪:美国Bio-Rad 公司;T18 高速剪切机:德国IKA 公司;MS-2000 激光粒度分析仪:英国Malvern 公司;FV1000 激光共聚焦显微镜、80i 光学显微镜:日本Nikon 公司;DHR-3 流变仪:美国TA 公司。
1.3 碱溶酸沉法制备芝麻分离蛋白
白芝麻籽经粉碎、正己烷脱脂3 次后得到脱脂芝麻粕。脱脂芝麻粕与去离子水按固液比1∶10(g/mL)混合,调节混合体系pH 值至10,25 ℃室温下搅拌2 h,8 000 r/min 离心30 min 后取上清液,将上清液pH 值调至4.5,静置30 min 后取沉淀,水洗离心(8 000 r/min、30 min)2 次,冻干后获得芝麻分离蛋白。
1.4 Osborne 法制备芝麻分离蛋白组分
参考文献中Osborne 法并有所改进[10]。脱脂芝麻粕与去离子水按固液比1∶10(g/mL)混合,调节混合体系pH 值至10,25 ℃室温下搅拌浸提2 h,8 000 r/min离心30 min 后取上清液,上清液调节pH 值至7,8 000 r/min 离心30 min 后分别收集上清液和离心沉淀物1,上清液冷冻干燥后即得白蛋白;离心沉淀物1溶解在10 mL 5%氯化钠溶液中,8 000 r/min 离心30 min 后分别收集上清液和离心沉淀物2,上清液冻干后即得球蛋白;离心沉淀物2 溶解在10 mL 70%乙醇溶液中,8 000 r/min 离心30 min 后分别收集上清液和离心沉淀物3,上清液冻干后即得醇溶蛋白;离心沉淀物3 溶解在10 mL 0.1 mol/L 氢氧化钠溶液,8 000 r/min离心30 min 后取上清液,冻干后即得谷蛋白。
1.5 芝麻分离蛋白及其组分的理化性质与加工性能分析
1.5.1 蛋白质含量、得率及分子量
芝麻分离蛋白含量测定参考GB/T 6432—2018《饲料中粗蛋白的测定凯氏定氮法》。蛋白质得率计算公式如下。
式中:X 为蛋白质得率,%;d 为提取的芝麻各蛋白组分质量,g;p 为提取的芝麻各蛋白组分的蛋白含量,%;D 为脱脂芝麻粉的质量,g;P 为脱脂芝麻粉蛋白的蛋白含量,%。
芝麻分离蛋白组分分子量测定参考Laemmli[11]的方法,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)法分析。
1.5.2 溶解度
溶解度的测定参考Achouri 等[8]的方法。用去离子水配制浓度为1 mg/mL 的蛋白溶液,pH 值调至3,8 000 r/min 离心30 min 取上清液,通过考马斯亮蓝法测定蛋白质浓度,溶解度表示为离心后上清液中蛋白质含量与离心前样品中蛋白质含量的百分比。
1.5.3 保水性和保油性测定
参考Khalid 等[5]的方法。0.1 g 蛋白置于离心管中,加入10 mL 去离子水,并在3 000 r/min 条件下离心15 min,去除上清液后称取离心管质量,以大豆分离蛋白作为对比。
按照上述方法测定保油性,以10 mL 山茶油替代去离子水。按照下列公式计算每克蛋白质样品的保水性(water holding capacity,WHC)和保油性(oil holding capacity,OHC)。
式中:X 为保水性,g/g;Y 为保油性,g/g;W0为0.1 g蛋白与离心管的总质量,g;W1为离心去除上清液后离心管的质量,g。
1.5.4 发泡性和发泡稳定性测定
称取1 g 蛋白置于100 mL(V0)去离子水中,在10 000 r/min 条件下均质2 min 后,立即记录发泡后泡沫体积V1;放置30 min 后记录25 ℃室温下泡沫体积V2,确定发泡性(foam capacity,FC)和发泡稳定性(foam stability,FS),计算公式如下。
式中:X 为FC,%;Y 为FS,%;V0为去离子水体积,100 mL;V1为蛋白发泡后泡沫体积,mL;V2为蛋白发泡放置30 min 后25 ℃室温下泡沫体积,mL。
1.5.5 乳化性和乳化稳定性测定
根据Sui 等[12]的方法稍加修改。将山茶油加入0.5%蛋白溶液中,直到油相体积分数为20%,使用高速剪切机经10 000 r/min 乳化均质2 min,获得新鲜乳液。用0.1%SDS 将乳液样品稀释至0.05 mg/mL,使用紫外分光光度计在500 nm 下测定初始的吸光度(A0)和放置30 min 后的吸光度(A30)。
乳化性(emulsifying activity index,EAI)和乳化稳定性(emulsifying stability index,ESI)根据以下公式计算。
式中:X 为EAI,m2/g;Y 为ESI,min;N 为样品稀释倍数;C 为蛋白质浓度,g/mL;φ 为油相体积分数,%;A0和A30分别为初始状态和静置30 min 的吸光度。
1.6 油相体积分数、白蛋白浓度和离子强度对乳液性质的影响
1.6.1 芝麻白蛋白乳液制备的单因素试验
将一定浓度的芝麻白蛋白溶液调节pH 值为3,加入一定量的山茶油,25 ℃室温下13 000 r/min 剪切2 min,获得芝麻白蛋白乳液。研究油相体积分数(20%、40%、60%、70%)、白蛋白浓度(1.0%、2.0%、4.0%、6.0%)和离子强度(0、0.01、0.05、0.10、0.20 mol/L NaCl)对乳液粒径分布、流变学特性及微观结构的影响。
1.6.2 乳液的粒径分布
参考Setiowati 等[13]的方法并稍加改进。使用激光粒度仪测定乳液的粒径分布情况(测试时取乳化层),采用体积平均直径d(4,3)表征乳液的粒径分布。
1.6.3 流变学特性
参考Lv 等[14]的试验方法。使用流变仪对乳液样品进行静态流动及动态振荡试验。在静态流动试验中,测定剪切速率为0.1~100 s-1时乳液样品的表观黏度。在动态振荡测量中,振荡频率为0.1~10 Hz,应变值为1%,记录频率扫描试验中样品的储能模量(G')和损耗模量(G'')。
1.6.4 微观结构分析
用光学显微镜和激光共聚焦显微镜观察新制备乳液的微观结构[15]。在光学显微镜下观察并采集明场图片,激光共聚焦显微镜在488 nm 和633 nm 激发波长下观察并采集荧光图像。样品染色方法:每1 mL 乳液中加入50 μL 尼罗蓝(1 mg/mL)和50 μL 尼罗红(1 mg/mL)混合染色,全程避光处理。
1.7 数据统计
每组试验均重复3 次,结果表达为平均值±标准差。采用Origin 8.5 软件绘制图表,SPSS Statistics 19 软件处理数据,通过ANOVA 进行方差分析,设置显著性水平P<0.05。
2 结果与分析
2.1 芝麻分离蛋白及其组分的理化性质和加工性能表征
芝麻分离蛋白及其组分的理化性质和加工性能表征结果见表1。
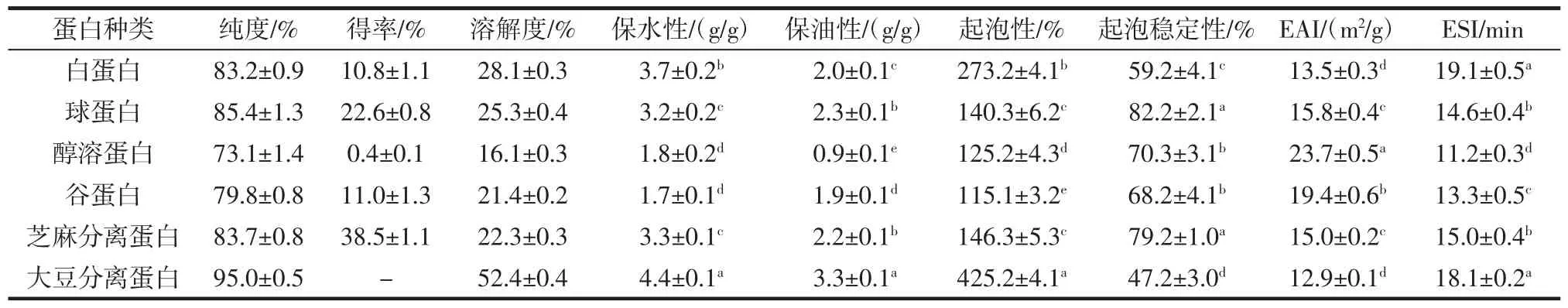
表1 芝麻分离蛋白及其组分的理化性质和加工性能表征Table 1 Characterization of sesame protein isolates and its components
表1 结果显示,采用Osborne 法从脱脂芝麻粕中分级芝麻分离蛋白各组分的得率从高到低依次为球蛋白(22.6%)、谷蛋白(11.0%)、白蛋白(10.8%)和醇溶蛋白(0.4%),得到的4 个蛋白质组分的总得率为44.8%,高于碱溶酸沉淀法提取的芝麻分离蛋白得率(38.5%),说明该提取法可以更高效地从脱脂芝麻粕中提取蛋白质。pH3 时,大豆分离蛋白比芝麻分离蛋白具有更高的溶解度,而且4 种芝麻蛋白组分中,白蛋白的溶解度最高,为(28.1±0.3)%。已有文献报道芝麻分离蛋白的等电点(isoelectric points,pI)在4~5,当pH值低于或高于pI 时,蛋白溶解度均升高。pH 值在3 及以下和9 以上时,芝麻分离蛋白都表现出较好的溶解度,当pH 值高于或低于pI 时,蛋白质带上负电荷或正电荷,蛋白质分子之间的静电斥力和离子水化力阻止它们聚集,使得蛋白质溶解度更大。同一条件下蛋白溶解度的差异可能是由蛋白质类型、固有溶解特性以及蛋白的变性程度造成的[5]。芝麻分离蛋白在酸性环境下表现出良好的溶解性,这有助于其在酸性食品中的应用[6]。
表1 结果还显示,芝麻分离蛋白(sesame protein isolate,Ses-PI)的保水性和保油性均低于大豆分离蛋白(soybean protein isolate,Soy-PI)。芝麻分离蛋白各组分中,白蛋白的保水性最好,球蛋白的保油性最好,这与其侧链基团的极性以及蛋白质的疏水性、变性程度有关[16]。白蛋白的起泡性最好,球蛋白的起泡稳定性最好,泡沫的形成与蛋白质分子吸附在空气/水界面引起表面张力变化有关[17]。与Soy-PI 相比,醇溶蛋白的EAI最高,白蛋白的ESI 最高。结果表明,不同的提取方法和提取条件影响了Ses-PI 及4 个蛋白组分的乳化性能。有文献报道,芝麻分离蛋白与大豆分离蛋白相比具有优异的乳化性能[18]。鉴于芝麻各组分蛋白得率和乳化性质的综合分析结果,将芝麻白蛋白作为研究对象,制作乳液,并探究油相体积分数、白蛋白浓度和离子强度对芝麻白蛋白乳液特性的影响。
2.2 芝麻分离蛋白及其组分的分子量分布
图1 为芝麻分离蛋白及其组分的SDS-PAGE 图谱。

图1 芝麻分离蛋白及其组分的SDS-PAGE Fig.1 SDS-PAGE of sesame protein and its fractions
由图1 可知,芝麻分离蛋白亚基大小主要分布在13~100 kDa,其中白蛋白主要由2S、7S 和11S 白蛋白亚基组成,其分子量分别为13、20~25、30~35 kDa 和60~65 kDa。盐溶性球蛋白亚基主要由7S 和11S 球蛋白以及少量的2S 球蛋白组成,盐溶性球蛋白与芝麻分离蛋白亚基组成基本一致,这主要与芝麻分离蛋白组成有关[19]。谷蛋白主要由11S 酸性亚基(30~35 kDa)和碱性亚基(20~25 kDa)组成,还有少量2S 球蛋白(13 kDa)条带。醇溶蛋白与白蛋白亚基组成相比,减少了2S 球蛋白条带,主要由7S 和11S 球蛋白亚基组成,分子量分布在20~25、30~35 kDa 和60~65 kDa。这与已有文献一致,即芝麻11S 球蛋白由酸性亚基和碱性亚基组成,分子量分别约为30~35 kDa 和20~25 kDa;芝麻β-球蛋白由两个9 kDa 和4 kDa 的亚基通过二硫键连接;7S 球蛋白由分子量为12.4~65.5 kDa 的多肽组成[20]。
2.3 油相体积分数、白蛋白浓度和离子强度对芝麻白蛋白乳液粒径的影响
2.3.1 油相体积分数对芝麻白蛋白乳液粒径的影响
油相体积分数对乳液粒径分布的影响如图2 所示。

图2 油相体积分数对芝麻白蛋白乳液粒径分布的影响Fig.2 Effect of oil phase volume fraction on particle size distribution of sesame albumin emulsions
由图2 可知,随着油相体积分数从20%增加到70%,乳液液滴粒径的分布峰从宽矮型转变为细高型,单峰的分布趋势更加明显。这说明乳液液滴粒径均一性提高。随着油相体积分数的增加,液滴粒径分布峰的位置逐渐向横坐标轴的右侧移动,液滴的粒径从18.94 μm 增加到58.95 μm。表明乳液液滴粒径随着油相体积的增加而逐渐增加。因为油相的增加减少了稳定油/水界面的有效颗粒数量,从而形成了更大尺寸的液滴。该结果与采用其他粒子作为稳定剂制备的乳液类似[14]。
2.3.2 白蛋白浓度对芝麻白蛋白乳液粒径的影响
白蛋白浓度对乳液粒径分布的影响如图3 所示。

图3 白蛋白浓度对芝麻白蛋白乳液粒径分布的影响Fig.3 Effect of albumin concentration on the particle size distribution of sesame albumin emulsions
由图3 可知,所有乳液液滴的粒径都是呈现单峰的分布趋势。随着白蛋白浓度从1.0%增加到6.0%,乳液液滴的分布峰逐渐变窄,分布峰的位置逐渐向横坐标轴的左侧移动,粒径由42.07 μm 降至19.33 μm,粒径尺寸及分布随着白蛋白浓度变化的现象与Song 等[21]的研究结果相似。在乳液体系中更多的蛋白颗粒表示有更多的粒子可以覆盖更多的油水界面以稳定更小的液滴,防止乳液液滴间发生聚合[22]。
2.3.3 离子强度对芝麻白蛋白乳液粒径的影响
离子强度对白蛋白稳定的乳液粒径分布的影响如图4 所示。
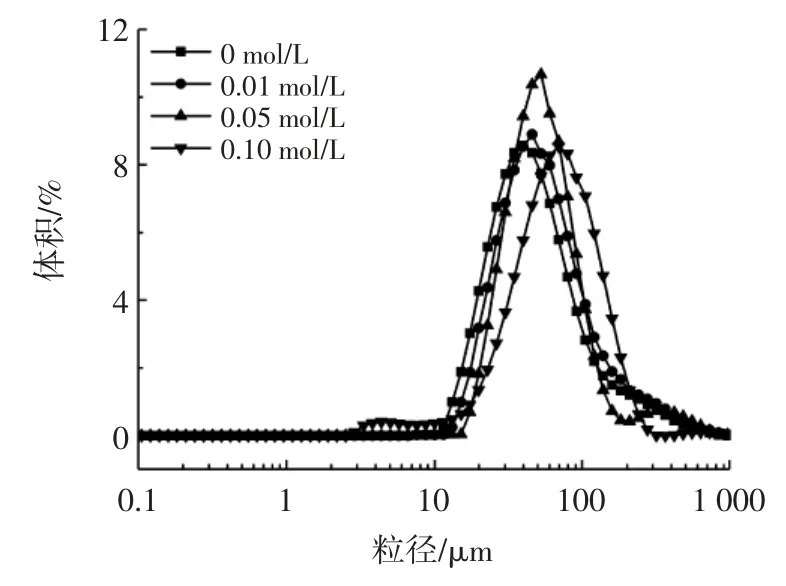
图4 离子强度对芝麻白蛋白乳液粒径分布的影响Fig.4 Effect of ionic strength on the particle size distribution of sesame albumin emulsions
如图4 所示,离子强度从0 mol/L 增加到0.01 mol/L,乳液液滴的分布峰接近重合,粒径增加不明显,当离子强度增加到0.05 mol/L 和0.10 mol/L 时乳液液滴的分布峰发生右移,粒径明显增加,增加到55.64 μm 和69.84 μm。离子强度越高,蛋白之间引力越强,蛋白颗粒吸附的液滴之间的静电斥力减小,导致液滴的不稳定性提高,液滴体积增加。随着离子强度的增加,蛋白在pH3 条件下稳定乳液液滴尺寸发生的变化与Zhu等[23]的研究结果一致。
2.4 油相体积分数、蛋白浓度和离子强度对芝麻白蛋白乳液流变学特性的影响
基于静态流动和动态振荡试验分别探究了在不同油相体积分数、白蛋白浓度和离子强度下pH3 时白蛋白乳液的流变学特性,结果如图5 所示。
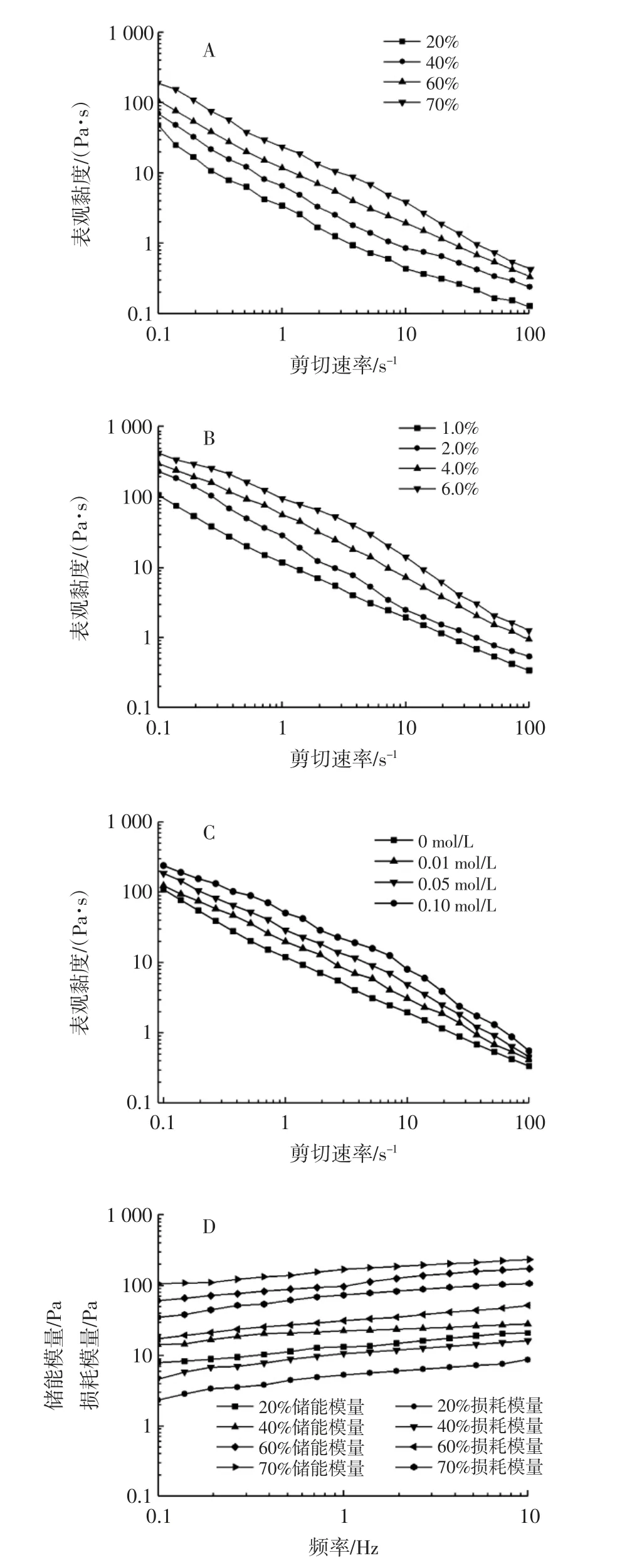
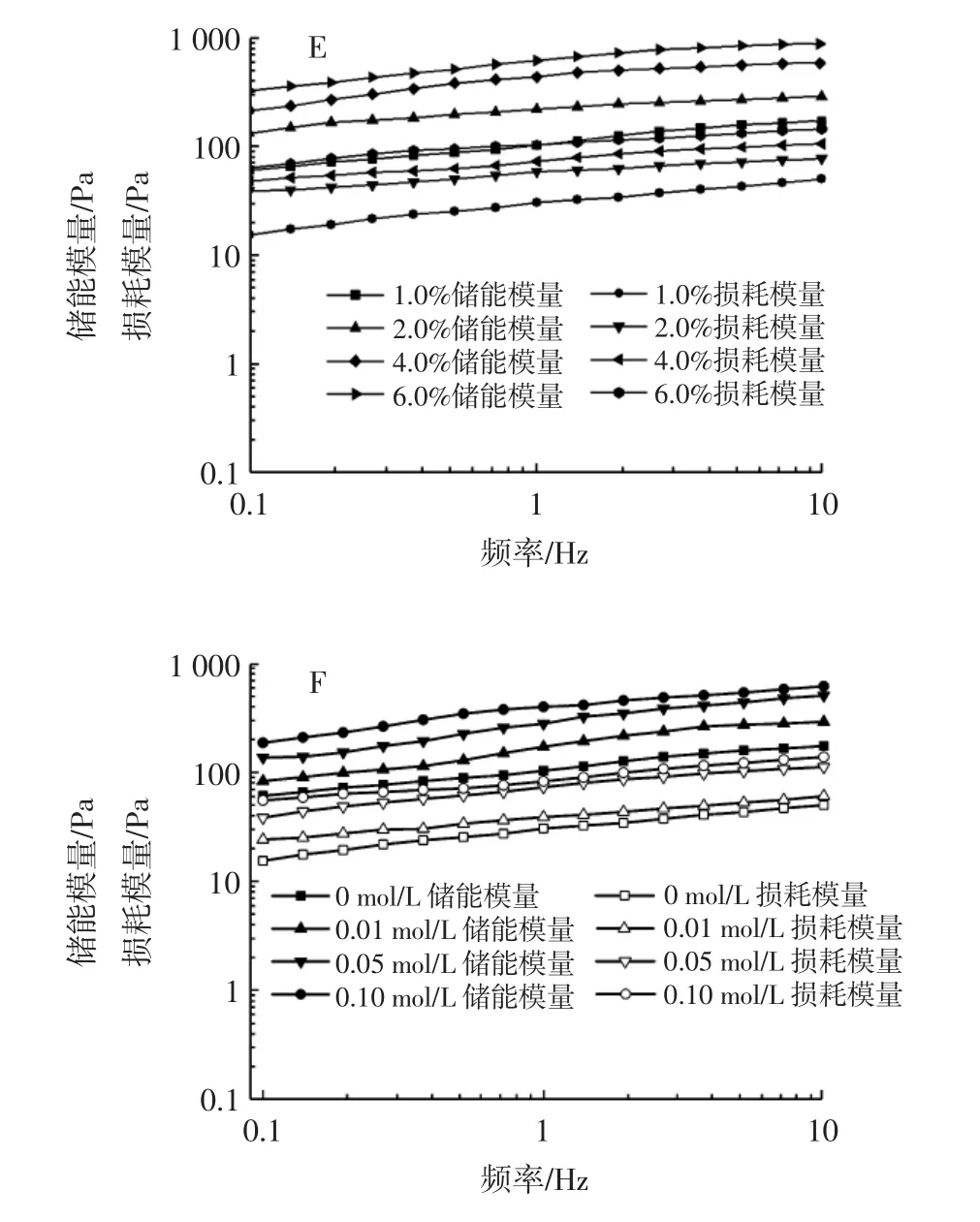
图5 白蛋白稳定的水包油乳液的流变学特性Fig.5 Rheological properties of O/W emulsion stabilized by albumin particles
从图5 A~图5C 可知,随着剪切速率的增加(0.1~100 s-1),乳液的表观黏度明显降低,这种剪切稀化的行为表明白蛋白稳定的O/W 乳液属于假塑性的非牛顿流体。这是由于剪切力的破坏速率大于乳液样品的恢复速率导致分子间流动阻力降低,乳液网络结构遭到破坏,乳液的表观黏度降低。当油相体积分数、白蛋白浓度和离子强度增加时,乳液的表观黏度增大,液滴之间的相互作用增强。这与关于O/W 乳液的研究结果相似[24-26]。
图5D~图5F 表明随着振荡频率的逐渐增加,全部测试样品的储能模量(G')和损耗模量(G'')都稍有增加,且在全段频率扫描范围内(0.1~10 Hz)G' 高于G'',结果表明乳液表现出以弹性行为为主的弱凝胶学特性[27]。
此外,在某一固定频率下,随着油相体积分数(20%~70%)、白蛋白浓度(1.0%~6.0%)和离子强度(0~0.1 mol/L)的增加,G'和G''逐渐增加,表明乳液的黏弹性增强,使得乳液具有更强的凝胶特性。在其他蛋白稳定的O/W 乳液中也有相类似的结果[28-29]。
2.5 油相体积分数、白蛋白浓度和离子强度对O/W乳液微观结构的影响
2.5.1 光学显微镜分析
图6 为新鲜制备的乳液的光学显微镜图。

图6 白蛋白稳定的水包油乳液的光学显微镜图Fig.6 Optical microscopic images of O/W emulsions stabilized by albumin particles
如图6A 所示,在油相体积分数为20%时,液滴尺寸较小且分散不均一,在油相体积分数为40%和60%时,液滴尺寸较大且相对分散均一,在油相体积分数为70%时,液滴尺寸最大。随着油相体积分数的增加,分散液滴的尺寸明显增大。在蛋白浓度一定时,液滴大小与油相体积分数呈正相关。如图6B 所示,当油相体积分数固定在60%时,液滴大小与蛋白浓度呈负相关。当白蛋白浓度固定为1.0%,油相体积分数为60%时,液滴大小与离子强度也呈正相关,这与图4 研究结果一致。结果表明,油相的增加减少了稳定油/水界面的有效颗粒数量,从而形成了更大尺寸的液滴;随着蛋白浓度的增加,更多的粒子可以覆盖更大的界面面积,从而使液滴尺寸变小;随着离子强度的增加,蛋白颗粒之间静电斥力变小,当离子强度更高时,蛋白粒子之间发生聚集而沉淀,可吸附到油水界面的粒子数量减少,液滴的尺寸增加,液滴间的聚集和絮凝程度增加。Boostani 等[30]对酸性条件下大麦醇溶蛋白稳定皮克林乳液的研究中也发现了类似的结果。
2.5.2 激光共聚焦显微镜分析
图7 为白蛋白在pH3 时稳定的乳液的激光共聚焦显微镜图。

图7 芝麻白蛋白激光共聚焦显微镜图Fig.7 Sesquiterpene albumin laser confocal microscope diagram
山茶油用尼罗红进行染色,在488 nm 波长处激发,蛋白用尼罗蓝进行染色,在633 nm 波长处激发,颜色分别设置为绿色和红色。为了尽可能利用CLSM 反映乳液的内部微观结构,制备玻片样品时乳液在不经过稀释的情况下,尽可能使样品摊薄进行观察,并在视野的边缘处拍照记录。图7A 反映的是油相的结构,可以看到油相呈绿色实心圆圈分散开,图7B 反映蛋白的结构,可以看到蛋白基本分布在油水两相界面处,形状呈红色空心圆圈分布在油滴的周围,表明蛋白附着于油滴周围;图7C 为图7A 和图7B 的叠加图,油滴处于内部被蛋白包裹着,也进一步证明了O/W 型乳液的形成和稳定机制,这与乳清蛋白在酸性条件下形成稳定的O/W 乳液的研究结果相一致[14]。
3 结论
采用Osborne 法分离提取芝麻白蛋白、球蛋白、醇溶蛋白和谷蛋白组分,得率分别为10.8%、22.6%、0.4%、11.0%。SDS-PAGE 图谱表明,芝麻分离蛋白的分子量主要分布在13~100 kDa。白蛋白在pH3 时较球蛋白、醇溶蛋白和谷蛋白显示更好的溶解性,白蛋白具有更好的起泡性和乳化稳定性,球蛋白和芝麻分离蛋白保油性更好。
白蛋白具有更好的起泡性和乳化性,但球蛋白、谷蛋白和芝麻分离蛋白保油性较好。白蛋白在pH3 时制备O/W 乳液,油相体积分数、蛋白浓度和离子强度是影响乳液粒径变化的主要因素。乳液粒径的大小与油相体积分数和离子强度呈正比,与蛋白浓度呈反比。白蛋白稳定的O/W 乳液表现出非牛顿假塑性流体行为,且具有以弹性为主的弱凝胶学特性。
随着白蛋白浓度的增加,白蛋白稳定的O/W 乳液液滴的尺寸减小且分布均一,但油相体积分数和离子强度对乳液液滴尺寸的影响表现出相反的结果;激光共聚焦显微镜结果表明,白蛋白在pH3 时表现出良好的表面活性且能够吸附在油水界面上,进一步说明了白蛋白稳定的O/W 型乳液的形成机制。
