基于微生物指标评价冷冻熟制小龙虾食用安全风险
2023-08-12公方朔陈一丹姜启兴许艳顺夏文水
公方朔,陈一丹,杨 方,姜启兴,许艳顺,夏文水
(江南大学食品学院,食品科学与技术国家重点实验室,江苏省食品安全与质量控制协同创新中心,江苏 无锡 214122)
小龙虾学名克氏原鳌虾(Procambarus clarkii),原产自美洲,20世纪30年代引进国内[1],因其环境适应性强、繁殖能力旺盛[2],且肉质鲜美、风味独特、营养价值高[3],已逐步发展成我国重要的经济淡水虾类[4]。目前我国小龙虾产业以鲜销为主,冷冻加工为辅[5],由于生鲜小龙虾容易腐败变质,且易受地域性和季节性等因素影响[6-9],故大力发展小龙虾的冷冻产品以实现跨地域、跨季节销售,从而进一步带动小龙虾养殖业和水产品加工业经济的增长十分必要。据统计数据显示,近5 年我国小龙虾加工总量呈现稳步增长趋势,2021年加工总量约85万 t,而养殖产量达263.36万 t,是2016年的3 倍[10]。小龙虾加工产业持续增长一方面促进了养殖业的快速发展,另一方面也改善了地域性和季节性带来的不利影响。近两年受新冠病毒肺炎疫情的影响,预调味的冷冻熟制小龙虾产品在各大电商平台的销量激增,深受广大消费者喜爱[11]。然而,预调味的熟制小龙虾为保证其独有的风味和质构,通常采用较低强度的方式杀菌(如巴氏杀菌),由于小龙虾的蛋白质和水分含量较高,易被微生物利用而腐败变质[12],而低强度杀菌不能完全消灭细菌的耐热性孢子[13],使得经巴氏杀菌的产品必须贮藏在冷冻条件下,以抑制细菌生长繁殖,从而保证一定时间的货架期。然而,当这些冷冻产品在冷链温度发生波动上升或者复热升温时间较长的情况下,没有被杀灭的细菌会重新生长繁殖,造成食品腐败变质。在食品中,参与导致食品腐败的微生物称为腐败菌[14],冷冻熟制小龙虾中的腐败菌在冻藏过程中存活率有差异,有的腐败菌耐受性高,可在适宜条件下复苏使其数量逐渐占据优势地位,称为优势腐败菌[15]。有效抑制小龙虾产品中的优势腐败菌可以进一步提高冷冻熟制小龙虾的食用安全性,因此,鉴定冷冻熟制小龙虾中优势腐败菌对于小龙虾产业具有重要意义。
近年来,随着分子生物学的发展,用于检测食品中腐败菌的技术层出不穷,高通量测序作为新一代测序技术,具有信息量大、效率高的优点[16]。高通量测序并不需要对菌株进行分离培养[17],它通过提取样品中细菌总DNA、对原始DNA序列进行剪切过滤聚类等操作,获得操作分类单元(operational taxonomic unit,OTU),随后进行的Alpha多样性分析、Beta多样性分析可以显示样品间的差异,进一步的物种注释及丰度分析可以深度展示样品物种构成,更加准确、全面地反映样本的微生物群落结构[16]。目前,该技术已被广泛应用于多个领域[18],其中针对水产品,特别是针对探究小龙虾腐败菌相[19-23]的研究逐年增加。而目前对于冷冻熟制小龙虾腐败菌群多样性的研究鲜有报道,且对于小龙虾菌相的研究多集中于虾肉,往往忽视了产品整体。整个熟制小龙虾产品由多部分组成,不能仅从虾肉菌相出发,需要结合不同部分综合探讨小龙虾产品的优势腐败菌。本研究选择市售真空包装冷冻熟制小龙虾,通过不同部分理化指标的变化确定食用终点,并利用高通量测序技术对食用终点熟制小龙虾的内脏与鳃、虾肉、虾壳以及调味汤料的细菌菌群进行分析,找出优势腐败菌,以期为开发优质冷冻熟制小龙虾产品提供理论指导。
1 材料与方法
1.1 材料与试剂
真空包装冷冻熟制小龙虾(750 g/盒),生产日期不超过30 d,购于天猫超市,冷链运输至实验室,置于-18 ℃冰箱保存。
盐酸、硼酸、氧化镁(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
K9840自动凯氏定氮仪 山东海能科学仪器有限公司;隔水式培养箱 上海一恒科学仪器有限公司;SW-CJ-1FD超净工作台 苏州安泰空气技术有限公司;LE483 pH计 梅特勒-托利多国际贸易(上海)有限公司;AX223ZH/E电子天平 奥豪斯仪器(常州)有限公司:高速均质机 湖南力辰仪器科技有限公司。
1.3 方法
1.3.1 冷冻熟制小龙虾食用终点的确定
分别于距生产日期30、60、90、120、150、180 d取样,每个时间点取3 个平行样品,将样品置于4 ℃冷藏柜中解冻12 h,解冻后用于总挥发性盐基氮(total volatile basic nitrogen,TVB-N)值和pH值测定。
1.3.1.1 TVB-N值测定
参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》中自动凯氏定氮仪法,每30 d从冷冻真空包装熟制小龙虾中分别取5.00 g内脏与鳃、虾肉、虾壳、调味汤料,搅碎后加入1.00 g氧化镁,连接到自动凯氏定氮仪进行测定。
1.3.1.2 pH值测定
参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》方法,每30 d从冷冻真空包装熟制小龙虾中分别取3.00 g内脏与鳃、虾肉、虾壳、调味汤料,加30 mL煮沸后冷却的水,使用高速均质机将其均质混匀,静置30 min,然后在4 ℃、10 000 r/min条件下离心10 min,取上清液测定pH值。
1.3.2 高通量测序
根据理化指标变化,无菌环境下取食用终点熟制小龙虾样品,分别于不同部分取样,每个部分取15.00 g。参照Yu Dawei等[24]的方法提取样品总DNA后,根据保守区设计得到引物,在引物末端加上测序接头,进行聚合酶链式反应(polymerase chain reaction,PCR)并对其产物进行纯化、定量和均一化,构建测序文库。建好的文库先进行文库质检,质检合格的文库用Illumina Novaseq 6000测序平台进行测序。测序结果首先使用Trimmomatic(version 0.33)、Cutadapt(version 1.9.1)软件对序列进行质控过滤得到优化序列,然后使用USEARCH(version 10)、UCHIME(version 8.1)软件进一步拼接过滤,最终得到高质量的有效序列用于后续分析。
1.4 数据处理与分析
使用USEARCH软件对有效序列在97.0%的相似度水平下进行聚类,获得OTU,使用QIIME2软件,结合Chao1、Ace、Shannon、Simpson、Coverage指数数据,进行Alpha多样性指数评估,基于分类学信息在门、属水平上进行群落组成统计分析,同时借助R语言、Python语言工具在百迈客生物云平台绘制物种丰度聚类热图。
使用Excel 2010软件对实验数据进行统计分析;利用SPSS 25软件进行统计学显著性差异分析,经单因素方差分析(analysis of variance,ANOVA)后进行邓肯多极差检验,P<0.05表示有显著性差异;利用Origin 2019b软件绘图。
2 结果与分析
2.1 熟制小龙虾冷冻过程中TVB-N值和pH值的变化
TVB-N值是评判小龙虾腐败程度的重要指标之一,其是三甲胺、二甲胺、氨等挥发性胺类物质含量的总和,主要由在微生物和酶的作用下降解蛋白质及非蛋白的含氮化合物产生[25]。根据GB 10136—2015《食品安全国家标准动物性水产制品》规定,水产制品TVB-N值不得高于30 mg/100 g。由图1可知,熟制小龙虾在冷冻期间TVB-N值总体呈上升的趋势,其中虾壳和调味汤料增长趋势较为缓慢,在整个贮藏期间TVB-N值均在安全限值以下;虾肉和内脏与鳃在冻藏期间TVB-N值持续增长,内脏与鳃在贮藏前120 d增长趋势较缓慢,由12.72 mg/100 g增加到17.84 mg/100 g,之后其数值快速增加,并在180 d时超过可接受上限,达到最大值(31.26 mg/100 g)。虾肉在30~60 d贮藏初期以及150~180 d贮藏末期TVB-N值增速较快,在180 d时达到32.42 mg/100 g。

图1 熟制小龙虾不同部分冻藏期间TVB-N值变化Fig.1 Changes in TVB-N content of different parts of cooked crayfish during frozen storage
由图2可知,相同贮藏时间熟制小龙虾体系不同部分样品间pH值具有显著差异(P<0.05),其中虾壳和调味汤料呈现先上升后下降的趋势,这可能是由于贮藏前期虾壳以及调味汤料中溶解的蛋白质被降解,产生碱性小分子含氮化合物[9],导致pH值上升;而贮藏后期乳酸、琥珀酸和磷酸等酸性物质快速积累[26],使pH值下降。而虾肉、内脏与鳃的pH值呈缓慢下降趋势,始终处于弱碱性范围。
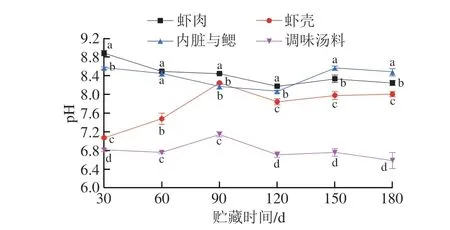
图2 熟制小龙虾不同部分冻藏期间pH值变化Fig.2 Changes in pH of different parts of cooked crayfish during frozen storage
2.2 高通量测序结果分析
2.2.1 测序样本数据分析
所有样本测序基本数据如表1所示,4 个样品测序共获得229 219 条原始序列,过滤后得到226 160 条优化序列,进一步质控、拼接、过滤长度和嵌合体后共产生217 214 条有效序列,有效序列平均长度为421~425 bp,并且样品有效率在92.57%以上。将各样品有效序列按照97%的相似度进行聚类,得到OTU。由表1可知,虾壳OTU数量最多,为799;内脏与鳃OTU数量次之,为711;调味汤料和虾肉中OTU数量相对较少,分别为597和550。
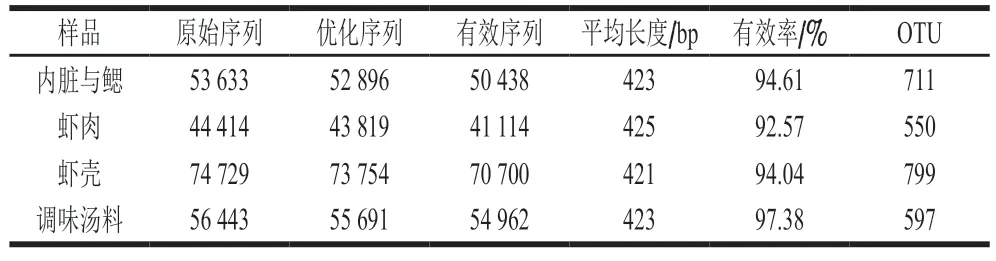
表1 高通量测序样本基本数据Table 1 Basic data of high-throughput sequencing
根据不同部分所对应的OTU绘制维恩图,利用维恩图可以展示样品之间共有、特有特征OTU数目,直观地表现出样品间特征的重合情况,从而找出不同样品中的共有微生物。如图3所示,熟制小龙虾4 个部分含有266 个相同OTU,内脏与鳃、调味汤料、虾壳以及虾肉中独有的OTU数分别为47、110、75、17,说明熟制小龙虾不同部分细菌种类具有共性,但也存在一定差异。
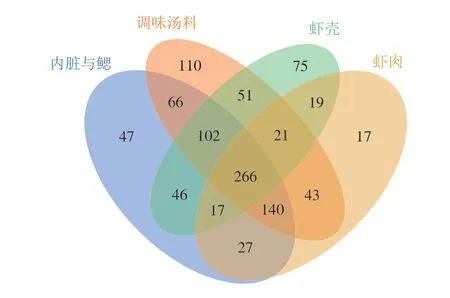
图3 熟制小龙虾不同部分OTU的维恩图Fig.3 Venn diagram of OTUs in different parts of cooked crayfish
2.2.2 熟制小龙虾样本Alpha多样性分析
Alpha多样性反映的是单个样品物种丰度及物种多样性,有多种衡量指标,包括Ace、Chao1、Shannon、Simpson、Coverage指数等,其中Coverage指数越高,则样本中物种被测出的概率越高。如表2所示,所有样本测序的Coverage指数均大于0.99,即样品覆盖率高,序列未被检出的概率低,表明所得有效序列可用于后续分析。
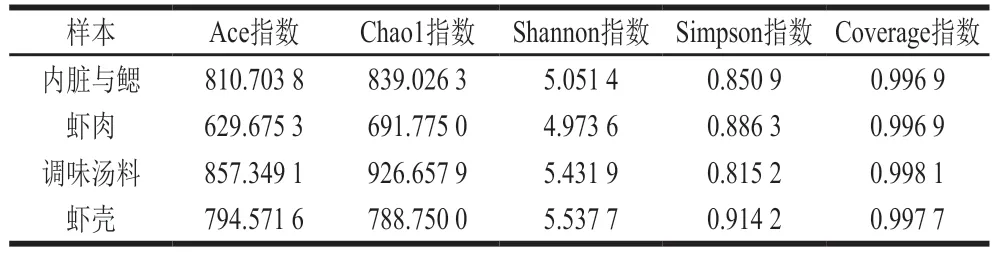
表2 熟制小龙虾不同部分Alpha多样性统计分析Table 2 Statistics of alpha diversity of bacteria in different parts of cooked crayfish
Chao1和Ace指数可用于衡量物种丰度(即物种数量),其数值越大,表明群落丰富度越高。如表2所示,调味汤料Chao1和Ace指数最大,虾肉最小,表明调味汤料中菌群丰度最高,虾肉中最低。
Shannon指数用于衡量物种多样性,受样品群落中物种丰度和物种均匀度的影响。相同物种丰度的情况下,群落中物种均匀度越高,则认为群落多样性越高,Shannon指数越大,说明样品的物种多样性越高。表2显示虾壳Shannon指数最大,虾肉最小,即虾壳中细菌多样性最高,虾肉中最低。
图4A为样本稀释曲线,可以用来判断样本测序量是否充分。随着测序深度逐渐增加,各样本稀释曲线趋于平缓,结合覆盖率数据,表明本研究测序结果可以反映熟制小龙虾不同部分的微生物情况。图4B等级-丰度曲线可以清晰反映出样本中物种丰富度和均匀度,物种的丰富度由曲线在横轴上的长度反映,曲线越宽,表示物种的组成越丰富;物种组成的均匀度由曲线的形状来反映,曲线越平坦,表示物种组成的均匀度越高。由图4B可以看出,4 个部分在横轴上的分布长度由调味汤料、内脏与鳃、虾壳、虾肉依次递减,表明调味汤料细菌组成最为丰富,而虾肉中物种丰富度较低。此外,调味汤料的曲线较平坦,表明其均匀度最高,而虾肉和虾壳的曲线较陡峭,表明其物种均匀度较低。
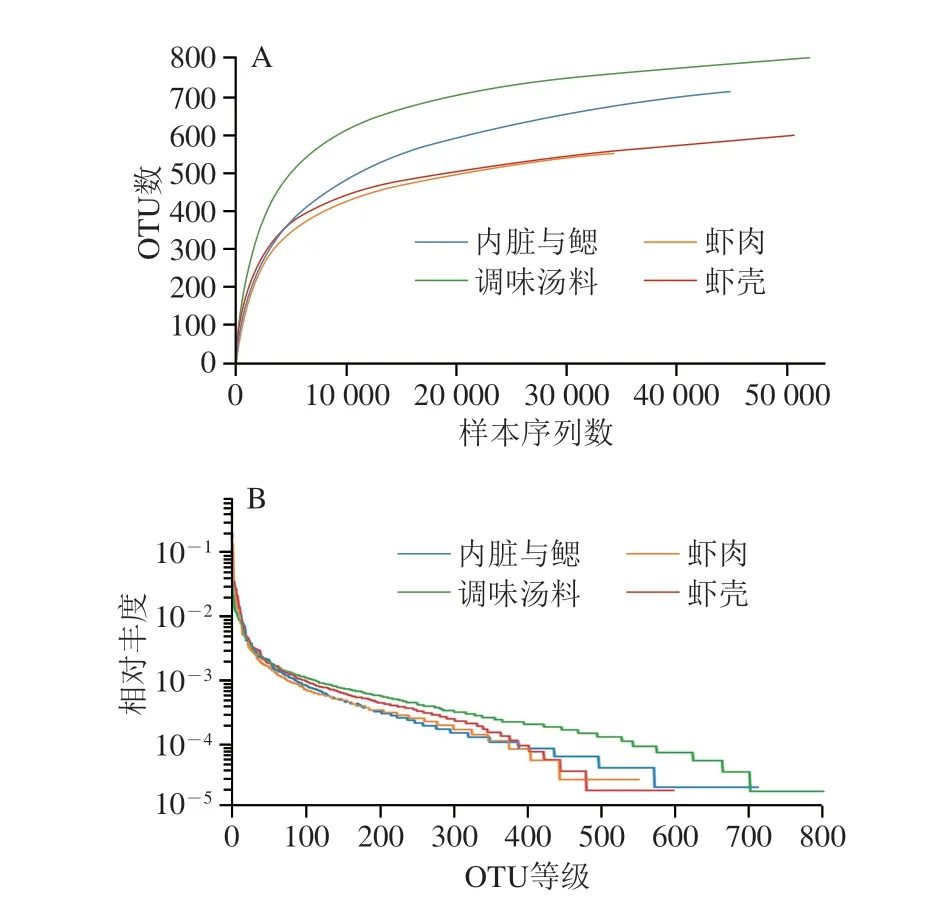
图4 熟制小龙虾不同部分样品稀释曲线(A)和等级-丰度曲线(B)Fig.4 Rarefaction curves (A) and rank-abundance curves (B) of bacteria in different parts of cooked crayfish
2.2.3 熟制小龙虾不同部分腐败微生物群落结构组成分析
熟制小龙虾不同部分腐败菌群落门水平(丰度前10 位的菌种)组成如图5A所示,其中内脏与鳃、虾肉和虾壳中主要菌门为变形菌门(Proteobacteria),相对丰度分别为68.41%、74.77%和54.03%;其次为厚壁菌门(Firmicutes),相对丰度为9%~22%;此外,拟杆菌门(Bacteroidetes)在虾壳(14.58%)和内脏与鳃(8.40%)中也占有一定比例。在调味汤料中厚壁菌门占绝对优势,相对丰度为62.05%,变形菌门和拟杆菌门分别占19.78%和7.17%;其他菌门在各样本中所占比例均小于5%。总体来看,厚壁菌门、变形菌门和拟杆菌门为冷冻熟制小龙虾中的优势菌门,门水平上各部分细菌种类大致相同,但丰度具有较大差异。
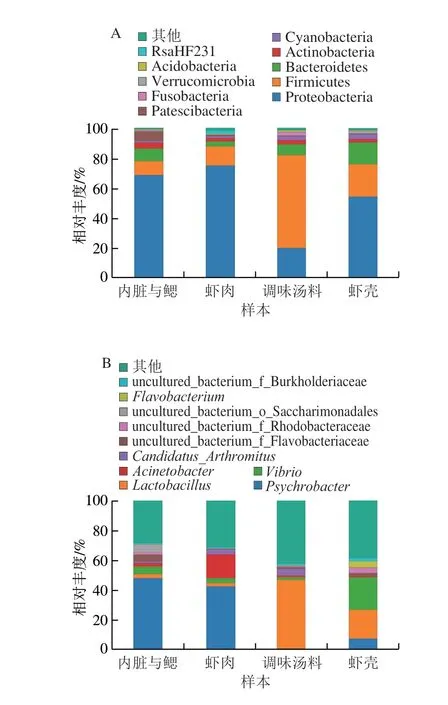
图5 熟制小龙虾不同部分样本细菌门水平(A)和属水平(B)物种相对丰度Fig.5 Relative abundance of bacteria in different parts of cooked crayfish at the phylum level (A) and genus level (B)
为了更深入了解熟制小龙虾体系不同部分微生物多样性差异,选取相对丰度前10 位的菌属,探究属水平上的微生物多样性差异,结果如图5B所示。不同样本间的优势菌属有较大差异,主要为嗜冷杆菌属(Psychrobacter)、乳酸杆菌属(Lactobacillus)、弧菌属(Vibrio)和不动杆菌属(Acinetobacter)等。内脏与鳃中嗜冷杆菌属占主要优势,为47.86%,弧菌属(5.05%)也占有一定比例,而其他菌属占比均小于5%;虾肉中菌属群落结构和内脏与鳃中相似,以嗜冷杆菌属(42.31%)为主,还含有较多不动杆菌属(16.04%),以及少量弧菌属和Candidatus Arthromitus;调味汤料不同于以上两个样本,其含有大量的乳酸杆菌属(46.25%);虾壳中优势菌属组成丰富,以弧菌属(21.72%)、乳酸杆菌属(19.38%)和嗜冷杆菌属(7.40%)为主。
选取丰度排名前50 位的菌属,根据其在各样本中的丰度信息进行聚类分析,颜色梯度由蓝色到红色表示菌属在样本中相对丰度由低到高。从图6可以看出,熟制小龙虾不同部分群落结构具有较大差异。通过聚类分枝的长度可知,内脏与鳃和虾肉的菌属结构相似,调味汤料、虾壳的菌属结构则相对独立。
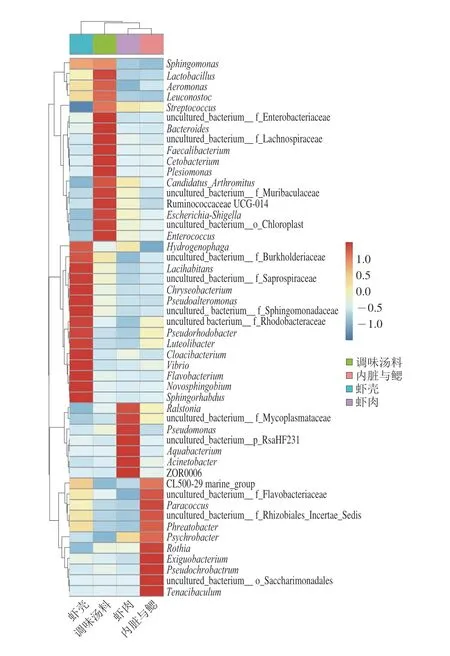
图6 熟制小龙虾不同部分样本属水平物种丰度聚类热图Fig.6 Clustering heatmap of bacterial abundance at the genus level of samples from different parts of cooked crayfish
2.2.4 熟制小龙虾不同部分样品菌群结构差异分析
主坐标分析(principal coordinate analysis,PCoA)是对特征值和特征向量进行排序,选择主要排在前几位的特征值,以找到距离矩阵中最主要的坐标,通过PCoA可以实现多个样品的分类,进一步展示样品间物种多样性差异。如图7所示,第1主成分(PC1)和第2主成分(PC2)解释度分别为60.62%和28.01%,叠加解释度达88.63%。各样本分散在4 个象限中,内脏与鳃和虾肉距离较近,表明其组内菌群结构有相似之处,而其他两组样本相距较远。因此,冷冻熟制小龙虾中不同部分之间的微生物结构差异较大。
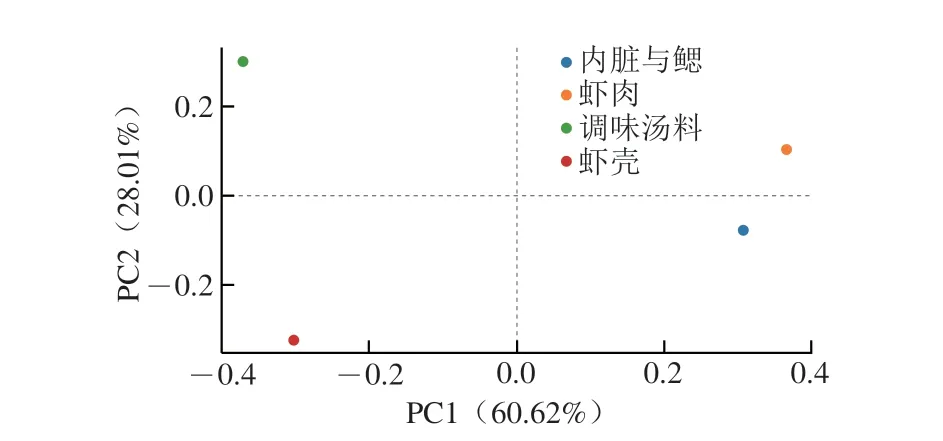
图7 熟制小龙虾不同部分样品菌群PCoAFig.7 PCoA of microbial communities in different parts of cooked crayfish
3 讨论
本研究以市售冷冻真空包装熟制小龙虾为研究对象,通过理化指标变化确定了熟制小龙虾在180 d时达到食用终点,利用高通量测序技术分析食用终点样本中不同部分的微生物多样性,发现熟制小龙虾不同部分的菌群结构和多样性具有差异。门水平上,内脏与鳃、虾肉、虾壳、调味汤料4 个部分中菌群以厚壁菌门、变形菌门和拟杆菌门为主,先前的研究表明变形菌门、拟杆菌门和厚壁菌门是熟制小龙虾的核心菌群[27]。属水平上,内脏与鳃中主要为嗜冷杆菌属以及少量弧菌属。这是因为内脏与鳃中的微生物与小龙虾生长养殖环境有较大联系,小龙虾生长养殖环境较复杂,环境中的微生物隐藏在虾鳃以及内脏中,加工过程中简单地清洗不能将其去除,进而使其出现在产品中。虾肉和内脏与鳃的菌群组成结构相似,主要为嗜冷杆菌属,但虾肉中还有一定比例的不动杆菌属。虾肉中的主要微生物可能来源于其肠道[28],小龙虾在加工过程中造成肠道破裂,而虾肉中蛋白含量较高,有利于微生物生长,从而使内脏中的微生物转移到虾肉并逐步发展成优势菌。冷冻贮藏条件下,大部分微生物生命活动被抑制,经过4 ℃解冻使可以在低温条件下生长代谢的嗜冷杆菌属、不动杆菌属以及弧菌属复苏,并利用内脏与鳃和虾肉中的营养物质生长代谢,逐步占据优势,而这3 种菌属常见于低温贮藏产品中[29-30];调味汤料时常会被研究者们忽略,在冻藏-解冻期间,它的存在极大程度影响了样品整体pH值,进而影响微生物群落。调味汤料初始pH值较低,利于乳酸杆菌属代谢发育,并且真空包装条件下,细菌有氧代谢受到抑制,而乳酸杆菌可进行厌氧代谢[31],由于贮藏温度波动上升,乳酸杆菌属逐步在调味汤料中占据优势。虾壳中优势菌群较丰富,主要由弧菌属、乳酸杆菌属和嗜冷杆菌属组成。虾壳作为连接虾内部和外部的关键点,其微生物来源较广,包括内部内脏与鳃和虾肉中菌群的向外扩散、生长加工环境中微生物的污染以及调味汤料中微生物的向内扩散[32];其中弧菌属可能是由于小龙虾养殖环境的污染和加工清洗不完全,使得环境中或者内脏与鳃中的弧菌属附着在虾壳上,而弧菌属作为兼性厌氧菌可在真空包装条件下生存[31],且后续加工条件以及较低强度的杀菌不能将其消灭,进而使其出现在产品中。由于虾壳为小龙虾分隔内外的屏障,推测嗜冷杆菌属和乳酸杆菌属主要来源于内脏与鳃和调味汤料。
小龙虾的品种、生长环境、加工贮藏条件均会影响优势腐败菌菌相结构[33],因此熟制小龙虾制品在加工过程中,可结合超声波等物理技术对小龙虾进行多次复合清洗,降低初始菌落丰度;对于调味汤料,可以适当延长煮制时间或调整汤料酸度;低强度杀菌虽然可以保留小龙虾独特的风味,但具有一定局限性,可适当结合使用抑菌剂以及其他物理杀菌方法,进而在保证产品风味和质构的同时降低食用风险,延长货架期。本研究结果可为今后冷冻熟制小龙虾制品食用安全性和品质的提高提供理论依据。
