膳食营养组分改善视网膜光损伤作用及机理研究进展
2023-08-12肖英梁刘翼翔
肖英梁,刘翼翔
(集美大学海洋食品与生物工程学院,福建 厦门 361021)
随着电脑、智能手机等电子产品的广泛使用,过量光暴露引起的各类眼科疾病已成为严重威胁人类健康的公共卫生问题,如视网膜色素变性(retinitis pigmentosa,RP)[1]、年龄相关性黄斑变性(agerelated macular degeneration,AMD)[2]、白内障[3]、近视[4]等。流行病学研究显示,2017年全球近视患者接近20亿 人(占全球总人口的28.3%),预计到2050年,近视患者将增加到47.6亿 人(占全球总人口的49.8%)[4]。2020年亚洲6~19 岁学生近视患病率达60%,比欧洲高20%[5]。此外,AMD是发达国家55 岁及以上个体视力丧失的主要原因,占全球失明人口数量的6%~9%[6]。随着人口的老龄化,全球范围内AMD患者的绝对人数都将增长。据估计,到2040年全球将有2.88亿 人受到AMD的影响[7]。
近年来,类胡萝卜素、花色苷、不饱和脂肪酸、维生素等食源性功能因子的护眼作用引起了科学家们的广泛关注。大量实验表明,这些食源性功能成分具有良好的抗炎、抗氧化、抗细胞凋亡的功能,能够通过对视网膜细胞的保护作用维持视觉健康[8-11]。随着现代医学对视网膜光损伤的研究日益深入,不仅越来越多的具有预防视网膜光损伤功能的膳食营养组分被不断发掘,膳食营养保护视力的新途径、新理论也不断得到丰富和完善。然而,有关视网膜光损伤的作用机制、不同膳食营养组分在干预视网膜光损伤方面的联系与差异还缺乏系统的总结和分析。因此,本文分析总结了视网膜光氧化损伤机理,综述了不同膳食营养成分在视网膜保护方面的最新研究进展,系统探讨了不同膳食营养组分保护视网膜细胞的关键作用靶点,以期为视力保护的精准膳食营养补充提供理论依据。
1 视网膜光损伤机制
视网膜处于高含氧量、高聚光、高多不饱和脂肪酸(polyunsaturated fatty acids,PUFAs)的环境中,并含有多种光敏剂,因此极易受到活性氧(reactive oxygen species,ROS)攻击而导致光氧化损伤[12]。研究表明,视网膜光损伤主要涉及视网膜色素上皮(retinal pigmented epithelium,RPE)细胞和感光细胞[13]。感光细胞包括视杆细胞和视锥细胞,负责将光信号转化为图像[8]。感光细胞的外节(outer segment,OS)含有一个致密的盘状双层膜结构,是视紫质和光敏器件的所在[8]。视网膜RPE层由高度极性、特殊分化的六边形单层上皮细胞构成,位于感光细胞OS和脉络膜之间[8]。RPE细胞的主要功能包括运输营养与代谢物质、形成血-视网膜屏障(blood-retinal barrier,BRB)、吞噬和消化感光细胞脱落的OS盘膜、参与视紫红质代谢等[8]。视网膜光损伤机制十分复杂,到目前为止已发现的途径有视紫红质介导的损伤、脂褐素造成的损伤、脂质过氧化作用、炎症反应、内质网应激(endoplasmic reticulum stress,ERS),如图1所示。
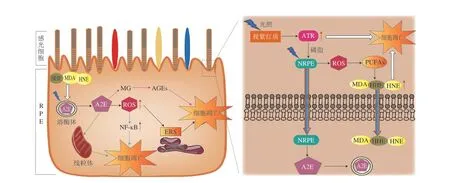
图1 视网膜光损伤作用机制Fig.1 Mechanism of retinal photodamage
1.1 视紫红质对视网膜光损伤的影响
视紫红质存在于感光细胞OS盘膜中,由载脂蛋白、视蛋白和11-顺式-视黄醛(11-cis-retinal,11CR)组成,在视觉形成过程中起着关键作用[14]。视紫红质吸收光子后,11CR异构化转变为全反式-视黄醛(alltrans-retinal,ATR),并与视蛋白分离。在转运体三磷酸腺苷结合盒A4(ATP-binding cassette subfamily A4,ABCA4)的辅助下,ATR被视黄醇脱氢酶(retinol dehydrogenases,RDHS)还原为全反式视黄醇(即VA)并进入RPE细胞,在软磷脂视黄醇酰基转移酶(lecithin retinol acyl transferase,LRAT)、RPE65和11-顺式-视黄醇脱氢酶(11-cisretinol dehydrogenase,11-cisRDH)的共同作用下将其异构氧化生成11CR,从而使视紫红质再生,即视觉循环[15]。除了通过酶促视觉循环再生视紫红质外,最近,Kaylor等[16]发现蓝光(450 nm)能通过光感受器膜中的视黄基磷脂中间体再生功能性视觉色素。感光细胞富含磷脂,与游离的ATR有效结合形成视黄基磷脂复合物(N-retinylidene-PE,NRPE)[16]。研究表明,NRPE在可见光异构化后脱落11CR以再生视紫红质[17]。视紫红质的分解可释放能量,并通过复杂的信息传递使视细胞产生电位变化,进而引发视神经冲动,形成完整的视觉[17]。
由视紫红质介导的视觉循环异常是引起视网膜光损伤的重要原因之一。早在1960年,Noell等[18]研究发现,普通光照可使大鼠视网膜中的感光细胞遭到破坏,其机理与可见光对存在于视杆细胞中的视紫红质的激活有关。为了进一步验证这一理论,Grimm等[19]利用RPE65蛋白耗损阻碍视紫红质再生时发现光照对视网膜没有影响。最近,Olchawa等[20]研究表明,视紫红质光漂白会释放出大量的ATR,引起视网膜光毒性。ATR在感光细胞OS中积累,是最丰富的视网膜光敏剂之一[21]。ABCA4负责将NRPE转运到感光细胞胞质内,从而再生视紫红质[22]。此外,其还将多余的ATR清除出盘膜,以防止潜在的毒性[22]。有研究表明光激活ATR会使ABCA4失活,从而导致ATR的积聚进一步增加。ATR超负荷导致视网膜光感受器的凋亡[23]。此外,如果释放的ATR不能及时从感光细胞中清除,游离的ATR将通过吞噬或扩散进入RPE细胞,诱导严重的细胞毒性,破坏RPE细胞膜通透性,引起线粒体损伤,导致视网膜变性[24]。
1.2 脂褐素对视网膜光损伤的影响
脂褐素是视紫红质等类视黄醛代谢后在RPE细胞内沉积的产物,具有光毒性[25]。脂褐素包含20多种荧光物质,其中N-亚视黄基-N-视黄基-乙醇胺(N-retinylidene-N-retinyl-ethano-lamine,A2E)为主要荧光物质,RPE细胞内所有脂褐素的毒性主要取决于A2E的总量[26]。Luo Maomei等[27]研究表明,A2E在蓝光照射下产生大量单线态氧、超氧阴离子自由基和其他氧化物,这些物质破坏溶酶体和线粒体的正常功能,引起RPE细胞凋亡和BRB功能障碍。此外,过量积累的A2E还会发生光裂解产生甲基乙二醛(methylglyoxal,MG),MG通过与蛋白质、磷脂和核苷酸反应生成晚期糖基化终末产物(advanced glycation end products,AGEs)来改变RPE分子结构和功能[28-29]。由于RPE溶酶体中缺乏消化脂褐素的酶,导致其无法被代谢清除,A2E在RPE细胞中的累积被认为与AMD和Stargardt病等视网膜相关疾病的发生和发展有关[30]。目前,针对A2E在蓝光照射下致RPE细胞器(例如溶酶体和线粒体)损伤这一方面的机制研究还不够深入,溶酶体和线粒体发生功能障碍的具体机制还有待进一步研究。
1.3 脂质过氧化对视网膜光损伤的影响
越来越多的实验证据表明,PUFAs的脂质过氧化是光诱导视网膜损伤的重要原因。感光细胞OS盘膜中富含PUFAs,内节段含有丰富的线粒体,具有较高的氧张力,极易受到ROS和脂质过氧化产生的高活性醛类化合物的攻击,如4-羟基壬烯酸(4-hydroxynonenal,4-HNE)、4-羟基己烯醛(4-hydroxyhexenal,4-HHE)和丙二醛(malondialdehyde,MDA)[31]。这些高活性醛类化合物与蛋白质、核酸发生非酶羰基化反应,引起RPE细胞功能障碍和光感受器细胞损伤[31]。二十二碳六稀酸(docosahexaenoic acid,DHA)为视网膜中含量最丰富的PUFAs,约占感光细胞膜磷脂中总脂肪酸含量的60%[32]。RPE细胞内DHA的光氧化产物破坏溶酶体膜的完整性,从而释放A2E,导致RPE细胞凋亡[32]。本课题组前期研究发现,氧化型PUFAs对RPE细胞有显著毒性作用,蓝莓多酚处理可抑制脂质过氧化,减少醛类化合物的生成,缓解细胞凋亡[33]。可见,抑制视网膜中PUFAs脂质过氧化是保护视网膜免受光损伤的有效途径。
1.4 炎症反应对视网膜光损伤的影响
核因子-κB(nuclear factor-kappa B,NF-κB)为调控炎症反应相关基因的关键转录因子。事实上,氧化剂水平的增加可能通过促进NF-κB抑制物(inhibitor of nuclear factor-κB,IκB)的快速降解来促进NF-κB的激活,从而允许转录因子NF-κB的核转位以及几种炎症介质的表达,包括诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)、单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)和白细胞介素-1β(interleukin-1β,IL-1β)[34]。Wang Yong等[35]研究发现,可见光诱导视网膜光氧化损伤后,NF-κB信号通路被激活,MCP-1、IL-6和IL-1β等炎症因子表达量升高,引发炎症反应,进一步加剧氧化损伤。光照诱导的感光细胞损伤模型中,NF-κB和肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)表达量升高,诱导视网膜退行性疾病的发生,抑制炎症反应可以减少ROS生成,缓解感光细胞凋亡[36]。因此,调节炎症反应对维持视网膜细胞内稳态具有重要意义。
1.5 ERS对视网膜光损伤的影响
内质网是调节蛋白质合成、加工和运输的重要细胞器,参与维持细胞内环境的动态平衡。过量光暴露会打破RPE细胞内氧化还原平衡状态,产生大量ROS,扰乱内质网蛋白质折叠,导致未折叠或错误折叠的蛋白质积累,触发ERS,并引发一系列的保护性级联信号反应,称为未折叠蛋白反应(unfolded protein response,UPR)[37]。结合免疫球蛋白(binding immunoglobulin protein,Bip)与3 种内质网跨膜蛋白因子(蛋白激酶RNA样内质网激酶(protein kinase RNA-like ER kinase,PERK)、活化转录因子6(activating transcription factor 6,ATF6)和肌醇需求酶1α(inositol-requiring enzyme 1α,IRE1α))解离,PERK自磷酸化产生活性,与真核生物蛋白翻译起始因子2(eukaryotic translation initiation factor 2,eIF2)相互作用,抑制蛋白翻译;IRE选择性剪切X-盒结合蛋白1(X-box binding protein 1,XBP1),XBP1翻译产生伴侣蛋白,加速未折叠蛋白折叠;ATF6迁移到细胞核中,参与XBP1的调控,减弱ERS,维持内质网正常功能[37]。然而,持续过强的ERS超出UPR维持稳态的能力时,则启动ERS凋亡级联反应,IRE1通过调节c-Jun氨基末端激酶(c-Jun-N-terminal kinase,JNK)的表达和增强子结合蛋白同源蛋白(enhancer-binding protein homologous protein,CHOP)的转录启动凋亡程序,诱导视网膜细胞凋亡[37]。越来越多的研究表明ERS在AMD和RP等视网膜退行性疾病的发生发展中发挥重要作用[38]。动物研究表明,在光感受器退化过程中,视网膜中BiP和XBP1表达量升高[39]。刘霞等[40]发现,长期过度的UPR激活可能导致自噬功能障碍、炎症信号增加、ROS聚集,从而诱导RPE细胞凋亡,这与AMD的发生密切相关。McLaughlin等[41]认为ERS为不同视网膜退行性疾病的发病机制,其研究结果表明调控ERS可以减少线粒体ROS的生成,抑制视网膜细胞自噬和凋亡。综上,ERS可能是今后研究视网膜退行性疾病机制的重要靶点。
2 膳食营养组分应用于光损伤
2.1 类胡萝卜素
类胡萝卜素是一种疏水生物活性分子,它广泛存在于动物、植物、真菌和藻类中[42]。依据其化学结构的元素组成,类胡萝卜素可分为碳氢类的胡萝卜素和含氧衍生物的叶黄素两类[43]。类胡萝卜素是哺乳动物必不可少的营养物质,其自身无法合成,必须从饮食中摄入[44]。许多基础和临床研究已经报道了类胡萝卜素在眼睛中的抗氧化和抗炎特性[45-46]。此外,β-类胡萝卜素在机体内转化为视黄醛,参与视觉循环[47];叶黄素和玉米黄素还能够过滤蓝光,从而保护光感受器免受光损伤[48];岩藻黄素和虾青素具有比叶黄素更为优异的抗氧化活性[49]。近年来,类胡萝卜素的视力保护功能备受关注,对其作用机制的研究也有新的进展,然而类胡萝卜素的护眼机制还未完全阐明。
2.1.1β-胡萝卜素
β-胡萝卜素是VA的前体,在包括视觉在内的许多生物过程中发挥重要作用。目前在自然界发现的类胡萝卜素超过700 种,其中有50 种经人体代谢后可以转化为VA,尤其以β-胡萝卜素的转化活性最高[50]。在机体内,β-胡萝卜素15,15’-单加氧酶(β-carotene 15,15’-monooxygenase,BCOM1)负责将β-胡萝卜素转化为VA,并将β-胡萝卜素对称地分解成两分子的ATR[51]。视黄醛是感光细胞中视紫红质的关键组成部分,在视网膜中介导光传导,参与视觉循环[52]。此外,VA是维持人体上皮细胞健康、影响细胞调节和分化的必需维生素。VA缺乏会使眼睑、眼结膜等的上皮细胞受到破坏,引起眼睛表面的杯状细胞丢失,加速眼表上皮的角质化,是引起干眼症的原因之一[53]。研究表明,摄食富含β-胡萝卜素的水果和蔬菜有助于机体VA的补充,缓解干眼症[54-55]。因此,β-胡萝卜素可被用作以食品为基础的补充剂,以减少VA缺乏。然而,有关β-胡萝卜素对视网膜光损伤的干预作用还鲜有报道。
2.1.2 叶黄素与玉米黄素
叶黄素和玉米黄素(图2)是叶黄素类胡萝卜素,主要来源于绿叶蔬菜、蛋黄、玉米和南瓜[56]。叶黄素和玉米黄素是能够通过BRB并在人类视网膜黄斑区积累的类胡萝卜素,被称为黄斑色素。Youssef等[57]研究了眼组织的吸收光谱,发现在295 nm波长以下的紫外线被角膜吸收,300~400 nm波长的紫外线都被晶状体吸收。400~700 nm波长的可见光和700~1 400 nm波长的红外线很容易通过人类眼睛结构传输到视网膜。因此,几乎所有的紫外线在到达视网膜之前都被吸收。然而,研究发现最短波长的可见光(蓝光,400~500 nm)每光子携带的能量最高,与视网膜的光损伤有关[58]。人类的眼睛已经发展出两种机制来减弱蓝光的传输:其一是晶状体对蓝光传输的衰减;其二是通过黄斑色素过滤机制获得额外保护[59]。黄斑色素有助于吸收蓝光,其峰值吸收波长约为450 nm[59]。已有研究证明,这些黄斑色素可以过滤大约40%的蓝光[60]。然而,目前有关黄斑色素作为蓝光过滤器的作用机制尚不完全清楚。关于黄斑色素对减少色差和光散射、钝化光敏剂激发是否有重要意义还有待阐明。后期可针对以上问题进行深入探究,为进一步理解黄斑色素过滤蓝光的具体机理提供依据。
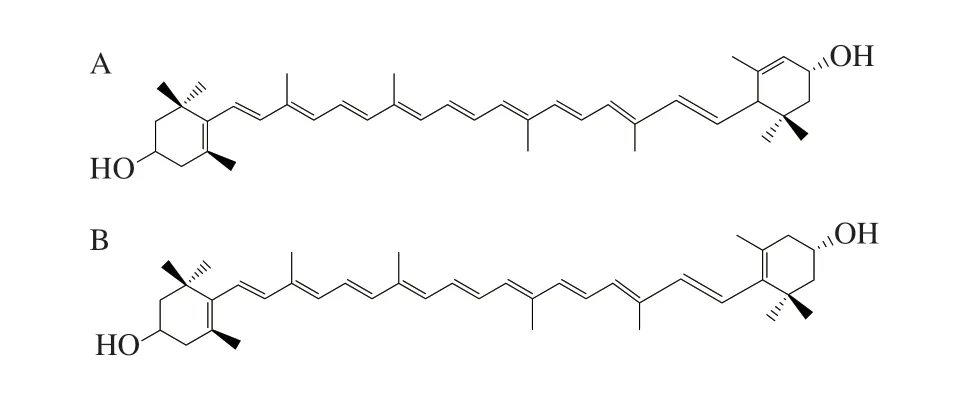
图2 叶黄素(A)与玉米黄素(B)的结构Fig.2 Structures of lutein (A) and zeaxanthin (B)
叶黄素与玉米黄素具有良好的抗氧化活性。最近一项综述报道了黄斑色素通过淬灭单线态氧、清除自由基以及淬灭光敏剂的激发三重态来实现视网膜氧化应激保护作用[61]。此外,黄斑色素还能通过“间接机制”来发挥抗氧化作用。Frede等[62]研究表明,叶黄素通过激活核因子相关因子2(nuclear-factor-E2-related factor 2,Nrf2)通路,上调抗氧化酶表达,从而增强RPE细胞抗氧化能力。Arunkumar等[63]进行了一项动物实验,发现叶黄素与玉米黄素能显著降低ABCA4和β-胡萝卜素-9’,10’-加氧酶(β-carotene 9’,10’-dioxygenase,BCO2)双基因敲除小鼠视网膜中A2E水平,并改善其视觉功能。Leung等[64]采用H2O2构建RPE细胞氧化应激模型,发现叶黄素与玉米黄素可抑制PUFAs过氧化,减少脂质过氧化物4-HNE等的产生,保护RPE细胞免受氧化应激的损伤。由此可见,黄斑色素能通过单线态氧、光敏剂的直接淬灭、减少脂质过氧化产物和A2E的产生以及提高抗氧化酶的活性来发挥抗氧化作用。
叶黄素与玉米黄素可以抑制炎症反应。Nidhi等[65]研究发现膳食摄入叶黄素可以缓解炎症,并在体内抑制TNF-α、IL-6和IL-8的产生。Yang Jiao等[66]的研究证实了补充叶黄素能抑制蓝光照射后大鼠血清中C反应蛋白、TNF-α和IL-6水平的升高,表明叶黄素保护视网膜组织免受蓝光损伤的能力部分是通过降低炎症和促炎细胞因子的水平来实现的。此外,摄入叶黄素与玉米黄素可降低内毒素性葡萄膜炎小鼠房水中NO、TNF-α、IL-6、前列腺素E2和MCP-1的浓度[67]。脉络膜新生血管在AMD和炎症过程的发病机制中发挥关键作用,叶黄素/玉米黄素治疗通过抑制NF-κB激活和随后的炎症介质上调从而抑制脉络膜新生血管[68-69]。一些对利用脂多糖构建的细胞和动物炎症模型的研究发现,叶黄素降低ROS水平并抑制ROS介导的转录活化因子3(activator of transcription 3,STAT3)炎症介质(IL-1β、IL-6、TNF-α、MCP-1)的表达[70-72]。可见,叶黄素抑制炎症的潜在机制与调节炎症相关基因的表达以及抑制炎症因子和促炎细胞因子的产生有关。
另外,叶黄素与玉米黄素还能够通过其他机制发挥视觉保护作用。Shivarudrappa等[73]研究表明叶黄素能够激活IRE1-XBP1、ATF6和ATF4通路及其下游激活剂,对ARPE-19细胞中高血糖介导的ER应激具有治疗作用。Widjaja-Adhi等[74]研究发现玉米黄素在视觉周期中具有保护作用,蓝光照射触发异常的ATR累积,对视网膜造成损伤,小鼠补充玉米黄素可以保护维甲酸免受光化学修饰的影响,并改善光诱导的视网膜损伤。在未来的研究中,黄斑色素和类维甲酸在光感受器生物学中的相互作用需要进一步详细描述。
黄斑色素光密度(macular pigment optical density,MPOD)是衡量黄斑区中叶黄素与玉米黄素浓度的指标[75]。流行病学调查及相关研究表明,膳食补充叶黄素和玉米黄素可以提高MPOD,改善视功能并减少老年人中AMD的发生。近期的一项综述为叶黄素/玉米黄素的饮食摄入提供了建议,指出在健康的成年人中,叶黄素与玉米黄素摄入量大于10 mg/d可以增加MPOD,但该综述未说明叶黄素/玉米黄素摄入的最小剂量和持续时间[76]。然而,有研究报道补充20 mg/d的叶黄素/玉米黄素并不能够比10 mg/d的剂量更有效地改善视觉表现[77-78]。对5 个随机对照实验的荟萃分析也得到了类似的结果[79]。相反,其他研究与叶黄素/玉米黄素疗效的线性剂量-反应模式一致,并得到8 个随机对照实验荟萃分析的支持,表明叶黄素/玉米黄素摄入量越高,改善视觉效果越好[80]。这些相互矛盾的结果很可能源于研究人群的差异,具体涉及饮食摄入量[81]。年龄相关性眼病研究2(Age-Related Eye Disease Study 2,AREDS2)显示,叶黄素/玉米黄素膳食摄入量最低的人群(每4 186 kJ能量的中位数只摄入0.7 mg/d)补充10 mg/d叶黄素/玉米黄素获得了最积极的结果[81]。因此,在低于1.4 mg/d平均摄入量的情况下,补充10 mg/d可能是慢性补充叶黄素/玉米黄素的最合适剂量。近年来部分叶黄素与玉米黄素对减少AMD发生的研究汇总如表1所示。

表1 叶黄素与玉米黄素对减少AMD发生的研究统计Table 1 Statistics of studies on the protective effects of lutein and zeaxanthin on AMD
2.1.3 岩藻黄素和虾青素
岩藻黄素(图3)是褐藻中最丰富和最具特色的色素之一,可以吸收波长在450~540 nm范围内的可见光[89]。本课题组前期研究发现,从海带中提取的岩藻黄素对可见光诱导的视网膜损伤有保护作用:体外实验结果表明,岩藻黄素在抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)过表达、抗衰老、提高吞噬功能、清除ROS等方面比叶黄素具有更好的生物活性;体内实验也证实了岩藻黄质在保护视网膜免受光损伤方面效果优于叶黄素[90]。这种优异的生物活性可能归功于其独特的结构特征[90]。后期实验结果表明,岩藻黄素通过调节Nrf2信号通路对可见光诱导的RPE细胞吞噬功能障碍有明显的改善作用[91]。岩藻黄素还可通过下调RPE细胞凋亡和细胞黏附因子蛋白表达,降低炎症反应,维持BRB的完整性,预防糖尿病视网膜病变[92]。这些结果表明岩藻黄质在临床上可能比叶黄素更有效地解决眼部问题。岩藻黄素有望成为未来重要的眼部营养素。

图3 岩藻黄素(A)与虾青素(B)的结构Fig.3 Structures of fucoxanthin (A) and astaxanthin (B)
虾青素(图3)是叶黄素家族中的天然红色类胡萝卜素,通常存在于海洋生物中,尤其是在微藻类和海洋动物产品中,例如鲑鱼、虾和龙虾[93]。由于独特的分子结构,虾青素具有一些重要的生物学特性,主要表现为强抗氧化、抗炎和抗凋亡活性[94]。Lin Chaowen等[95]研究发现虾青素以剂量依赖的方式诱导Nrf2的核转位,提高II相抗氧化酶的表达,保护视网膜细胞免受蓝光诱导的氧化应激损伤。Otsuka等[96]使用视网膜缺血/再灌注模型研究虾青素对视网膜细胞的保护作用,发现虾青素通过抑制NF-κB的激活来缓解炎症反应。Fakhri等[97]研究表明,虾青素通过下调p-Erk/ERK、细胞色素c、Caspase 3、Caspase 9的激活和Bax2/Bcl2比例来发挥抗细胞凋亡的作用。此外,在对糖尿病大鼠视网膜病变模型的研究中发现,虾青素降低缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)、ERS标志物XBP1和VEGF的表达,对糖尿病所致视网膜异常具有保护作用[98]。因此,虾青素有可能作为一种潜在的营养制剂来预防或治疗糖尿病患者的视网膜功能障碍。
2.2 多酚
2.2.1 花色苷
花色苷为自然界中水溶性的可食用植物色素,广泛分布于深色的蔬菜、浆果和谷物中[99-100]。现有研究表明摄入花色苷对视力具有保护功效,其作用机制涉及多种途径(图4),包括促进视紫红质再生、增强抗氧化系统、抑制炎症、抗衰老和缓解ERS等[32,101]。

图4 花色苷对视网膜保护途径Fig.4 Pathway for retinal protection by anthocyanins
视网膜中的视紫红质可能是花色苷的作用靶点之一。感光细胞通过视紫红质漂白触发视觉传导,随着花色苷改善夜视功能的报道不断涌现,人们开始关注花色苷与视紫红质的相互作用。Nomi等[102]研究发现从黑醋栗中纯化的矢车菊素-3-葡萄糖苷(cyanidin-3-glucoside,C3G)能够促进青蛙视杆细胞外层的视紫质再生,而飞燕草素花色苷则没有此效果。Yanamala等[103]从牛视网膜中获得视紫质,利用核磁共振氢谱技术观察了C3G与视紫质的作用,发现当经过暗光激活后,C3G能够与视紫质结合,他们认为这与该条件下所造成的pH环境对C3G结构的改变有密切关系。同时,该研究组对C3G促进视紫质再生的机理做了研究,认为这与改变视蛋白结构并促进其与视黄醛的结合有关[104]。以上研究表明,膳食C3G能够促进视紫红质再生,但其具体机制仍不明确。
花色苷可通过清除ROS及激活内源性抗氧化通路从而抑制氧化应激[105-106]。Song Yu等[107]研究发现蓝莓花色苷能够激活Nrf2/HO-1信号通路,增加谷胱甘肽含量,降低MDA和ROS水平,预防糖尿病视网膜病变。Wang Yong等[108]研究表明C3G及其酚酸代谢物显著上调Nrf2/HO-1的表达,减轻视网膜氧化应激,减少DNA损伤和脂质过氧化,抑制可见光诱导的视网膜变性。进一步研究表明C3G可通过清除RPE细胞内ROS,抑制A2E光氧化及MG生成,从而缓解光损伤导致的RPE细胞凋亡[109]。本课题组前期研究发现,蓝莓花色苷能抑制脂质过氧化反应,其机制涉及清除ROS及抑制VEGF过表达[33]。此外,Lee等[110]研究发现越橘提取物能抑制A2E在细胞内的积聚,减少ROS的生成,减轻蓝光对携带A2E的RPE细胞和小鼠视网膜的损伤。
有关花色苷的抗炎活性也已有多项研究证实。NOD样受体结合蛋白3(NOD-like receptor binding protein 3,NLRP3)介导Caspase-1激活和促炎细胞因子IL-1β/IL-18的分泌,异常激活产生炎症反应,C 3 G 通过调控JNK-c-Jun/转录因子激活蛋白-1(activator protein-1,AP-1)通路,钝化NLRP3炎症体的激活,从而缓解视网膜炎症[111]。除了钝化NLRP3炎症体激活外,蓝莓花色苷还能抑制细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)和NF-κB表达,干预高糖诱导的人视网膜毛细血管内皮细胞炎症反应,预防糖尿病视网膜病变[112]。此外,越橘花色苷提取物能下调脂多糖诱导的小鼠视网膜炎症和葡萄膜炎后视网膜中IL-6的表达,抑制NF-κB的激活及炎症中伴随出现的视网膜感光细胞OS缩短及视紫红质减少[113]。
此外,花色苷还能缓解ERS。Ooe等[114]研究表明,越橘花色苷能通过调节ATF4的表达,抑制短波视蛋白的异常聚集来缓解ERS,保护感光细胞。Peng Wenting等[115]基于A2E和蓝光诱导的RPE细胞损伤模型进行研究,发现C3G通过抑制ERS保护内质网形态结构,改善RPE细胞的屏障功能,上调紧密连接蛋白的表达。Nakamura等[116]研究了越橘提取物对视神经挤压伤后视网膜神经节细胞(retinal ganglion cell,RGC)的影响,发现越橘提取物可通过调节Bip的表达,缓解ERS,抑制RGC死亡。
目前研究发现,多数花色苷稳定性较差、生物利用率较低,其含量和功能活性极易受到加工影响,在一定程度上限制了花色苷在健康食品产业中的应用。未来应进一步研究加工过程中提高花色苷稳定性的方法,通过优化递送系统提高花色苷在体内的稳定性和生物利用度。
2.2.2 其他多酚
除花色苷外,还有一些多酚具有良好的护眼功能。例如,槲皮素能通过抑制AP-1活性、聚腺苷二磷酸核糖聚合酶(poly(ADP-ribose) polymerase,PARP)裂解和补体激活,参与RPE细胞内A2E的清除,缓解蓝光和紫外线诱导的细胞凋亡[117]。儿茶素可显著下调糖尿病视网膜病变大鼠NF-κB和促炎介质(IL-1β、IL-6、TNF-α)的表达,因此可以作为治疗糖尿病视网膜病变的有效成分[118]。阿魏酸可减轻碘酸钠诱导的视网膜变性小鼠细胞损伤,口服阿魏酸可以为视网膜提供保护作用[119]。大量研究表明多酚可有效保护视力,维持视网膜正常功能。但目前的研究大多集中于花色苷,对其他多酚研究较少,有待进一步研究。
2.3 长链不饱和脂肪酸
感光细胞OS盘膜中含有丰富的PUFAs,对人类正常的视网膜活动和视力保护具有重要作用。DHA是感光细胞中含量最丰富的PUFAs,能够延缓感光细胞凋亡,促进细胞分化,提高视蛋白的表达,视网膜DHA的减少还会影响视敏度和全视野ERG[120]。二十碳五烯酸(eicosapentaenoic acid,EPA)可以调节脂蛋白的代谢,抑制炎症化合物的表达,这些炎症化合物可以破坏细胞外基质,包括Bruch膜,并导致新生血管AMD[121]。Gorusupudi等[122]研发了一种大量合成超长链不饱和脂肪酸的方法,补充这种不饱和脂肪酸可以增加小鼠的视网膜脂质水平,并改善其视觉功能。Deng Qianchun等[123]研究显示摄食富含ω-3 PUFAs的油脂通过激活NRF2/HO-1信号通路和下调NF-κB p65的表达来减轻光诱导的视网膜变性。此外,补充EPA和DHA可有效缓解干眼症状,其机理除了减轻炎症之外,还包括改善泪膜的脂层、使睑板腺和泪腺的功能正常化[124]。然而,本课题组研究发现,在强光条件下补充DHA会增加RPE细胞对光损伤的敏感性,通过脂质过氧化作用导致RPE细胞的功能障碍[125]。因此,补充PUFAs可能会加剧视网膜光损伤,服用PUFAs补充剂的患者应该避免或减少暴露在高光强条件下。
2.4 牛磺酸
牛磺酸是一种含硫非蛋白氨基酸,可以促进视网膜的分化和发育[126],改善细胞生长条件,维持视网膜正常功能,延长视网膜细胞生存期[127]。Garcia-Ayuso等[128]研究发现牛磺酸耗竭下的光暴露会加速光感受器的退化,补充牛磺酸有助于防止视网膜变性。Froger等[129]基于细胞和动物模型进行研究发现,补充牛磺酸能提高RGC的体外存活率,缓解N-甲基-D-天冬氨酸(N-methyl-Daspartate,NMDA)诱导的RGC兴奋毒性,这一结果进一步得到体内实验的证实。在一项以N-甲基-N-亚硝基脲诱导的小鼠视网膜变性实验中发现,静脉注射牛磺酸可以有效增加视网膜中牛磺酸浓度,改善视网膜组织紊乱,缓解视网膜M-视锥和S-视锥细胞群变性[130]。以上结果表明,牛磺酸可缓解变性视网膜中的氧化应激,增加RGC和感光细胞存活率,补充牛磺酸可能是青光眼、RP的一种治疗方法。
2.5 维生素类
VA是人体必需维生素,主要在小肠吸收,参与视紫红质的形成[131]。夜盲症是由视杆细胞功能障碍引起的[132]。陈子畅等[133]研究表明VA通过抑制氧化应激减轻炎症反应来保护光感受器细胞,这为补充VA治疗夜盲症提供了理论依据。VB2(核黄素)的缺乏会导致结膜炎等眼科疾病。流行病学研究表明,服用5 mg VB2(3 次/d)能够有效缓解季节性角膜炎;如果结合VB3(烟酰胺)(25 mg,3 次/d)服用,效果更佳[134]。谷物的表皮层含有丰富的VB,但在谷物加工过程中丢失十分严重,长期食用精制的大米和淀粉而缺乏必要的粗粮摄入,往往会导致VB缺乏症。报道显示,服用500 mg/d VC能够改善眼睛刺痛、眼睛分泌物多等症状;使用VC眼药水能够有效缓解过敏性和感染性结膜炎[134],但其具体机理还不清楚。此外,流行病学研究发现膳食中VC的摄入量与白内障发病率呈负相关[135]。VD对圆锥形角膜病也有一定治疗效果。研究表明,连续3 个月到3 年服用15 000 IU/d剂量的VD能够明显缓解圆锥形角膜病,使视锥细胞矫平,提高视力[134]。此外,有研究发现,服用麦角固醇(VD2的前体物)对改善近视也有帮助[134]。VE和VC具有抗炎活性,对眼科炎症疾病有一定的疗效。研究发现,连续8 周服用500 mg/d的VC和100 IU/d的VE对改善急性葡萄膜炎有一定的帮助[134]。然而,有关维生素类物质对视网膜光损伤的防治作用研究较少,相关功效还并不明确。
3 结语
综上所述,过量光暴露会导致视网膜感光细胞及RPE细胞凋亡,破坏视网膜的结构与功能。氧化应激、炎症反应、ERS是光诱导视网膜损伤的主要原因。花色苷、类胡萝卜素及VC、VE等具有良好的抗氧化及抗炎活性;叶黄素、玉米黄素能够过滤蓝光,减弱蓝光光照强度;部分功能因子如VA和花色苷还能通过促进视紫质再生参与视传导,具有抑制视网膜细胞凋亡等生物活性;此外,不饱和脂肪酸和牛磺酸能够促进视网膜细胞分化和发育,改善视功能。可见,花色苷、类胡萝卜素等营养成分可以作为功能性食品和辅助治疗剂来预防和治疗视网膜光损伤。
未来可重点从以下方面研究膳食营养组分改善视网膜光氧化损伤作用及相关机理:1)膳食营养成分改善视网膜氧化损伤机制涉及调控氧化应激、炎症反应和ERS等通路,但各通路间联合调控机制尚未明确,还有待进一步证实。2)花色苷、类胡萝卜素等膳食组分存在化学性质不稳定、生物利用率低等问题,提高其稳定性及生物利用度可能更有利于发挥其预防视网膜光损伤的功能。3)不同营养成分在调控途径方面的差异性赋予其在改善视力方面的潜在协同效应,这有助于通过合理膳食搭配实现精准营养补充,从而保护视力。
