烟酰胺磷酸核糖基转移酶及沉默信息调节因子2同源蛋白1在乳腺癌组织中的表达及与患者临床病理特征的关系
2023-08-11邹腾跃邹芳芳孙亚君尹俊倩毕铁强
邹腾跃,邹芳芳,孙亚君,尹俊倩,毕铁强
(1.潍坊医学院临床医学院,山东 潍坊 261053;2.山东大学附属威海市立医院,山东 威海 264200)
乳腺癌已成为严重威胁女性生命的恶性肿瘤之一[1]。在2020年全球最新癌症数据中报道,乳腺癌目前已取代女性肺癌成为全球女性癌症第一的恶性肿瘤[2]。肿瘤增殖通常依赖于烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NAD)的生物学作用机制[3]。NAD的代谢和稳定对维持组织内环境稳态尤为重要,高NAD水平可增强肿瘤治疗抵抗性[4]。首先,烟酰胺磷酸核糖基转移酶(Nicotinamide phosphoribosyl transferase,NAMPT)作为生理性NAD合成的限速酶,通过控制干细胞信号传导途径增加肿瘤发生率。肿瘤细胞增殖过程被其他NAMPT抑制剂抑制后,NAD的补充和下游代谢平衡会被中断。抑制NAMPT过程导致NAD耗尽,随后抑制ATP合成,进而增加表达NAMPT的癌症起始细胞群对凋亡的敏感性[5]。其次,NAMPT作为一种致癌基因,可作为诱导乳腺癌中基本干细胞途径的关键因素。这种效应是由NAMPT下游因子PARP和SIRT-1所介导。沉默信息调节因子2同源蛋白1(Silencing regulatory protein-1,SIRT-1)是第三类组蛋白去乙酰化酶的家族成员,其使用NAD作为辅助因子。此外,SIRT-1的表达失调与肿瘤、代谢、感染和神经退行性疾病的发病机制密切相关[6]。最近的研究已将SIRT-1与正常干细胞的功能相联系起来,此外,SIRT-1在肿瘤细胞耐药性、肿瘤干细胞特性和化疗诱导的干细胞性中的作用仍是未知状态[7-8]。基于此,本研究拟通过组织芯片技术和免疫组化技术检测不同临床特征乳腺癌中NAMPT及SIRT-1表达,旨在为今后乳腺癌患者的临床治疗、预后改善等提供基础。
1 资料与方法
1.1 一般资料 研究对象选取为2015年1月至2017年12月威海市立医院甲状腺乳腺外科手术成功切除乳房的381例乳腺癌患者,年龄34~78岁,平均(56.52±10.12)岁;其中有淋巴结转移者167例,肿瘤直径≥2 cm者104例,无病生存期≥55个月者329例,随访5年存活364例、死亡17例。病例纳入标准:均于我院成功完成乳腺外科手术,并经术后病理结果证实为乳腺癌患者;手术前未接受过乳腺放疗、化疗及其他药物治疗者;完成5年随访或随访至患者死亡,无失访病例,且临床检查资料与随访资料齐全者等。排除标准:伴有其他严重恶性肿瘤者;既往参与过其他试验者;伴有传染性疾病者;复发性乳腺癌患者等。本临床试验经威海市立医院伦理委员会审核并同意。
1.2 研究方法
1.2.1 试剂:兔抗人Anti-Visfatin antibody抗体及兔抗人重组Anti-SIRT-1抗体均购自美国Abcam公司。
1.2.2 组织芯片技术:收集381例乳腺癌患者的病理组织标本,样本蜡块进行苏木精-伊红染色法(HE)染色后观察,选定并分别在HE切片和相应石蜡组织块上标记取样组织的位点,用内径0.6 mm的不锈钢针进行穿刺,深度2~3 mm,将其固定于模具蜡块板上的小孔内;在切片成型前,蜡块需在4 ℃的冰箱中预冷处理4 h,然后取出蜡块在切片机套板上进行修正。用-20 ℃预冷冰袋贴覆在模具蜡块表面膜上5~10 min左右后,快速连续切片30~50张左右,再用冰袋冷冻出组织块。将模具蜡块以4 μm厚度均匀的连续切片敷贴于载玻片或尼龙膜等固相载体上,完成组织芯片制片。
1.2.3 免疫组织化学法(SP法):首先,将组织切片放置在二甲苯甘油中加热脱蜡,在不同梯度的乙醇溶液中重新水化后进行抗原修复,在3%过氧化氢(H2O2)溶液中脱洗10 min后注入20%山羊血清室温下封闭1 h;随后,分别滴加兔抗人Anti-Visfatin antibody抗体及重组Anti-SIRT-1抗体,再分别用20%山羊血血清稀释(分别为1∶1000、1∶500)抗体,4 ℃冰箱过夜;最后,组织切片用磷酸缓冲盐溶液(PBS)溶液清洗3次后进行孵育。
1.2.4 结果判定:免疫球蛋白的染色评分结果基于免疫球蛋白的染色强度值标准和阳性细胞百分比。染色强度判定标准:细胞无着色(0分),细胞着色为淡黄色(1分),细胞着色为深棕色(2分),细胞着色为褐色(3分)[8]。阳性细胞百分比:阳性细胞<25%(0分),阳性细胞比值介于25%~50%之间(1分),阳性细胞比值介于51%~75%之间(2分),阳性细胞比值>75%(3分)。以免疫球蛋白的染色强度值及阳性细胞百分比相加得到的加权系数总和得出免疫球蛋白表达的最终得分,其中,染色强度与阳性细胞比值得分相加≤3分为低表达,>3分为高表达。
1.3 观察指标 分析三阴性乳腺癌与非三阴性乳腺癌患者NAMPT及SIRT-1的蛋白表达,并分析其与患者年龄、淋巴结转移情况、肿瘤大小、无病生存期、5年存活率等临床病特征之间的关系及NAMPT表达与SIRT-1表达的关系,采用Pearson相关系数检验分析NAMPT、SIRT-1表达与临床特征之间的相关性。
1.4 统计学方法 数据分析使用SPSS 21.0统计学软件进行。计数资料采用[例(%)]表示,两组比较采用χ2检验;采用Pearson相关系数检验分析NAMPT、SIRT-1表达与临床特征之间的相关性;P<0.05表示差异具有统计学意义。
2 结 果
2.1 三阴性乳腺癌与非三阴性乳腺癌患者NAMPT及SIRT-1表达情况比较 三阴性乳腺癌患者NAMPT高表达率高于非三阴性乳腺癌患者(P<0.05),见表1。
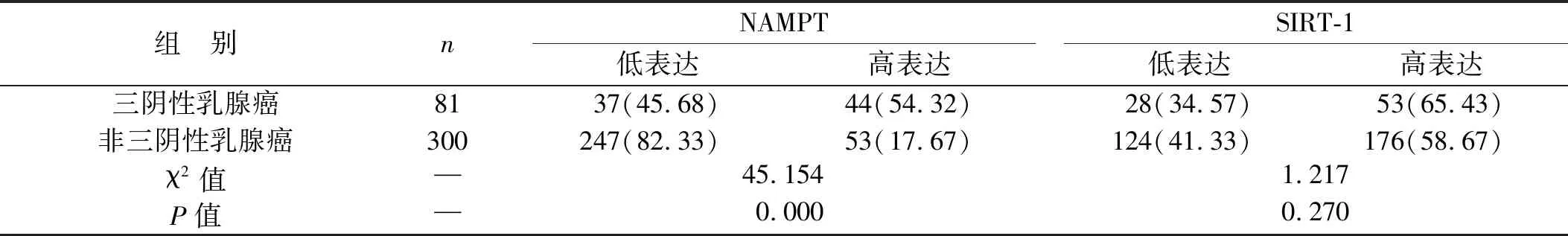
表1 三阴性乳腺癌与非三阴性乳腺癌患者NAMPT及SIRT-1表达情况比较[例(%)]
2.2 乳腺癌中NAMPT表达与患者临床特征的关系 年龄≥56岁、有淋巴结转移、无病生存期<55个月的乳腺癌患者NAMPT高表达率高于年龄<56岁、无淋巴结转移、无病生存期≥55个月的乳腺癌患者(均P<0.05),见表2。
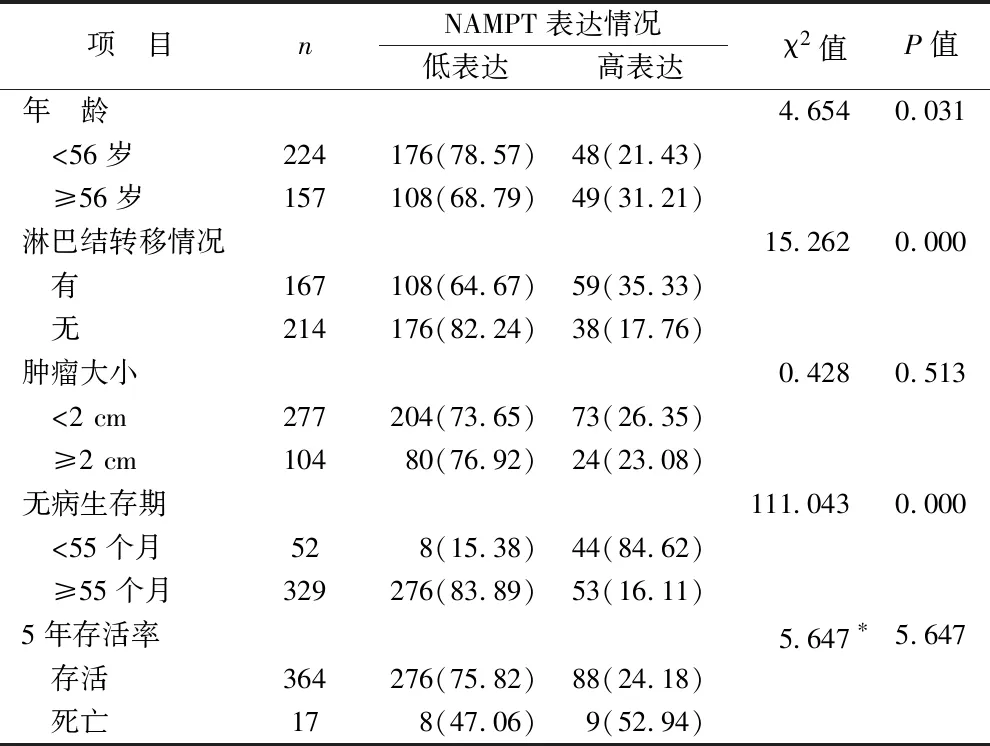
表2 乳腺癌中NAMPT表达与患者临床特征的关系[例(%)]
2.3 乳腺癌中SIRT-1表达与患者临床特征的关系 有淋巴结转移、无病生存期<55个月的乳腺癌患者SIRT-1高表达率高于年龄<56岁、无病生存期≥55个月的乳腺癌患者(均P<0.05),见表3。

表3 乳腺癌中SIRT-1表达与患者临床特征的关系[例(%)]
2.4 乳腺癌患者NAMPT与SIRT-1表达的关系 NAMPT高表达的乳腺癌患者SIRT-1高表达率高于SIRT-1低表达率(P<0.05),见表4。
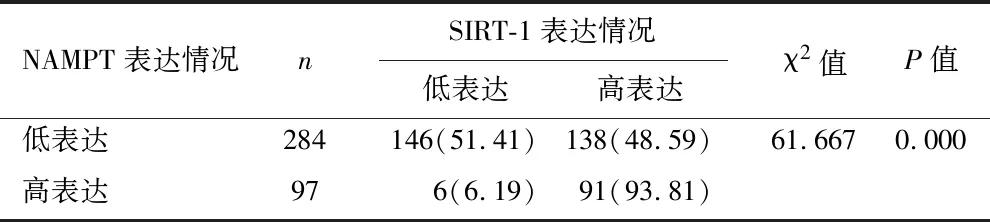
表4 乳腺癌患者NAMPT与SIRT-1表达的关系[例(%)]
2.5 乳腺癌患者NAMPT及SIRT-1表达情况与临床特征之间的相关性 乳腺癌患者NAMPT、SIRT-1表达与淋巴结转移、无病生存期呈正相关(r=0.079、0.505、0.462、0.497,均P<0.05),见表5。

表5 乳腺癌患者NAMPT及SIRT-1表达情况与临床特征之间的相关性
3 讨 论
随着近年来科学技术的迅速发展,人们的健康防病意识越来越强,这使得癌症患者在早发现、早诊断、早治疗方面得到了新起点,尽管目前对乳腺癌的治疗取得一定的进展,但仍有许多中晚期乳腺癌患者的病情无法得到有效的控制。但对于乳腺癌的临床分子分型、治疗方式、预后预测等方面还需要进行更为完善的分子病理学研究及临床试验。故而,提高肿瘤组织的靶向化疗敏感性,延缓肿瘤细胞的快速进展,提高肿瘤患者的化疗生存率,已成为现代抗肿瘤靶向药物治疗中急需解决的重点问题。本研究通过分析乳腺癌患者NAMPT及SIRT-1的表达,取得了较好的结果。
本研究结果显示,三阴性乳腺癌患者NAMPT高表达率高于非三阴性乳腺癌患者,年龄≥56岁、有淋巴结转移、无病生存期<55个月的乳腺癌患者NAMPT高表达率较高,且NAMPT表达与淋巴结转移、无病生存期呈正相关,提示三阴性乳腺癌患者NAMPT为高表达,且其表达与乳腺癌患者临床特征密切相关。NAMPT可催化烟酰胺转化为烟酰胺单核苷酸(Nicotinamide single nucleotide,NMN)过程,是NAD补救途径中的限速步骤[9-11]。实验证明NAMPT在许多肿瘤类型中过表达,且在乳腺癌中NAMPT已被证实是一种有效的靶向癌基因[12]。许多Ⅰ期和Ⅱ期临床试验开始推广NAMPT抑制剂的使用[13-14]。目前已有实验室正在探索针对NAMPT的新药设计,为乳腺癌患者的临床治疗提供新一代肿瘤靶向抑制剂,通过抑制剂抑制NAMPT活性作用于NAD可发挥减少肿瘤细胞糖酵解、核苷酸合成和腺嘌呤核苷三磷酸生成等作用,进而抑制患者病情进展[15]。此外,NAMPT还可作为控制其他NAD依赖性蛋白家族途径中的上游因子,NAD+是SIRT-1的限速辅因子,其调节成为调节SIRT-1功能的重要工具[16]。SIRT-1则倾向于通过赖氨酸残基的H3脱乙酰化来激活或抑制特定靶基因的转录[17]。进一步分析SIRT-1与乳腺癌患者临床特征的关系发现,有淋巴结转移、无病生存期<55个月的乳腺癌患者SIRT-1高表达率较高,SIRT-1表达与淋巴结转移、无病生存期呈正相关,且NAMPT高表达的乳腺癌患者SIRT-1高表达率高于SIRT-1低表达率,进一步说明NAMPT可影响SIRT-1的表达,且SIRT-1的表达与乳腺癌患者淋巴结转移、预后密切相关。分析原因可能为SIRT1作为SRtuin家族成员之一,可参与应激反应、新陈代谢、细胞衰老及增殖等,在肿瘤形成中主要起促癌基因作用。
目前,临床试验已证实乳腺癌患者可对NAMPT抑制剂敏感,而本研究进一步证实NAMPT可驱动干细胞与干细胞信号通路的上调,且NAMPT可影响SIRT-1的表达[18]。因此,可将NAMPT、SIRT-1作为乳腺癌治疗和复发中的新的治疗靶点,在乳腺癌细胞中抑制NAMPT的高表达可能有助于抑制去分化;且对具有化疗抵抗性的肿瘤使用NAMPT抑制剂可以抑制SIRT-1的表达,进而抑制肿瘤细胞增殖,同时提高肿瘤对于化疗药物的敏感性,有助于提高乳腺癌患者的临床治疗效果[19]。最近的研究强调了这些介导肿瘤化疗耐药性的途径的重要性,并且干细胞信号通路的上调与肿瘤细胞的放疗耐药性相关[20]。
综上,NAMPT在三阴性乳腺癌中表达明显上调,NAMPT可影响SIRT-1的表达,同时年龄可能影响NAMPT及SIRT-1的表达,且两者高表达预示患者可能出现淋巴结转移、预后差。NAMPT及SIRT-1的表达可能作为乳腺癌治疗和复发中的新的生物学分子治疗靶点,为改善患者的不良预后提供明确的研究方向。但本研究亦存在一定不足,如样本量较少、为单中心研究、未完全明确三阴性乳腺癌患者NAMPT及SIRT-1的表达机制及二者对乳腺癌的具体作用机制等,仍有待临床进一步研究并证实NAMPT、SIRT-1在乳腺癌中的表达及其临床意义。
