氧化还原实验探究题命题情境与命题视角窥探
2023-08-11陈建托
陈建托
(首都师范大学附属中学)
科学探究是进行科学解释和发现、创造和应用的科学实践活动,化学实验是探究和学习物质及其变化的基本方法,是科学探究的一种重要途径。
北京市高考化学命题注重科学探究的考查,试卷压轴题一般以实验探究题形式呈现,而氧化还原相关的情境因具有很强的综合性、复杂性,是探究题重要切入点之一。本文研究北京市近几年高考题、模拟题中与氧化还原相关的实验探究题,分析命题情境,梳理命题视角,期望给予高三复习和备考一定的帮助。
一、命题情境
《普通高中化学课程标准》(2017年版2020年修订)提出“以真实情境为测试载体”的命题原则。“无情境不命题”,北京市实验探究题一般以真实情境为载体,立足于解决实际问题,实现对学生基础知识、关键能力和学科素养的考查。
氧化还原相关实验探究题命题情境主要有以下特点:
①情境具有真实性、科学性且具有正确的价值导向,落实高考立德树人的核心功能。
②一般选取核心元素的重要化合物进行多角度的实验探究。
③情境合理地、立体化地将化学学科核心内容紧密关联,构建具有内部逻辑的整体。
④情境具有一定的综合性、复杂性,体系一般多物质、多性质、多反应、多干扰,解决问题需要多步分析推理、灵活迁移应用。例如2019年北京高考探究SO2与AgNO3溶液的反应,体系有多种物质,物质有多重性质,反应有多种可能,如图1所示。
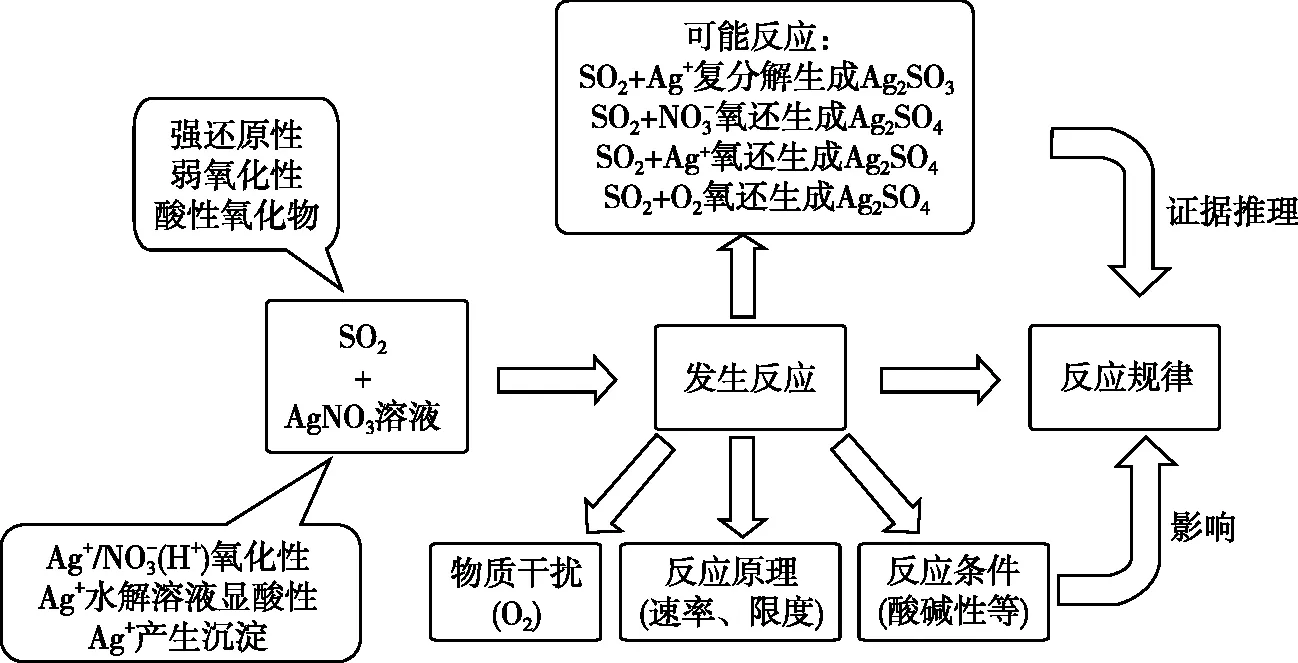
图1 SO2与AgNO3溶液反应体系
笔者将北京市近10年高考题(含等级性考试)和近3年模拟题(含高三上学期期末考试,本文简称高三期末)中相关情境归纳,简析4类典型情境。
(一)氧化性物质+还原性物质复杂反应体系
一般命题选取学生相对熟悉的物质,但物质性质多元,物质之间的反应比较复杂,除氧化还原反应外还可能涉及酸碱反应、沉淀反应、络合反应,浓度、温度、溶液的pH等反应条件会影响反应进行,反应速率和反应限度也影响反应的竞争性。这种情境命题切入点丰富,在考题中比较普遍。
(二)物质制备或性质探究
选取具有典型氧化性或还原性的物质,对其制备或性质进行探究。这种情境涵盖面广泛,设置问题灵活,突出对实验技能的考查。
(三)意外现象
化学学科的魅力之一在于其不确定性,实验中经常出现预期之外的现象,这也成为常见命题情境之一。意外现象情境可以构建“原有认知→情境冲突→解决问题→新的认知”的思维历程,将反应原理、实验操作、实验设计、实验评价和结论概括等有机融合。相关题目如表1所示。
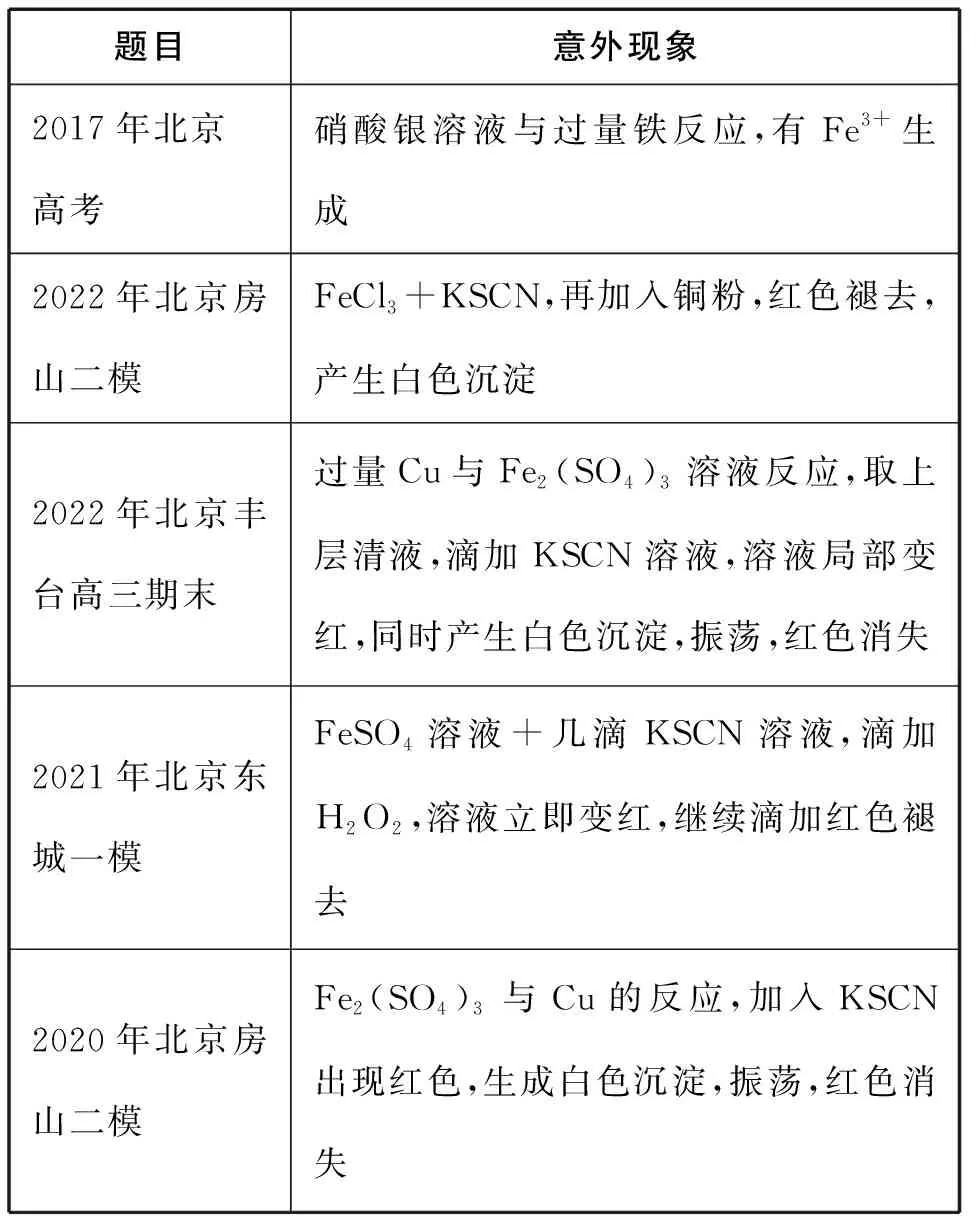
表1 意外现象考题
(四)可逆氧化还原反应
依托可逆氧化还原反应开展的探究实验,可关联平衡移动、平衡常数测定和计算、反应速率、氧化性还原性变化、电化学等知识,题目思维量大、综合度高。近几年相关考题如表2所示。
二、命题视角
实验探究题情境复杂新颖,命题视角丰富灵活,这种命题形式和趋势可以起到反套路、反押题的作用,引导摒弃机械刷题。本文给出几种经典命题视角。
(一)氧化性、还原性变化
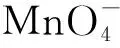
1.氧化性、还原性影响因素探究
探究物质氧化性还原性影响因素常采取的办法是控制变量进行对比实验,设计实验时要控制浓度、温度等条件一致,保证单一变量,勿引入多余干扰因素。
2.沉淀反应或络合反应对物质氧化性或还原性的影响
反应物或产物发生沉淀反应或络合反应引起物质浓度改变,影响物质氧化性或还原性,进而影响氧还反应的进行。
【例1】(2021年北京房山一模节选改编)化学变化是有条件的。某小组同学探究I-与金属阳离子的氧化还原反应,实验过程如表3。已知:同浓度的稀溶液中氧化性:Ag+>Fe3+>Cu2+。
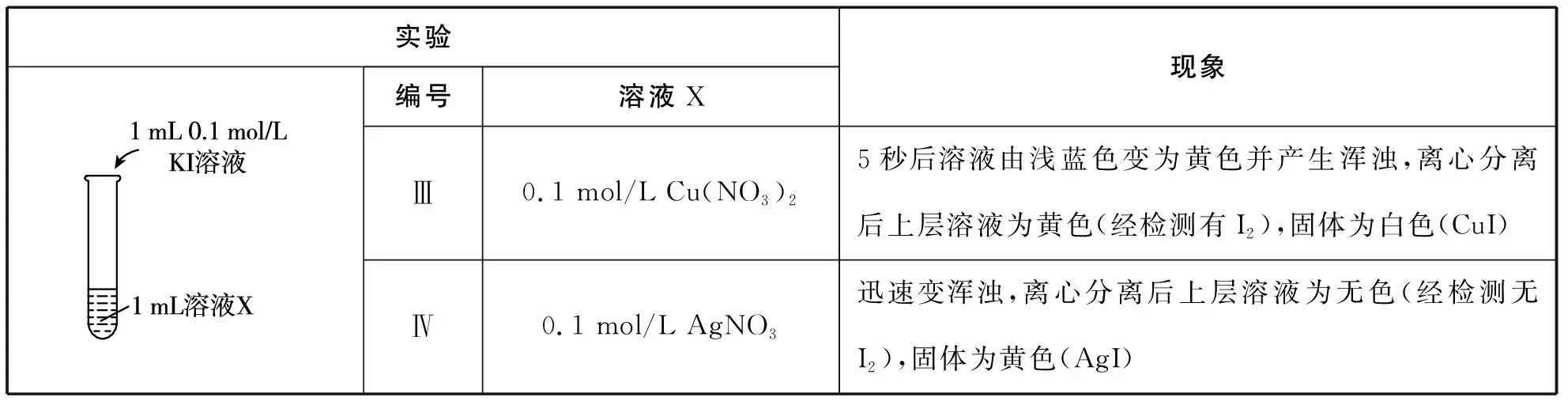
表3 实验过程
(3)实验Ⅲ中Cu2+与I-反应的离子方程式是________________________。
(5)该小组同学进一步分析认为,实验Ⅲ发生氧化还原反应的原因是________,实验Ⅳ没有发生氧化还原反应的原因是:________________。

(二)物质干扰
进行氧化还原相关的实验,体系中可能会有其他物质干扰,影响核心物质和反应的探究。排除物质干扰常用两种方法。
1.直接去除干扰物质
如果干扰物质容易去除,则直接去除干扰物质进行对比实验。如2011年北京高考,探究SO2与可溶性钡盐的反应,存在两种干扰,一是装置中的空气,可以实验前通一段时间氮气去除;二是铜与浓硫酸反应挥发的硫酸酸雾,可以通过饱和NaHSO3溶液洗气去除。
2.替换干扰因素,进行对比实验
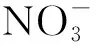
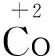
实验Ⅰ.粉红色的CoCl2溶液或CoSO4溶液在空气中久置,无明显变化。
实验Ⅱ.向0.1 mol/L CoCl2溶液中滴入2滴酸性KMnO4溶液,无明显变化。
实验Ⅲ.按如图2所示装置进行实验,观察到电压表指针偏转。
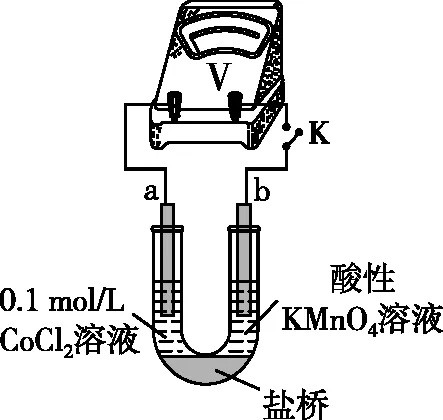
图2 实验装置
①甲同学根据实验Ⅲ得出结论:Co2+可以被酸性KMnO4溶液氧化。
乙同学补充实验Ⅳ,____________(补全实验操作及现象),否定了该观点。
【简析】实验欲探究Co2+与KMnO4溶液的反应,但有Cl-干扰。一方面可以替换Cl-进行对比实验,将实验Ⅲ中的0.1 mol/L CoCl2溶液替换为0.1 mol/L CoSO4溶液,指针几乎不偏转;另一方面,也可以替换Co2+进行对比实验,将实验Ⅲ中的0.1 mol/L CoCl2溶液替换为0.2 mol/L NaCl溶液进行实验,指针偏转幅度与实验Ⅲ相同。
(三)竞争反应
在发生氧化还原反应的同时还可能存在其他类型反应的竞争,即体系为多反应体系。举例如表4所示。
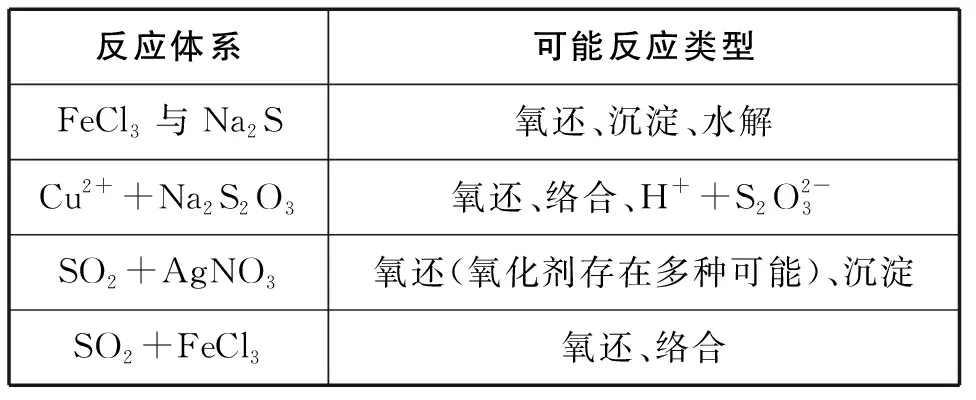
表4 竞争反应
1.双液电池避免非氧化还原反应干扰
对于多反应体系,若需要进行氧化还原反应、避免其他反应类型,可以采用双液电池装置,如图3所示。例如探究硫酸铜溶液与硫化钠溶液的氧化还原反应,若二者直接接触会立即产生CuS沉淀而影响氧化还原反应的进行,运用双液电池装置可以避免两种物质直接接触,进而避免沉淀反应。
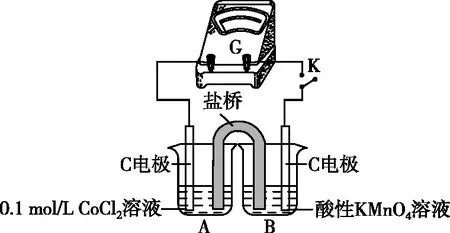
图3 双液电池装置
2.络合反应避免氧化或沉淀反应
如FeCl3溶液与Na2S溶液混合制备Fe2S3,可能发生氧化还原反应,加入NaF将Fe3+络合,降低c(Fe3+)进而降低Fe3+氧化性,可以避免氧还反应,从而制得Fe2S3。
再如2021年北京高考,铁黄(FeOOH)纯度可以通过产品的耗酸量确定,如图4所示。
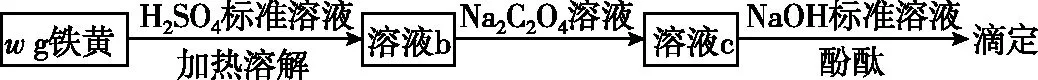
图4 铁黄纯度测定
本题为返滴法,用NaOH溶液滴定剩余H2SO4。但是溶液b中存在Fe3+,会与NaOH反应生成沉淀干扰滴定,加入过量Na2C2O4将Fe3+络合,可以避免Fe3+与NaOH反应。
3.反应主次、快慢、先后的协调与竞争
反应主次、快慢和先后涉及反应速率与反应限度等因素。举例几种情况。
①先A再B。若体系中可以进行两种反应A、B,且先进行A,过一段时间再进行B,一般是A反应的速率快(活化能低),B反应的限度大(平衡常数大)。

②A多B少。体系中同时进行两种反应A、B,A反应的比例高于B反应,一般是A反应的速率快,B反应的速率慢。
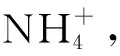
③连续反应。体系中A反应生成M物质,B反应消耗M物质。若M有积累剩余,则A反应速率快;若M几乎无积累,则B反应速率更快。
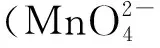
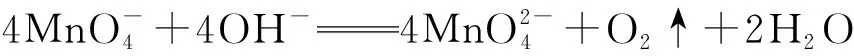

(四)氧还产物多样化
因反应物浓度、相对用量(滴加顺序)或pH等因素的改变,反应产物有多种可能。
三、结语
氧化还原相关的实验探究题一般具有完整的逻辑,可从以下几个环节进行分析推理:
①明确目的;
②识别变量和干扰;
③设计并进行实验,实现变量控制和排除干扰;
④结合反应原理进行分析解释。
题目分析模型如图5所示。
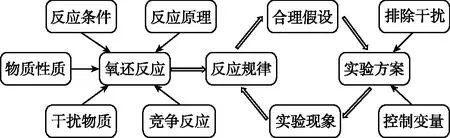
图5 分析模型
氧化还原相关实验探究题大多以素养立意为命题导向,强化实验情境、基础知识、实验能力及学科思想之间的高度联系。教师在教学中需要注重情境化教学,精心设计实验探究活动,培养学生对复杂体系进行观察、分析和推理的能力,进而全面提升学生学科素养,落实立德树人根本任务。
