基于“实验探究与证据推理”素养导向的“化学平衡”教学实践与反思
2023-08-11牛淼
牛 淼
(安徽省合肥市第七中学)
核心素养是学生应具备的、能够适应终身发展和社会发展需要的必备品格和关键能力,《普通高中化学课程标准》(2017年版2020年修订)中提出了“宏观辨识与微观探析” “变化观念与平衡思想” “证据推理与模型认知” “科学探究与创新意识” “科学态度与社会责任”五个维度的化学学科核心素养,再一次凸显出了实验探究和证据推理在课堂教学实践中的核心地位,在素养为本的背景下,一线教师重塑化学课堂,具有非常重要的现实意义,也是时代赋予的重要使命。
化学是以实验为基础的科学,实验探究在课堂教学中起着举足轻重的作用,通过化学实验引导学生具有证据意识,基于证据加以分析推理,建立观点、结论和证据之间的逻辑关系,揭示现象的本质和规律。进而发展学生“发现和提出有探究价值的问题,能从问题和假设出发,确定探究目的,设计探究方案,进行实验探究,在探究中学会合作”,较为明确地表述所探究的问题,提升核心素养。下面以笔者实际教学“影响化学平衡移动的条件”一课为例作以下阐述。
一、教材分析
学生在人教版(2019)高中化学《必修第二册》的学习中已经知道外因的变化能使化学平衡状态发生改变,本节内容既是在必修课程基础上的延伸,又是选择性必修教材《化学反应原理》第二章承上启下的核心,系统性好,理论性强,有利于启发学生实验探究和推理思考。
影响化学反应速率的条件和化学平衡等知识刚刚学完,不仅在知识上为本节的教学奠定了基础,而且其探讨问题的思路和方法,也可以迁移至本节课来指导学生进行学习。当浓度、温度、压强等外界条件改变时,化学反应速率就会发生改变,相应的化学平衡就有可能发生移动,以此引导学生了解化学平衡的调控在生产、生活和科学研究领域中的重要作用。
教材由探究实验引入教学,通过对溶液颜色的变化分析,引导学生进行证据推理得出浓度变化对化学平衡移动影响的结论。在温度相关实验现象的分析中,归纳出改变温度时,对吸热反应方向的速率影响更为明显。压强对化学平衡的影响,教材中同样有相应的实验,但“由于手持技术实验能够实现实验数据可视化,具有帮助学生探析微观世界,促进学生对抽象概念的认知,提高学生学习兴趣和应用信息技术的能力等一系列教学功能”,所以可以在此补充一个手持技术数字实验,引导学生分析数字实验曲线,借助压强和浓度的关系,证据推理得出压强对化学平衡移动的影响规律。对探究实验的分析学习使得学生较好地进行了科学方法的训练和核心素养的提升,最终梳理出勒夏特列原理。
二、科学探究的步骤
提出问题——猜想与假设——设计实验方案——实验验证——证据推理——得出结论——反思评价。整个过程中突出体现了学生的主体地位,教师在教学中的主导作用同样也不容忽视。设计实验方案时,引导学生选择现象明显的反应,做好对照实验;指导学生在实验过程中控制单一变量,进行对比实验;疏导学生低落或亢奋的情绪,共同分析原因,保护好学生的求知欲。实验验证阶段,教师要及时提醒学生合作完成观察、测量、记录、查阅资料等内容,收集证据,进行归纳、比较、分类、概括、加工和整理,得出正确的结论,并督促学生对探究结果的可靠性进行评价,对探究活动进行反思,发现自己和他人的长处和不足,积极表达与交流,并提出改进措施。
三、教学过程
(一)提出问题,引导学生猜想与假设
利用学生的生活经验和已有知识为基础,提出符合学生认知水平的问题,组织学生进行猜想与假设,发展“能比较明确地表述所发现的问题” “敢于质疑并提出自己的见解”等能力。
【教学环节一】化学平衡移动含义
【教师】化学平衡状态的特征及实质是v(正)=v(逆),当外界条件发生改变,平衡状态是否发生改变?
【学生】改变反应条件(如浓度、温度、压强等),引起化学反应速率变化,如果v(正)≠v(逆),各组分质量或浓度就会不断改变,从而导致化学平衡被破坏,一段时间后,当正、逆反应速率重新相等时,则建立起新的化学平衡;如果v(正)=v(逆),则化学平衡没有被破坏。
【教师】展示如图1所示
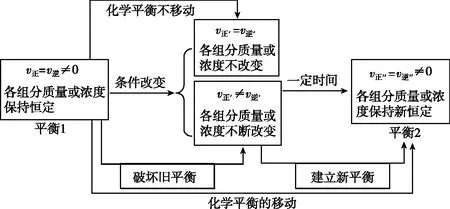
图1
【教师】当一个可逆反应达到平衡后,如果改变反应条件,导致旧的化学平衡被破坏、新的化学平衡建立,这种现象叫做化学平衡移动,平衡具体向哪个方向移动呢?
【学生】通过比较平衡破坏瞬间的正、逆反应速率的相对大小来判断平衡移动的方向。
①引起v(正)>v(逆),则化学平衡向正反应方向(或向右)移动;
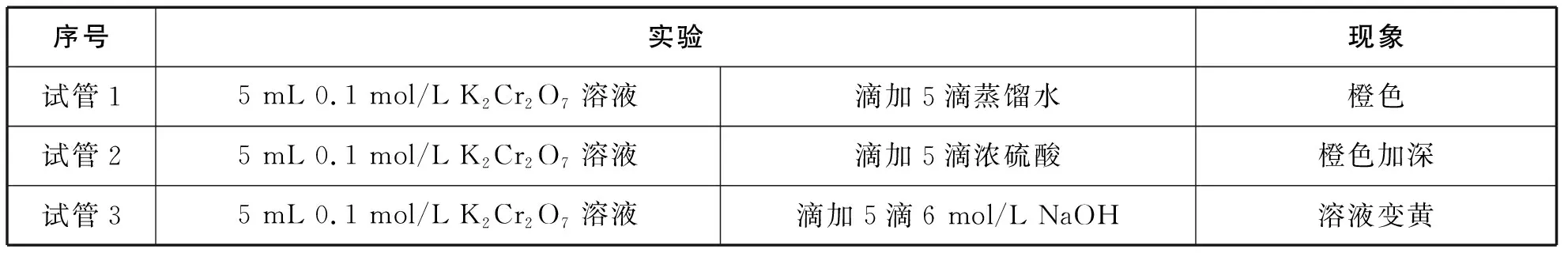
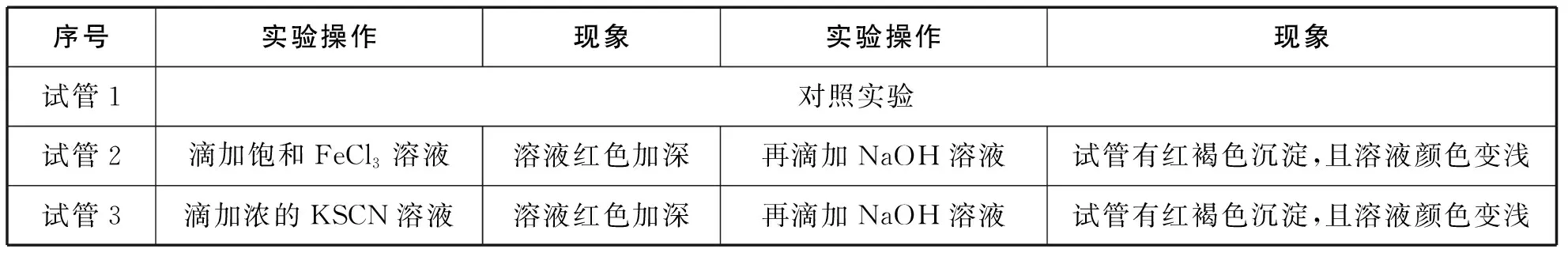
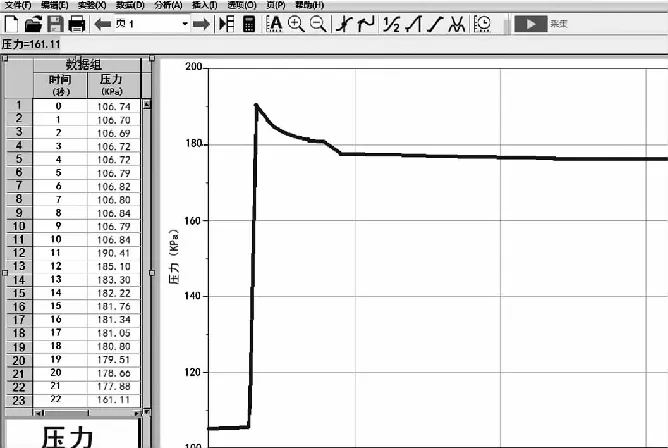
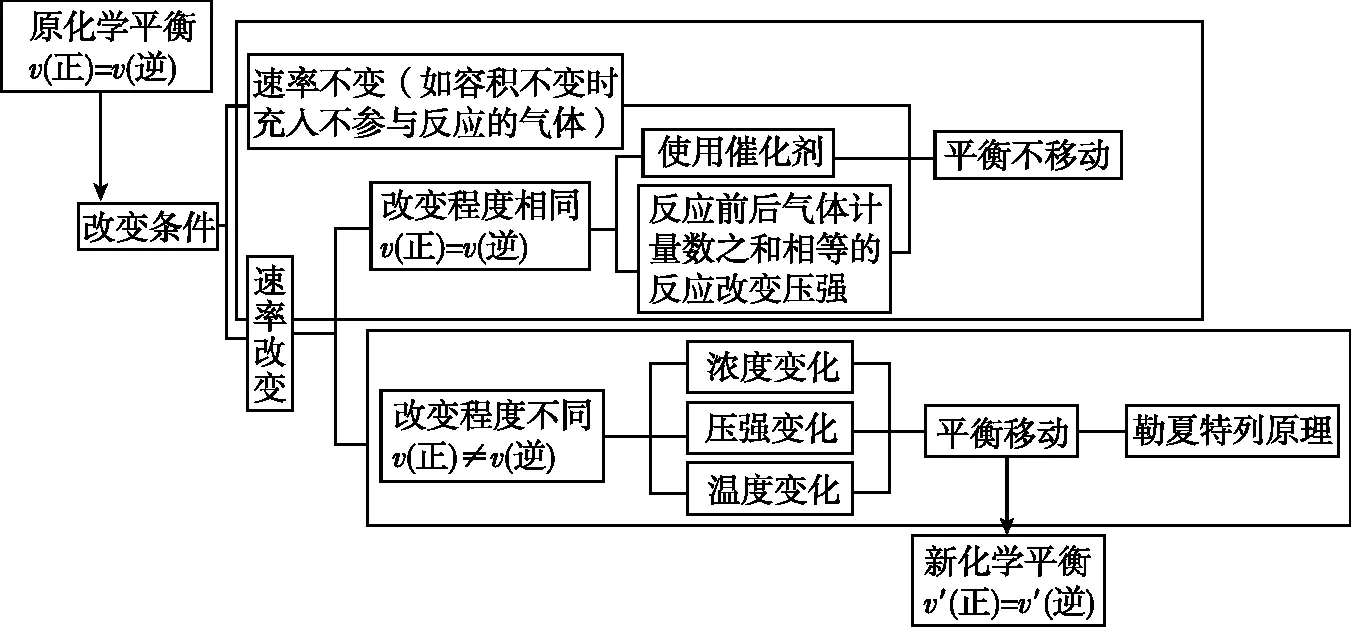
②引起v(正) ③虽能引起v(正)和v(逆)变化,但变化后新的速率仍保持相等,例如使用催化剂,则化学平衡不发生移动。 【教师】同学们的猜想与假设与化学反应速率的变化紧密相关,为了证明以上结论,可以从几个方面设计实验验证呢? 【学生】影响化学反应速率的外因有四个方面,其中温度、浓度易于设计实验验证。 【设计意图】根据化学平衡状态“逆、等、动、定、变”的特征,提出为什么会“变”,如何“变”,“变”的结果,组织学生对可能有的答案进行猜想与假设,为下一步设计实验方案和实验验证做好铺垫。 设计实验方案是培养学生创新思维和科学探究能力的关键环节,能够多方面地提升学生的核心素养,学生既要将已学知识综合运用,又要交流完善方案中存在的问题,还要考虑方案的安全性、简约性和科学性。 【教学环节二】浓度对化学平衡移动的影响 【教师】设计实验方案,探究浓度对化学平衡移动的影响。 实验药品:蒸馏水、浓硫酸、6 mol/L NaOH溶液、0.005 mol/L FeCl3溶液、0.01 mol/L KSCN溶液、饱和FeCl3溶液、1 mol/L KSCN溶液、0.01 mol/L NaOH溶液、固体KCl、0.1 mol/L K2Cr2O7溶液。 【学生】做好对照实验,确保现象清晰,易于准确描述。应该设计四组实验,分别从增大生成物浓度、减小生成物浓度、增大反应物浓度、减小反应物浓度四个角度逐一验证。 展示设计的实验报告 表1 增大或减小生成物浓度 先向试管中加入8 mL 0.005 mol/L FeCl3溶液和12 mL 0.01 mol/L KSCN溶液,试管中溶液呈红色,将溶液分成三等份再进行如下实验操作(实验操作及现象如表2)。 表2 增大或减小反应物浓度 【教师】在FeCl3与KSCN实验中,如果加入固体KCl,实验会有什么现象? 【设计意图】借助课本演示实验,引导学生发现缺少对照实验环节,难以准确观察和记录现象,培养学生“理性思维、批判质疑、勇于探究”的科学精神,重新设计实验记录单,将多而繁杂的信息进行梳理。通过FeCl3与KSCN实验中加入固体KCl,明确了改变与反应体系无关成分的浓度,对化学平衡无影响,加深对“浓度”内涵的理解。让学生“能依据探究目的设计并优化实验方案” “能和同学交流实验探究的成果,提出进一步探究或改进实验的设想”,提升核心素养。 【教学环节三】温度对化学平衡移动的影响 【学生】取两组平衡球,一组为对照实验,另一组分别将两端放入冷、热水中观察,发现升高温度,混合气体颜色加深,平衡逆向移动;降低温度,混合气体颜色变浅,平衡正向移动。 【教师】原平衡时v(正)=v(逆),升高温度,正、逆反应速率同时增大,然而混合气体颜色加深,说明平衡逆向移动程度更大,这说明了什么呢? 【学生】化学是以实验为基础的科学,改变温度时,对吸热反应方向速率影响更为明显。 在其他条件不变的情况下,升高温度,会使化学平衡向着吸热反应的方向移动;降低温度,会使化学平衡向着放热反应的方向移动。 【设计意图】升高温度,虽然正、逆反应速率同时增大,但不是等倍增大,混合气体颜色加深,说明NO2浓度增大更多,平衡向逆反应方向移动程度更大,本实验逆反应方向为吸热反应方向,由此得出升高温度吸热反应方向速率增长更多,v(放) “科学探究不等同于实验,也不只是实验;探究的关键在于好奇心、怀疑精神和求证精神”。取得实验探究证据后,学生要在教师的引导下对证据进行分析、推理,梳理出证据与猜想、假设的关系,运用证据对猜想和假设进行解释,最终得出证实或证伪的结论。 【教学环节四】压强对化学平衡移动的影响 【学生】借助手持技术数字化实验,将压强传感器直接伸入针筒内(图2),测得反应过程中气体压强(p)随时间(t)变化的曲线(图3)。 图2 压强对平衡的影响装置图 图3 加压时NO2和N2O4的混合气体压强变化图 【教师】请对曲线的三个阶段作出分析。第一阶段水平线说明什么?第二阶段压强线陡增,主要发生了什么变化?第三阶段压强线略有下降,最终持平的原因? 【学生】第一阶段是旧的化学平衡体系,装置内总压强恒定,为水平线。 第二阶段由于压缩针筒活塞,容器体积迅速减小,单位体积内气体物质的量迅速增多,压强瞬间增大,曲线陡增,该过程主要发生的是物理变化; 第三阶段加压后,曲线略有下降,压强有所减小,然而容器体积维持不变,说明发生了化学平衡移动,容器内混合气体物质的量有所减少,观察化学方程式得出平衡向右移动(即向着气体计量数之和减小的方向移动),主要发生的是化学变化。 【教师】纵观整条曲线,压强先增大后略有减小,减小的程度与之前压强增大的幅度相比弱很多,这说明什么呢? 【学生】可见化学平衡移动只能小幅度地减弱外因的影响,不可能完全抵消外因的改变量,新平衡时的压强仍比旧平衡大。 【学生】压缩针筒,容器体积减小,混合气体物质的量浓度增大,红棕色先加深。由于NO2浓度增加更多,所以v(正)>v(逆),平衡向右移动,气体颜色略有变浅。 【学生】各组分的浓度增大,颜色加深;本反应是反应前后气体计量数之和不变的反应,所以不会发生化学平衡移动。其他条件不变时,有气体参加且反应前后气体计量数之和发生改变的反应中,增大压强,平衡向气体计量数之和缩小的方向移动;减小压强,平衡向气体计量数之和增大的方向移动。反应前后气体计量数之和没有变化的反应,改变压强平衡不移动。 【设计思路】借助手持技术完成常规实验解决不了的探究问题,充分利用数据曲线引导学生比较、归纳、概括,运用证据,结合压强和浓度的关系对结论进行解释。培养学生“能解释证据与结论之间的关系,确定形成科学结论所需要的证据和寻找证据的途径”,进行科学方法的训练和核心素养的提升。 反思与评价是素养发展的核心部分,可以使学生“具有终身学习的意识和严谨求实的科学态度”。实验探究得出结论后,组织学生及时反思整个过程:提出的问题是否全面,猜想与假设全部还是部分得到证实或证伪,设计的实验方案是否科学合理,实验验证是否操作正确,收集的证据是否可靠,得出的结论是否准确。 【教学环节五】勒夏特列原理及其局限性 【教师】本节课我们从浓度、温度、压强的角度得出了很多结论,反思这些结论,我们总结出了一条共同的规律,你能发现吗?改变影响化学平衡的一个因素,平衡将向能够减弱这种改变的方向移动,这就是法国科学家勒夏特列在1888年通过大量实验后,反思总结出的重要原理。通过该原理我们得到了哪些启示? 【学生】科学家不是天生而成,只是他们更加善于总结与反思!勒夏特列原理中的“减弱”这种改变,不是“消除”改变。勒夏特列原理只考虑有单个条件改变。另外勒夏特列原理只能表示平衡移动的方向,不能预测达到新平衡所需要的时间和反应转化的具体程度。 【教师】同学们说得非常好!下面我们也来试着总结和反思,画出分析化学平衡移动一般思路的思维导图,找出勒夏特列原理使用时需要注意的问题。 【学生】思维建模,展示如图4所示。 图4 思维建模 【设计意图】基于科学史的探究教学有利于培养学生的科学思维方法、科学精神、科学态度,帮助学生了解在科学研究的漫漫长河中,我们今天所学的化学知识是科学家们通过不懈的科学探究,不断地反思总结,客观地论述评价所得出的。“思维建模的方法适用于自我建构知识,是教师创设建构主义课堂的一把钥匙”,借助思维建模分析勒夏特列原理的局限性,既可以梳理出分析化学平衡移动的一般思路,又可以有效规避使用误区,培养“尊重事实和证据,不迷信权威,具有独立思考、敢于质疑和批判”的创新精神。 本节课通过设计符合学生认知规律和思维发展的教学环节,利用科学探究的方式让学生寻找证据,推理建模,领悟科学精神。著名心理学家威廉·詹姆斯说过:“人性中最本质的愿望,就是希望得到赞赏”。在科学探究的过程中,对学生的积极表现,教师要及时给予评价和肯定,对错误的回答,也要给予鼓励和正确的引导,让学生在轻松、活跃的气氛下碰撞出知识的火花,有利于知识的构建,有利于化学核心素养的落实。(二)优化实验设计方案,指导学生实验验证



(三)证据推理,引导学生得出结论




(四)及时反思评价,督导学生素养提升
四、教学反思
