短花针茅StbCRY1 和StbCRY2 基因克隆与表达差异分析
2023-08-10赵鸿彬白雪范宇凤张晓馥张涛李淑芬
赵鸿彬,白雪,范宇凤,张晓馥,张涛,李淑芬,3
1.内蒙古农业大学生命科学学院,内蒙古 呼和浩特 010018;2.内蒙古自治区生物制造重点实验室,内蒙古 呼和浩特 010018;3.内蒙古高校麦类作物种质创新与利用重点实验室,内蒙古 呼和浩特 010018
光是生物钟基本架构中的第一环,光受体作为生物钟分子基础中的输入途径和核心振荡器,通过转录以及翻译,调节植物体内的输出信号,从而在时间维度上调节植物生长发育和代谢,并且在外界胁迫时起到应答的作用(Johansson et al.,2015)。植物光受体通过感知光的种类、强弱、照射时间调控相关基因的表达和光形态建成。通过对不同植物光受体的研究,发现三类光受体分别通过感知红光、蓝光和紫外光进行信号转导,其中包括5 个红光受体光敏色素(PHYA、PHYB、PHYC、PHYD、PHYE)(Cashmore et al.,1999)、7 个蓝光受体(CRY1、CRY2、PHOT1、PHOT2、FKF1、LKP2、ZTL)和1 个UV-B(UVR-8)受体(Smith,2000;马朝峰等,2019)。
目前的研究认为在植物花期、光周期等的调控过程中,发挥最大作用的蓝光受体为隐花色素。最早发现的隐花色素Cry1(cryptochromes1)于1990年在拟南芥中发现(Lin et al.,1995),其突变体在蓝光生长时表现为下胚轴伸长,随后,Cry1 同源蛋白Cry2 也相继被发现(Lin et al.,1996),隐花色素CRY1、CRY2 由辅酶基团和脱辅酶基团两大功能基团构成。辅酶基团感受外部环境中的光信号;脱辅酶基团传递由辅酶基团感受的光信号给下游信号通路蛋白,从而引发植物相应生理反应(Yang et al.,2000;Wang et al.,2001)。脱辅酶基团包含N 端PHR 和C 端CCE 两个重要结构域,因其在不同生物中都存在保守性较高的DAS 基序,因此在不同植物中都具有相同或相似的功能(王红霞等,2017)。
隐花色素在光形态建成具有重要作用,主要参与下胚轴伸长(Yu et al.,2010)、植物开花(王红霞等,2017)、气孔开放(张丽等,2021)等生理过程。在蓝光条件下,植物COP1 是光形态建成的中心抑制因子,SPA1 与COP1 结合增强COP1 活性,抑制光形态建成(Liu et al.,2011)。CRY1 可以通过与SPA1 作用,使SPA1 与COP1 相互作用被打断,失去活性的COP1 不能降解HY5/HYH 等转录因子,下胚轴伸长受到抑制(Liu et al.,2016)。CRY2 与调节下胚轴伸长基因PIF4/PIF5 处于同一位点,二者结合可调控低光照度蓝光下拟南芥下胚轴伸长生长(Zuo et al.,2011)。
拟南芥的隐花色素通过参与开花途径调控开花,隐花色素CRYs 与光敏色素PHYs 共同调控CO的转录和表达,从而影响开花关键基因FT的表达(Zuo et al.,2011)。通过对CRY 突变体的研究,发现cry1cry2 双突变体在蓝光下使叶片气孔开度增加,过表达CRY1 的植株在蓝光下则使叶片气孔开度减小(Liu et al.,2011)。除去上述CRY1 参与SPA1-COP1 调控途径,隐花色素还作为光与光依赖蛋白间的调控因子参与信号转导,如CRY2 与CIB1直接结合激活FT转录(Liu et al.,2013)、CRY1通过对 H2A.Z 促进作用抑制下胚轴的伸长等(Zlatanova et al.,2008)。
此外,植物还通过CRY1、CRY2基因表达调控生物钟,以适应周围环境的改变,使植物自身生长繁殖不受影响,并且在极端环境下的植物的适应中,这两个基因更是起到关键作用(Yan et al.,2022)。在拟南芥中发现介导CRY 蛋白降解的E3泛素连接酶LRB,揭示了环境温度与光照变化下CRY 蛋白稳定性的分子机制,二者互作调节CRY蛋白稳定性进而响应环境温度变化,促进下胚轴伸长等表型改变(Ma et al.,2021)。
对于大多数植物而言,全球变暖会导致其春季早花、秋季晚花,延长生殖生长期(Sherry et al.,2007)等物候上的改变,同样,由此导致的氮沉降对也会对不同植物物候产生不同影响(Galloway et al.,2003;李元恒等,2014)。短花针茅为多年生丛生型旱生草本植物,是亚洲中部暖温带荒漠草原的代表植株,因荒漠草原生态环境脆弱,易受温度、水分等环境因子的影响,生态稳定性较差,作为内蒙古荒漠草原的主要优势物种对荒漠草原生态稳定性有着重要的作用,它返青早,是早春促进家畜恢复体况的优等牧草,具有十分重要的生态和饲用价值。因其生长环境较为苛刻,对环境温度、土壤可利用养分(氮素)等的变化敏感。在放牧等人为因素影响下,荒漠草原部分优势种如短花针茅(Stipabreviflora)、克氏针茅(Stipakrylovii)等优势度下降(黄琛,2015)。因此探究短花针茅生长和发育过程对气候变化及人为扰动等因素响应的分子机制尤为重要。通过前期对短花针茅响应逆境胁迫的转录组数据的分析发现,CRY基因家族在短花针茅生殖生长过程中可能参与了对逆境的响应,但仍缺乏有力的证据。本文通过对CRY基因克隆和表达规律的分析,来探究不同生态环境因子影响下隐花色素CRY1、CRY2 在短花针茅生长发育中的响应规律,以期为短花针茅生殖生长对逆境响应的分子机制研究提供有用的信息。
1 材料与方法
1.1 试验材料
本实验所需实验材料短花针茅取自内蒙古四子王旗荒漠草原农牧科学院实验基地(41°46′44″N,111°53′42″E),基地试验区土壤贫瘠,降雨少,昼夜温差大,为典型的中温带大陆季风气候。本实验对野外长期放牧处理下及增温与施氮交互处理下的短花针茅进行了取样。增温施氮样地设置24 个小区,分对照(Ck)、施氮(N)、增温(W)、增温×施氮(WN)4 组。施氮组为每年降雨时期内人工施加10 g·m−2·a−1NH4NO3,增温处理通过在样地上空2.25 m 处悬挂2 kW 红外线辐射器实现,增温施氮处理是在增温小区内同时进行施氮处理。根据对短花针茅花发育各时期的观察,于2022年4 月下旬至2022 年5 月下旬采集放牧处理和增温施氮处理下短花针茅颖片突起期(YPQ)、小花突起期(XHQ)、授粉期(SFQ)生殖枝及叶片。剪取不同处理组中生长良好的短花针茅生殖枝10支和10 丛短花针茅地上部分全部叶片,每种处理下3 次重复,分别用无菌水冲洗,锡箔纸包裹,液氮中速冻后保存于−80 ℃冰箱中。野生烟草种子由实验室保存。
1.2 方法
1.2.1 短花针茅总RNA 提取及StbCRY1和StbCRY2基因克隆
根据本实验室已有增温施氮处理下短花针茅花期差异基因转录组数据库信息,筛选到StbCRY1和StbCRY2基因的cDNA 序列片段设计引物,采用北京全式金植物总RNA 提取试剂盒提取短花针茅生殖枝总RNA,利用其反转录试剂盒进行cDNA 第一链合成,以短花针茅生殖枝的cDNA 为模板,用基因开放阅读框特异性引物StbCRY1-F1/StbCRY1-R1和StbCRY2-F1/StbCRY2-R1(表1)进行PCR 扩增。利用RACE 试剂盒的反应体系进行第一链的合成。取2 μL RNA 样品、5′CDS Primer A/3′CDS Primer A 1.5 μL、SMART II.A oligo 1.5 μL 置于掌上离心机的离心管中,混合均匀;70 ℃水浴2 min;在冰上冷却2 min;加入10×Buffer 1 μL、DTT(10 mmol·L−1)2.5 μL、dNTPMix(2.5 mmol·L−1)3.5 μL、逆转录酶0.6 μL 混合均匀,在42 ℃ PCR 仪中放置1.5 h后取出,再加入EDTA Buffer 20 μL,在72 ℃ PCR仪中放置7 min,−20 ℃保存,用于后续试验。以合成的5′RACE 第一链cDNA 为模板,利用StbCRY1和StbCRY2的5′-GSP1(表1)和试剂盒自带的UPM引物进行PCR 扩增,然后将其扩增的PCR 产物稀释50 倍,以稀释后的PCR 产物为模版,以试剂盒自带引物UPM 以及StbCRY1和StbCRY2的5′-GSP2为引物(表1)进行第2 次PCR 扩增,以RACE 试剂盒的反应条件进行扩增。目的片段和Blunt Simple克隆载体进行连接,测序后,通过DNAMAN 软件分析将5′和3′端的测序结果拼接在一起,并去除重叠的核苷酸碱基,获得完整的短花针茅基因全长序列。以反转的5′RACE cDNA 为模板,用ORF 特异性 引 物StbCRY1-F/StbCRY1-R和StbCRY2-F/StbCRY2-R(表1)进行PCR 扩增,接着切胶回收纯化,连接克隆载体并转化大肠杆菌感受态细胞,最后经菌液PCR 检测后将阳性克隆送测序。

表1 扩增引物序列及用途Table 1 The sequence and usages of the primers
1.2.2 StbCRY1、StbCRY2 序列分析
使用NCBI 在线ORF finder(https://www.ncbi.Nlm.nih.gov/orffinder/)工具将StbCRY1、StbCRY2核苷酸序列翻译成氨基酸序列、用 Protparam(https://web.expasy.org/protparam/)进行蛋白基本性质分析、利用Sopma(http://npsa-pbil.ibcp.fr/cgibin/npsa_automat.pl?page=npsa_sopma.html ) 和Swiss-Mode(swissmodel.expasy.org/)在线工具进行蛋白质二级、三级结构分析、利用MAGA6 构建NJ分子系统进化树。
1.2.3 融合表达载体构建及转化
设计StbCRY1和StbCRY2ORF 引物,引物序列StbCRY1-GFP-F/StbCRY1-GFP-R和StbCRY2-GFPF/StbCRY2-GFP-R见表1。根据试剂盒说明书步骤进行操作,反应体系:Biorun Pfu PCR Mix 25 μL,模板1 μL,Nuclease-free Water 20 μL;PCR 反应程序:94 ℃ 5 min;94 ℃ 30 s,50 ℃ 45 s,72 ℃32 s,循环数30;延伸:72 ℃ 10 min,16 ℃ 30 min。测序无误后用BsaI/Eco31I 内切酶分别酶切目的序列和pBWA(V)HS 载体,之后将载体酶切物和目的序列酶切产物合并,一起用PCR 纯化试剂盒纯化,最后用T4 DNA 连接酶连接,获得pBWA(V)HSStbCRY1-GFP 和pBWA(V)HS-StbCRY2-GFP 融合表达载体。将表达载体电转化法转入农杆菌GV3101,于28 ℃培养2 d,将农杆菌接于10mL YEB 液体培养基中,180 r·min−1培养1 h。后用4 000 r·min−1,离心4 min,将农杆菌聚集在离心管底部,去上清,后用10 mmol·L−1MgCl2悬重悬菌体,调OD600 至0.6 左右。挑选生长状况良好的烟草植株,用1 mL 注射器从烟草叶片下表皮注射,培养2 d 后在激光共聚焦显微镜于488 nm 激发光下观察。
1.2.4 荧光定量PCR
以克隆获得的短花针茅StbCRY1和StbCRY2基因 cDNA 序列为模板设计引物StbCRY1-F2/StbCRY1-R2和StbCRY1-F2/StbCRY2-R2,利用短花针茅TLF基因为内参基因TLF-F/TLF-R(赵鸿彬等,2022)(表1)。
参照试剂盒说明书对不同处理的StbCRY1和StbCRY2基因进行实时荧光定量PCR 表达分析。具体步骤为:模板是稀释20 倍后的cDNA 第一链,PCR 体系10 μL,包括模板1 μL、Tip Green qPCR SuperMix 5 μL、Rnase-free Water 3.4 μL,冰上配制成混合液后混匀,于实时荧光定量PCR 仪(TaKaRa PCR Thermal Cycler Dice Real Time System)中反应。反应程序为:95 ℃ 30 s;95 ℃ 15 s,60 ℃ 30 s,40 个循环。根据表达量计算方法(Livak et al.,2001)计算结果,每个样品做3 个生物学重复。
2 结果与分析
2.1 StbCRY1 和StbCRY2 基因序列分析
StbCRY1和StbCRY2基因编码蛋白ORF 框长分别为2 695 bp 和2 176 bp(图1、2),一级结构特征见表2,二者编码酸性蛋白质,皆是亲水蛋白质。StbCRY1和StbCRY2蛋白保守结构域,StbCRY1蛋白具有PhrB 结构域和Cry-C 结构域。StbCRY2蛋白具有PhrB 结构域。

图1 StbCRY1 基因ORF 及推导的氨基酸序列Figure 1 The ORF and deduced protein sequence of StbCRY1

图2 StbCRY2 基因ORF 及推导的氨基酸序列Figure 2 The ORF and deduced protein sequence of StbCRY2

表2 StbCRY1 和StbCRY2 基因编码蛋白的结构特征Table 2 Structural characteristics of proteins encoded by StbCRY1 and StbCRY2 genes
利用Sopma 在线预测工具预测StbCRY1和StbCRY2编码蛋白质的二级结构,可知StbCRY1 出现α 螺旋结构占比为40.49%、出现β 转角为4.58%、出现无规线团的占比为45.64%、出现伸展链的占比为9.30%。可知StbCRY2 出现α 螺旋结构可占比为36.45%、出现β 转角占比为4.44%、出现无规线团的占比为47.93%、出现伸展链的占比为11.18%。StbCRY1 和StbCRY2 编码蛋白的空间构象预测见图3。

图3 StbCRY1 和StbCRY2 蛋白的空间构象预测Figure 3 Prediction of the soatial conformation of StbCRY1 and StbCRY2 proteins
2.2 StbCRY1 和StbCRY2 基因编码蛋白进化分析
为了解CRY1、CRY2 蛋白的进化关系,将StbCRY1、StbCRY2 蛋白的氨基酸序列与大麦(Hordeuminnermongolicum)、小麦(Triticum aestivum)、二穗短柄草(Brachypodiumdistachyon)等植物蛋白序列构建进化树,结果表明短花针茅CRY1 蛋白与野生二粒小麦(Triticumdicoccoides)和普通小麦(Triticumaestivum)处于同一分支,即三者CRY1 进化关系较为相近,短花针茅CRY2 蛋白与大麦CRY2 蛋白亲缘关系相近(图4)。
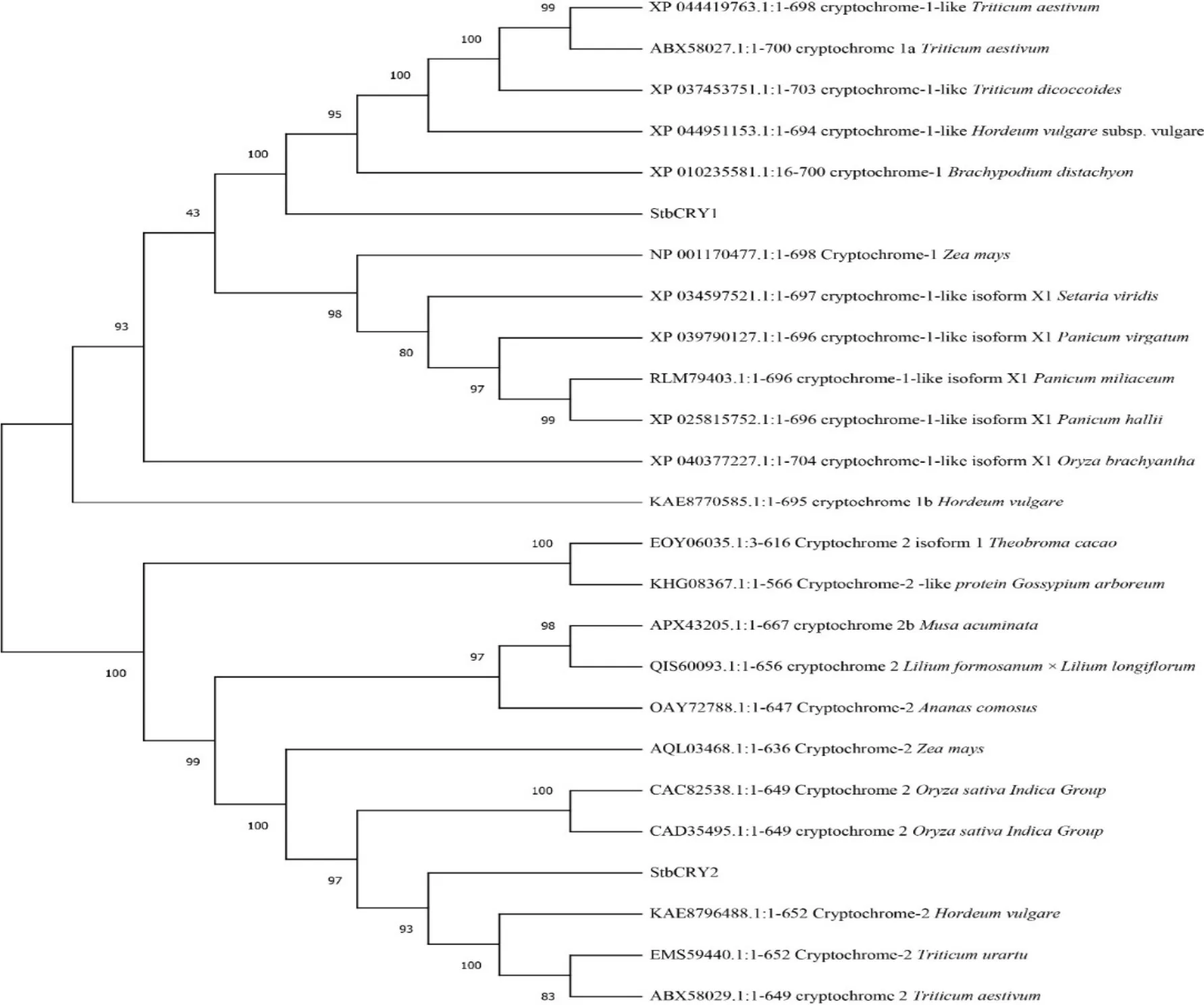
图4 StbCRY1、StbCRY2 与其他物种CRY 蛋白进化树Figure 4 Phylogenetic tree of StbCRY with CRY1, StbCRY2 proteins from other plants species
2.3 StbCRY1 和StbCRY2 基因亚细胞定位分析
利用SoftBerry 在线预测StbCRY1、StbCRY2蛋白,结果表明StbCRY1 蛋白定位于细胞核和细胞质中;StbCRY2 蛋白同样定位于细胞质与细胞核中。为了验证结果的真实性,进行蛋白质亚细胞定位实验。利用转入pBWA(V)HS-CRY1-Glosgfp 和pBWA(V)HS-CRY2-Glosgfp 的农杆菌将StbCRY1、StbCRY2基因导入到烟草叶片中进行翻译表达,后置于激光共聚焦显微镜下观察。观察结果如图5、6所示,短花针茅StbCRY1 和StbCRY2 蛋白均定位于细胞核,少量定位于细胞质。

图5 488 nm 激发光下StbCRY1 蛋白在烟草叶片中的表达情况Figure 5 Expression of StbCRY1 protein in tobacco leaves under 488 nm excitation light

图6 488 nm 激发光下StbCRY2 蛋白在烟草叶片中的表达情况Figure 6 Expression of StbCRY2 protein in tobacco leaves under 488 nm excitation light
2.4 增温施氮处理条件下StbCRY1 和StbCRY2 花期时空表达差异
2.4.1 同一花发育时期不同增温施氮条件下StbCRY1和StbCRY2时空表达差异
在长期增温施氮处理环境下,短花针茅生殖枝中StbCRY1和StbCRY2在不同处理下变化差异较大(图7)。YPQ 期StbCRY1仅在N 处理下显著上调,StbCRY2在N 处理下显著上调,而在W 处理下显著下调;在XHQ,StbCRY1和StbCRY2表达总体上均显著下调,变化趋势一致,在WN 交互作用下表达量下降之最低;SFQ 期中,StbCRY1和StbCRY2表达趋势也较为一致,与Ck 相比,二者在N 和W处理下表达量均显著提高,WN 处理表达量均下调但差异不显著。同时,在处理间,StbCRY1、StbCRY2在不同处理间存在相同表达趋势,在N 处理下表达量最高,W 条件下次之,在WN 条件下降至最低(图7)。

图7 不同增温施氮条件下生殖枝StbCRY1 和StbCRY2 同一花期表达差异Figure 7 Expression differences of StbCRY1 and StbCRY2 in reproductive branches at the same flower development stage under different temperature and nitrogen application conditions
增温施氮处理下短花针茅营养枝叶片中的StbCRY1与StbCRY2的表达模式与生殖枝中完全不同(图8)。在YPQ 期中,与Ck 相比StbCRY1仅在W 处理下表达量显著上调,在处理间WN 处理下StbCRY1表达与W 处理下相反,StbCRY2同样在W 处理表达量显著上调,但在WN 处理下表达量极显著下调,表达量在处理间呈现先显著上调后极显著下调的趋势;在XHQ,StbCRY1、StbCRY2表达量整体呈现下调趋势,StbCRY1在几个处理下均显著下调,其中N 处理下下调最显著,其次是WN 处理,最后为W 处理,StbCRY2在W、WN 条件下表达水平一致,表达量显著低于N 处理和Ck;在SFQ,StbCRY1仅在W 处理下表达量极显著下调,在Ck、N 处理、WN 处理下表达差异不显著;StbCRY2表达量在W、WN 处理下显著上调,在N 处理下差异不显著(图8)。

图8 不同增温施氮条件下营养枝叶片StbCRY1 和StbCRY2 同一花期表达差异Figure 8 Expression differences of StbCRY1 and StbCRY2 in vegetative branch leaves leaves at the same flower development stage under different temperature and nitrogen application conditions
2.4.2 同一增温施氮条件下不同花发育时期StbCRY1和StbCRY2时空表达差异
在长期增温施氮处理环境下,短花针茅生殖枝中StbCRY1和StbCRY2在花期的3 个发育阶段下变化差异较大(图9)。Ck 中与YPQ 相比,短花针茅生殖枝StbCRY1表达量先显著上调后显著下调;StbCRY2表达量整体呈下调趋势,在SFQ 下调显著。W 处理下,StbCRY1仅在SFQ 显著上调,XHQ 表达量变化不显著;StbCRY2表达量虽然都显著低于YPQ,但随花发育的推进,表达呈现极显著下调(XHQ)再上调(SFQ)的趋势。

图9 同一增温施氮条件下不同花发育时期生殖枝StbCRY1 和StbCRY2 表达差异Figure 9 Expression differences of StbCRY1 and StbCRY2 in reproductive branches at different flower development stages under the same temperature and nitrogen application conditions
N 处理下,StbCRY1表达量整体呈现显著上调趋势,并随着花发育时间的推移持续上调,在SFQ表达量最高;StbCRY2在XHQ 期极显著下调,而在SFQ 表达量与XHQ 相比显著上调,但与YPQ 相比不显著。此外,WN 处理下,StbCRY1表达量在3 个花发育的时期呈显著的先下调再上调趋势;StbCRY2整体表达量显著下调,随时期变化呈现先下调后上调的变化(图9)。
短花针茅营养枝叶片中StbCRY1和StbCRY2在不同花发育阶段表达模式明显区别于生殖枝(图10)。Ck 中,StbCRY1表达量在XHQ、SFQ 期显著上调,与YPQ 比较而言,表达趋势呈上调-下调趋势;StbCRY2仅在XHQ 表达显著上调,其余时期没有显著差异。W 处理下,StbCRY1在SFQ 期表达量显著低于其余两个时期;StbCRY2表达水平在XHQ 和SFQ 均显著下调,在XHQ 表达量最低。N处理下,StbCRY1表达量随短花针茅花发育的持续呈现下调趋势,在花发育后期表达量最低;StbCRY2与之相反,在XHQ、SFQ 期表达量皆高于YPQ 期。WN 条件下,两个基因在XHQ 期和SFQ 期表达水平皆显著上调,StbCRY2在SFQ 表达量最高。

图10 同一增温施氮条件下不同花发育时期营养枝叶片StbCRY1 和StbCRY2 表达差异Figure 10 Expression differences of StbCRY1 and StbCRY2 in vegetative branch leaves leaves at different flower development stages under the same temperature and nitrogen application conditions
3 讨论
3.1 StbCRY1 和StbCRY2 序列特征
隐花色素CRY1、CRY2 通过对不同种类光照的感知来感受外界环境状况,并通过调控下游基因的表达来调节荒漠草原植物光形态的建成(李仕铭等,2018)。CRY1、CRY2 调控引起植物在合适时间生长繁殖,是植物应对环境变化的方式之一(王红霞等,2017)。本研究中利用5′RACE 与PCR 技术克隆了短花针茅StbCRY1和StbCRY2基因,通过对其氨基酸序列分析发现,二者皆为酸性蛋白质,StbCRY1与StbCRY2基因编码蛋白都含有PhrB 结构域。表明短花针茅StbCRY1 和StbCRY2 与禾本科小麦或玉米亲缘关系最近,存在共同的起源。有研究显示小麦TaCRY1 在洋葱表皮细胞中出现类似的核积累(徐沛,2008),由此可见StbCRY1 蛋白与小麦TaCRY1 一样,为蓝光依赖的核浆穿梭蛋白。此外,本文发现StbCRY1 定位于细胞核与细胞质中,其定位与大豆CRY1 蛋白一致(熊璐,2008)。
3.2 禁放牧处理对StbCRY1 和StbCRY2 表达的影响
3.3 StbCRY1 和StbCRY2 表达对增温和施氮处理的响应
对于绝大部分生长在荒漠草原的植被,增温会导致春季早花、秋季晚花,延长生殖生长期;同时草原上大部分物种物候期会对土壤中氮素含量增加产生积极响应,适宜的氮素含量和温度是短花针茅在合适的时间生长繁殖的关键(白春利等,2013)。本研究结果表明,在人工模拟不同增温施氮条件下,开花前期处理组营养枝叶片与生殖枝StbCRY1和StbCRY2表达量高于Ck 组,这是因为其与短花针茅营养生长向生殖生长的转变及下胚轴的伸长过程有关(Lin et al.,1996;蒋玮琳等,2014)。在拟南芥研究发现中CRY2 在低温环境下表现出高泛素化修饰,通过26S 蛋白酶体途径被降解(Ma et al.,2021),但CRY 本身是否受到温度调节尚不清楚。本文在对短花针茅的开花基因研究中发现,开花时StbCRY1、StbCRY2在3 种处理下表达量均下调,这表明其在光周期调控开花的过程中与开花相关基因产生拮抗作用,受到开花下游基因的抑制。之后在雌雄蕊形成期抑制作用消失,体现为表达量上升。在生殖枝中,N、W 分别处理与WN 共同施加处理相比,前者StbCRY1和StbCRY2表达量较高,表明N 和W 条件下StbCRY1和StbCRY2的响应模式的变化是通过昼夜节律钟的改变来适应和调节逆境对短花针茅生长发育的影响,而WN 交互处理中这种影响的效应减弱,N 减弱了W 处理对植物生殖枝StbCRY1、StbCRY2表达的影响,反之亦然。
4 结论
本实验通过对短花针茅中的两个基因StbCRY1和StbCRY2的克隆和表达分析,获得各包含2 695 bp 和2 176 bp 的开放阅读框。StbCRY1、StbCRY2蛋白主要分布于细胞核和细胞质。StbCRY1和StbCRY2基因对花期和增温施氮处理环境的响应因处理和开花时期的不同而存在显著的差异,短花针茅生殖枝StbCRY1和StbCRY2的表达水平受W 和WN 处理的影响较大,并且在WN 处理下二者表达水平受开花时期的影响较强;营养枝叶片中StbCRY1和StbCRY2主要对W 处理有较强明显的响应,在W处理下开花的不同时期表达都与Ck 表现出显著的不同。本研究通过隐花色素StbCRY1、StbCRY2基因在放牧、气候等环境变化下的响应机制,为进一步探究荒漠草原短花针茅的生长发育响应气候变化及人为干扰的分子机制提供了基础数据。
