安罗替尼联合PD-1抑制剂治疗晚期非小细胞肺癌患者的近期临床疗效及对血清VEGF、MMP-2水平的影响分析
2023-08-10李燕舞
高 航, 殷 俊, 李燕舞
肺癌是全球癌症相关死亡的最常见原因,其中非小细胞肺癌约占肺癌总病例数的80%~85%,且出现早期转移和复发的概率较高,大部分患者在治疗后仍出现疾病进展,二线及以上化疗方案有效率低,患者预后相对较差[1]。大量临床研究证实,腺癌等非小细胞肺癌对化疗敏感性较高,在过去的几十年中,出现了许多针对非小细胞肺癌治疗的新策略,主要包括靶向治疗和抗血管生成治疗[2]。靶向抑制程序性死亡受体1(programmed death-1,PD-1)/程序性死亡配体1(programmed death ligand-1,PD-L1)通路的免疫检查点在早期临床研究中显现出积极的效果,但其目前在临床上应用还存在较大的局限[3]。安罗替尼是我国自主研发的一种新型单克隆抗体,可靶向抑制血管内皮生长因子(vascular endothelial growth factor,VEGF)相关信号通路,从而达到抗肿瘤血管新生的目的[4]。鉴此,本研究采用安罗替尼联合PD-1抑制剂治疗晚期非小细胞肺癌患者,分析其临床疗效以及对患者血清VEGF、基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)表达水平的影响,现报道如下。
1 资料与方法
1.1一般资料 选择2018年2月至2022年2月我院收治的110例Ⅲb~Ⅳ期非小细胞肺癌患者的临床资料,根据治疗方法不同将其分为联合治疗组(接受安罗替尼联合PD-1抑制剂治疗)和抗PD-1治疗组(接受PD-1抑制剂治疗),每组55例,两组基线资料比较差异无统计学意义(P>0.05),具有可比性。见表1。研究获医院医学伦理委员会批准。
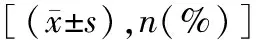
表1 两组基线资料比较
1.2纳入与排除标准 纳入标准:(1)符合《中国晚期原发性肺癌诊治专家共识(2016年版)》[5]中关于晚期非小细胞肺癌的诊断标准,经病理学、免疫组织化学、影像学检查确诊为不可切除的肺腺癌、肺鳞癌,TNM分期为Ⅲb~Ⅳ期。(2)表皮生长因子受体、间变性淋巴瘤激酶基因检测均为阴性;或检测结果阳性,已经接受过相关靶向药物治疗后发生耐药,且至少接受过2种系统化疗后出现进展或无法耐受治疗。(3)预计生存时间>6个月。(4)至少包含1个可测量的病灶。(5)患者及家属知情且同意。排除标准:(1)合并其他类型恶性肿瘤;(2)合并自身免疫性疾病;(3)合并严重肝肾功能不全;(4)对本研究所使用药物不耐受,或同时联用其他抗肿瘤药物。
1.3治疗方法
1.3.1 抗PD-1治疗组 根据《中国晚期原发性肺癌诊治专家共识(2016年版)》[5]和临床实践要求选择免疫治疗药物。其中22例患者采用帕博利珠单抗(MSD Ireland,国药准字JS20180031)治疗,15例患者采用卡瑞利珠单抗(苏州盛迪亚生物医药有限公司,国药准字S20190027)治疗,18例患者采用信迪利单抗(苏州信达生物制药有限公司,国药准字S20180016)治疗。每个治疗周期第1天静脉滴注溶解于200 ml 0.9%氯化钠注射液中的上述药物200 mg。
1.3.2 联合治疗组 采用安罗替尼联合PD-1抑制剂治疗,其中24例患者采用帕博利珠单抗,16例患者采用卡瑞利珠单抗,15例患者采用信迪利单抗治疗。在抗PD-1治疗的基础上口服盐酸安罗替尼胶囊(正大天晴药业集团,国药准字H20180004),初始剂量12 mg/d,1次/d,若患者不耐受可调整为8~10 mg/d。两组均以21 d为一个治疗周期,每个治疗周期后停药7 d,共治疗3个周期。
1.4观察指标 (1)血清VEGF、MMP-2水平:于治疗前、治疗后1周、治疗后1个月、治疗后3个月采集患者空腹静脉血,采用酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法检测血清VEGF、MMP-2水平,试剂盒购自武汉赛培生物科技有限公司。(2)临床疗效:在完成3个治疗周期后参照《实体瘤疗效评价标准》进行临床疗效评估[6]。完全缓解(complete remission,CR):病灶完全消失且4周内无新病灶出现。部分缓解(partial remission,PR):病灶缩小≥30%,且维持4周。病情进展(progression of disease,PD):病灶增大≥20%或出现新病灶。病情稳定(stable condition,SD):肿瘤病灶最大径有一定减少或增加,处于PR与PD的标准之间,未达到CR或PR标准。客观缓解率(objective response rate,ORR)=(CR+PR)/总例数×100%,疾病控制率(disease control rate,DCR)=(CR+PR+SD)/总例数×100%。(3)不良反应发生情况:记录患者治疗期间不良反应发生情况,包括胃肠道反应、肝毒性、肾功能不全、脱发、甲状腺功能亢进/减退、肺炎等。
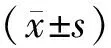
2 结果
2.1两组不同时间点血清VEGF水平比较 两组治疗前血清VEGF水平差异无统计学意义(P>0.05)。在接受治疗后,两组血清VEGF水平均呈下降趋势(P<0.05),且在治疗后1周、1个月、3个月,联合治疗组水平均较抗PD-1治疗组更低,差异有统计学意义(P<0.05)。见表2。
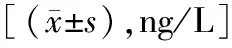
表2 两组不同时间点血清VEGF水平比较
2.2两组不同时间点血清MMP-2水平比较 两组治疗前血清MMP-2水平差异无统计学意义(P>0.05)。在接受治疗后,两组血清MMP-2水平均呈下降趋势(P<0.05),且在治疗后1周、1个月、3个月,联合治疗组水平均较抗PD-1治疗组更低,差异有统计学意义(P<0.05)。见表3。
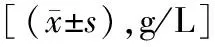
表3 两组不同时间点血清MMP-2水平比较
2.3两组临床疗效比较 联合治疗组CR 0例,PR 25例,SD 25例,PD 5例;抗PD-1治疗组CR 0例,PR 13例,SD 29例,PD 13例。联合治疗组的ORR、DCR均显著高于抗PD-1治疗组,差异有统计学意义(45.45% vs 23.64%,χ2=5.789,P=0.016;90.91% vs 76.36%,χ2=4.251,P=0.039)。
2.4两组不良反应发生情况比较 两组不良反应发生率比较差异均无统计学意义(P>0.05)。见表4。上述不良反应经对症处理后明显减轻或消失,未影响联合治疗方案正常实施。
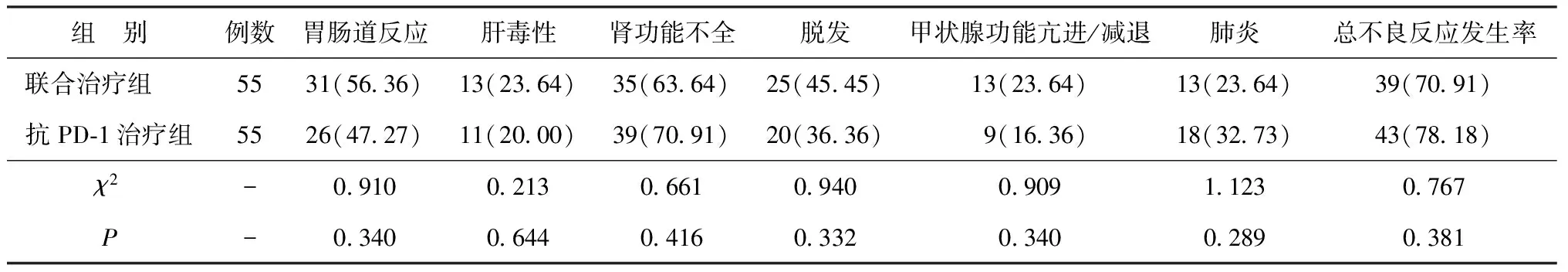
表4 两组不良反应发生情况比较[n(%)]
3 讨论
3.1癌症的发生、发展涉及机体多种病理、生理机制,其中关键在于特异性和非特异性的免疫逃避[7]。越来越多的研究证据表明,针对非小细胞肺癌患者的抗肿瘤方案不仅可以通过细胞毒性作用介导,而且免疫介导已经成为更安全、有效且耐受的一线治疗选择[8],针对PD-1通路的免疫疗法是目前晚期非小细胞肺癌最有效的治疗策略之一[9]。柯章敏等[10]的研究探讨了PD-1抑制剂一线治疗晚期非鳞非小细胞肺癌的疗效及安全性,采用PD-1抑制剂艾瑞卡联合培美曲塞、卡铂化疗的方案,治疗总有效率达95.24%,患者CD3+、CD4+、CD4+/CD8+T淋巴细胞等免疫指标均显著改善,且并未增加不良反应发生率。李亚男等[11]的研究比较了PD-1抑制剂与贝伐珠单抗针对PD-L1阴性的晚期非鳞非小细胞肺癌患者的疗效,结果显示,PD-1抑制剂组患者ORR、DCR均高于贝伐珠单抗组(69.57% vs 35.71%;100.00% vs 88.10%),但在单独评估不良反应风险后,认为对于合并免疫治疗禁忌证或发生免疫相关不良事件的患者,贝伐珠单抗可作为代替方案。针对晚期非小细胞肺癌患者,阻断PD-1/PD-L1途径的治疗措施虽然带来了一些积极结果,但总体而言只对于被诊断为转移性非小细胞肺癌并表现出PD-1/PD-L1表达>1%的患者,靶向抑制PD-1/PD-L1通路的治疗方案才可带来理想的收益,盲目使用PD-1/PD-L1抑制剂反而会增加患者的经济负担,给患者治疗信心带来负面影响[12]。
3.2安罗替尼是一种新型的酪氨酸激酶抑制剂,能有效抑制VEGF信号通路,抑制肿瘤组织中血管内皮细胞增殖和新生血管的形成,从而达到抗肿瘤的目的[13]。季栋梁[14]的研究比较了安罗替尼与第一代酪氨酸激酶抑制剂厄洛替尼的临床治疗效果与安全性,结果显示,与目前临床一线铂类化疗药相比,安罗替尼可显著提高患者的生存期,中位生存期为10.3个月,一年生存率为45.1%,效果不差于厄洛替尼,且并未增加不良反应发生的风险;此外,安罗替尼疗效与患者年龄、性别、表皮生长因子受体(epidermal growth factor receptor,EGFR)突变无显著相关性,提示不同年龄、性别的患者都有可能在安罗替尼治疗中获益。程刚等[15]研究了安罗替尼联合二线化疗方案治疗晚期非小细胞肺癌的疗效,结果显示安罗替尼联合二线化疗可以显著提高患者的DCR(82.4% vs 57.65%),且无严重不良反应发生。
3.3本研究采用安罗替尼联合PD-1抑制剂的方案对晚期非小细胞肺癌患者进行治疗,结果显示,联合治疗组的ORR、DCR均显著高于抗PD-1治疗组,提示安罗替尼联合PD-1抑制剂的方案对晚期非小细胞肺癌患者疗效更显著。此外,本研究中联合治疗组的胃肠道反应、肝毒性、脱发、甲状腺功能亢进/减退发生率高于抗PD-1治疗组,肾功能不全、肺炎的发生率低于抗PD-1治疗组,但差异均无统计学意义,提示安罗替尼联合PD-1抑制剂并不会增加相关不良反应发生的风险,有较好的安全性。有研究指出,肿瘤的侵袭性生长和转移与新生血管密切相关,因此在治疗时阻断肿瘤组织周围血管的形成,是控制远处转移和复发的关键[16-17]。MMP-2是一种分解细胞外基质组分的蛋白酶,可降解细胞外基质和血管基底膜,促进肿瘤的侵袭转移,不少研究均证实在多种类型的肿瘤组织中MMP-2呈高表达,与患者不良预后相关[18]。VEGF是重要的促血管生成因子,在肿瘤相关血管内皮细胞生长调节的过程中发挥关键作用,其水平在一定程度上反映肿瘤转移的风险,在晚期肺癌患者中往往呈高水平[19]。唐静等[20]探讨了MMP-2及VEGF与非小细胞肺癌患者临床特征的关系,结果显示非小细胞肺癌患者血清MMP-2、VEGF水平显著高于健康人,并且与肿瘤大小、淋巴结转移及肿瘤分期具有关联性。因此,VEGF、MMP-2可作为评估药物抗肿瘤效果的有效指标。本研究分析了安罗替尼联合PD-1抑制剂对VEGF、MMP-2表达水平的影响,结果显示,在治疗后1周、1个月、3个月,两组血清VEGF、MMP-2水平均呈下降趋势,且联合治疗组水平较抗PD-1治疗组更低,提示安罗替尼联合PD-1抑制剂可能通过降低VEGF、MMP-2表达水平抑制肿瘤侵袭,减少肿瘤扩散的风险。
综上所述,安罗替尼联合PD-1抑制剂对晚期非小细胞肺癌患者疗效显著,能降低VEGF、MMP-2表达水平,且安全性较高。但本研究为单中心回顾性研究,纳入病例较局限,后续将通过更大样本量的前瞻性研究及基础实验对结果、结论作进一步验证。
