急性呼吸衰竭ECMO支持患儿病原学及临床因素对结局的影响分析
2023-08-10黄翰武梁珍花吕立文庞小容刘桂良凌光满
黄翰武, 梁珍花, 王 敏, 吕立文, 石 磊, 庞小容, 刘桂良, 凌光满, 陈 莹
急性呼吸衰竭是一种危及生命的常见并发症,是入住儿科重症监护室(pediatric intensive care unit,PICU)的常见原因。由于诊断标准的不一致和异质性,流行病学没有得到很好的描述。在有潜在儿科急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的呼吸衰竭患者中,流行病学数据显示,PICU入院的呼吸衰竭年发病率为2.3%,死亡率为24%~34%[1-2]。机械通气是治疗儿童呼吸衰竭的重要手段,但仍有部分患儿因肺部病变严重,面临着机械通气失败的风险,死亡率极高。自20世纪70年代以来,体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)支持已被用于机械通气支持失败的严重急性呼吸衰竭儿童的气体交换[3]。据报道,每年约有1 500名美国儿童和3 000名全球儿童接受ECMO支持[4-5]。文献中越来越多的证据证实,ECMO支持在新生儿和儿童急性难治性呼吸衰竭患者中得到成功应用[6-7]。近年来,我国儿童ECMO开展例数、应用的疾病种类不断增加及拓展,患儿存活率也有所提升[8]。尽管ECMO支持的患者群体的临床及疾病的复杂性不断提高,但可能归因于管理策略的加强和技术的重大进步,ECMO的结果得以改善[9]。急性呼吸衰竭有三大病因类别:内在和获得性肺疾病、气道疾病和神经肌肉功能障碍。肺部感染是儿童急性呼吸衰竭的常见病因之一,全球5岁以下幼儿中,因肺炎死亡人数在2000年为170万,2015年则为90万,虽然数量有所下降,但仍巨大[10]。而不同的肺部感染病原体可能对ECMO支持治疗结局造成影响[11-12]。故本研究对28例急性呼吸衰竭需ECMO支持患儿进行单中心的回顾性分析,分析其病原学及临床因素对结局的影响。
1 资料与方法
1.1一般资料 回顾性分析2019年1月至2023年6月在广西壮族自治区人民医院PICU住院的因急性呼吸衰竭行ECMO支持治疗的28例患儿的临床资料,其中男20例,女8例,年龄2 d~13岁。急性呼吸衰竭的病因包括重症感染性肺炎21例,吸入性肺炎1例,烧伤性ARDS 1例,创伤性ARDS 2例,肺动静脉畸形合并肺出血1例,新生儿膈疝1例,新生儿持续性肺动脉高压(persistent pulmonary hypertension in newborns,PPHN)4例,新生儿胎粪吸入综合征1例,先天性肺囊性病变1例,颅脑损伤1例,塑型性支气管炎5例等。病原学包括链球菌6例(肺炎链球菌5例,缓症链球菌1例),金黄色葡萄球菌1例,嗜麦芽窄食单胞菌1例,肺炎克雷伯菌1例,嗜肺军团菌1例,耶氏肺孢子菌2例,流感嗜血杆菌1例,腺病毒3例,巨细胞病毒(cytomegalovirus,CMV)5例,EB病毒(Epstein-Barr virus,EBV)1例,呼吸道合胞病毒(respiratory syncytial virus,RSV)1例,流感病毒8例(甲型流感6例,乙型流感1例,副流感1例),禽流感1例。有5例甲型流感相关的塑型性支气管炎需行ECMO治疗,支气管镜检查可取出典型的“树枝”(见图1)。
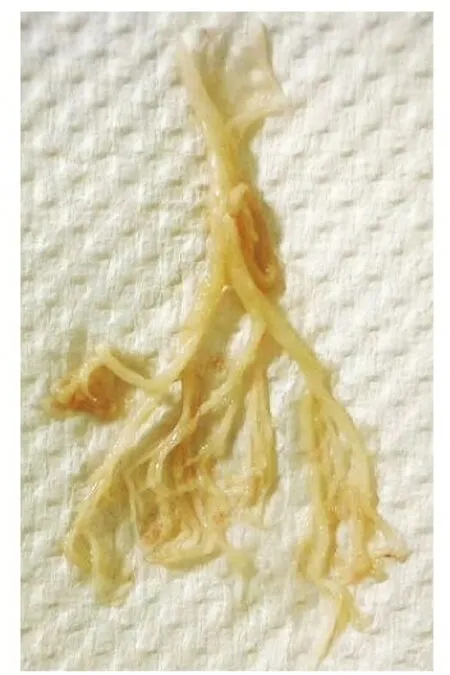
图1 甲型流感合并塑型性支气管炎患儿支气管镜检查下取出典型“树枝”的照片
1.2纳入与排除标准 纳入标准:符合ECMO指征的急性呼吸衰竭患儿诊断标准[13-14]:(1)新生儿:①尽管进行了最大限度的规范化治疗,但组织氧供不足(乳酸升高、代谢性酸中毒恶化、终末器官功能障碍等迹象);②严重缺氧性呼吸衰竭伴急性失代偿(PaO2<40 mmHg);③氧合指数(oxygen index,OI)>40持续超过4 h,或OI>20持续超过24 h,临床症状无明显改善;④严重肺动脉高压伴右心室功能障碍和(或)左心室功能障碍。(2)儿童:①严重呼吸衰竭,OI>40持续6 h以上或持续PaO2/FiO2<60~80 mmHg,或肺泡-动脉氧分压差>600 mmHg;②常规机械通气和其他呼吸支持(高频通气、一氧化氮吸入、俯卧位通气)治疗无反应;③高机械通气压力(如常规通气平均气道压>20~25 cmH2O,高频通气>30 cmH2O)或已出现气压伤;④持续高碳酸血症性呼吸衰竭(如血pH<7.1)。排除标准:(1)致死性染色体异常(例如13-三体或18-三体);(2)无法控制的出血;(3)不可逆的脑损伤;(4)原发疾病以循环衰竭为主或首发。
1.3分组方式 (1)根据患儿年龄分为婴儿组(≤1岁组)11例和非婴儿组(>1岁组)17例。(2)根据患儿性别分为男性组20例和女性组8例。(3)根据患儿病原学分为细菌感染组5例,病毒感染组9例,细菌+病毒混合感染组6例,阴性组8例。病原学检查方法为患儿血、痰培养及宏基因组病原检测。(4)根据患儿ECMO结局分为存活组17例和死亡组11例。以撤离ECMO后超过48 h存活者纳入存活组,ECMO支持治疗期间或撤离ECMO后48 h内死亡者纳入死亡组。
1.4观察指标 收集及分析因急性呼吸衰竭行ECMO支持治疗患儿的年龄、性别、原发疾病、病原学、ECMO支持模式、ECMO上机前后的P/F指数及乳酸水平、上机前Murray肺损伤评分、ECMO支持时长、ECMO前后机械通气时长及ECMO结局。
1.5统计学方法 应用SPSS20.0统计软件进行数据分析。不符合正态分布的计量资料以中位数(下四分位数,上四分位数)[M(P25,P75)]表示,组间比较采用秩和检验。计数资料以例数(n)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.128例患儿ECMO前后P/F指数和乳酸水平比较 ECMO后P/F指数显著高于ECMO前(P<0.05),ECMO前后乳酸水平比较差异无统计学意义(P>0.05)。见表1。
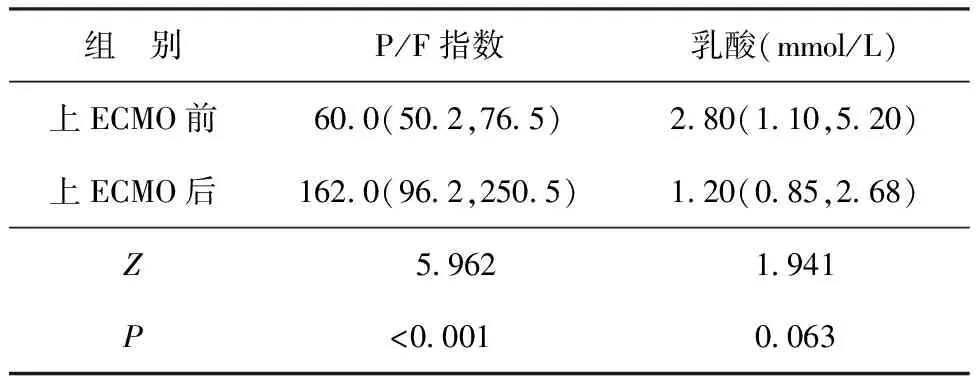
表1 28例患儿ECMO前后P/F指数和乳酸水平比较 [M(P25,P75)]
2.2不同年龄组ECMO治疗情况及结局比较 婴儿组和非婴儿组的ECMO支持时长、ECMO后机械通气时长及结局比较差异无统计学意义(P>0.05)。见表2。
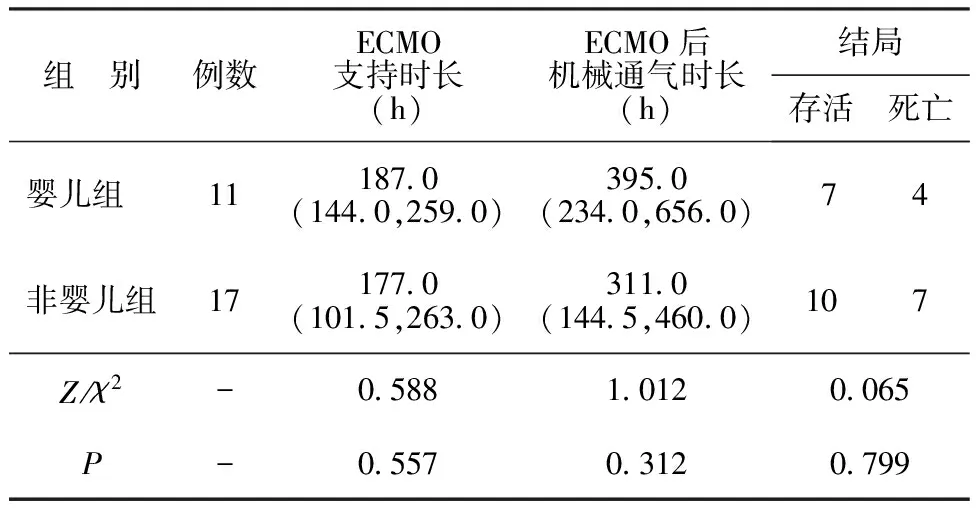
表2 不同年龄组ECMO治疗情况及结局比较[M(P25,P75),n]
2.3不同性别组ECMO治疗情况及结局比较 男性组和女性组的ECMO支持时长、ECMO后机械通气时长及结局比较差异无统计学意义(P>0.05)。见表3。
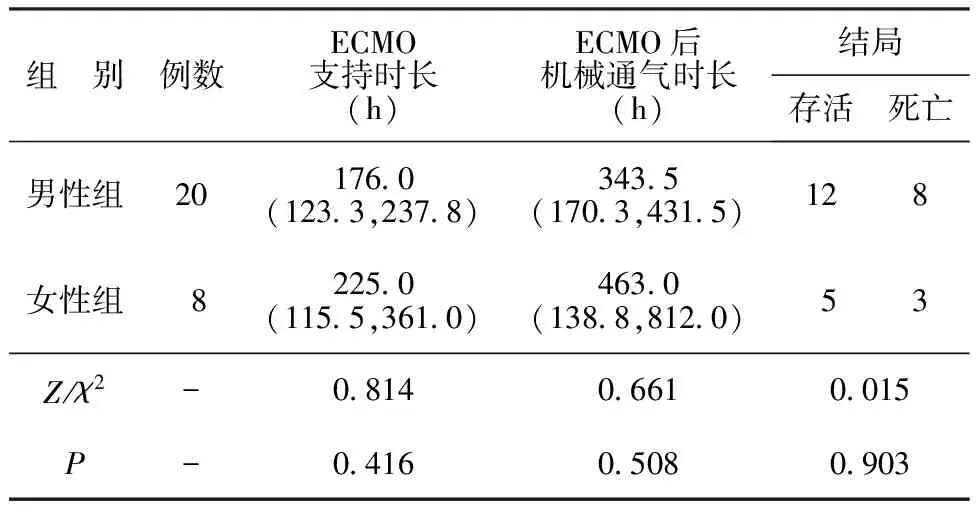
表3 不同性别组ECMO治疗情况及结局比较[M(P25,P75),n]
2.4不同病原感染情况对ECMO治疗结局影响的分析结果 细菌感染组、病毒感染组、细菌+病毒混合感染组及阴性组在ECMO前后P/F指数和乳酸水平、ECMO支持时长、ECMO后机械通气时长及结局方面比较差异无统计学意义(P>0.05),但在ECMO前Murray肺损伤评分方面差异有统计学意义(P<0.05),以细菌+病毒混合感染组评分最高。见表4。
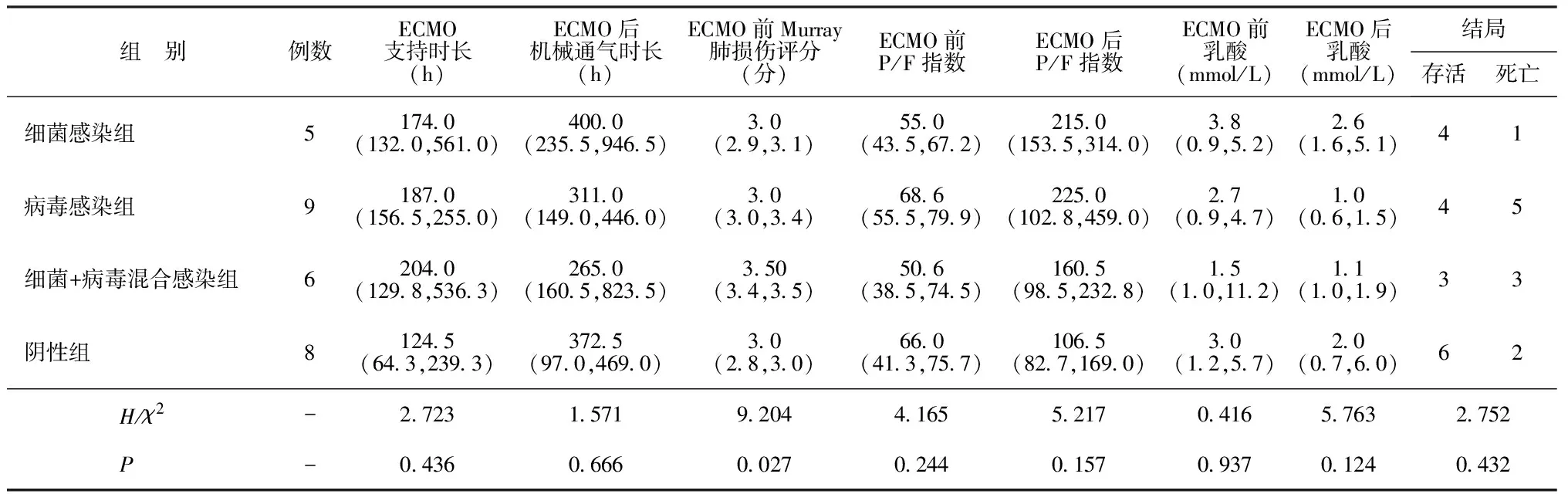
表4 不同病原感染情况对ECMO治疗结局影响的分析结果[M(P25,P75),n]
2.5存活组与死亡组治疗情况及结局比较 存活组与死亡组ECMO前P/F指数、乳酸水平、ECMO支持时长、ECMO前后机械通气时长比较差异无统计学意义(P>0.05),ECMO支持模式差异有统计学意义(P<0.05)。见表5。
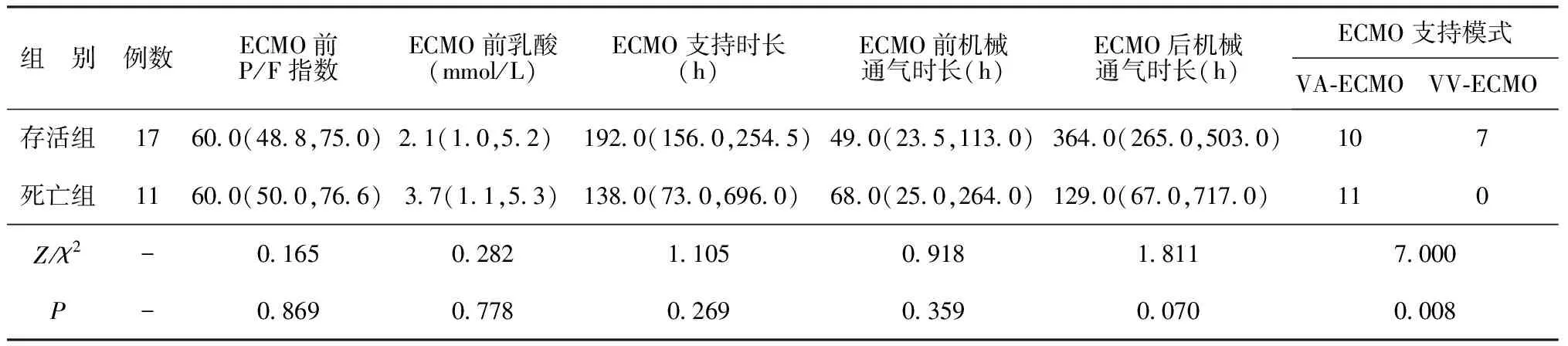
表5 存活组与死亡组治疗情况及结局比较[M(P25,P75),n]
3 讨论
3.1在儿童中,与病毒性或细菌性肺炎、创伤和ARDS相关的呼吸系统疾病的病死率仍然较高。其中包括流感在内的严重病毒性下呼吸道感染可通过宿主和病毒侵犯机制发展为ARDS,包括上皮细胞死亡、肺泡损害、局部和全身细胞因子产生、先天免疫细胞浸润、强烈的T细胞反应以及其他先天和适应性免疫反应[15]。ARDS通常采用肺保护性通气策略进行治疗,但如果这些机械通气策略不能提供足够的氧合或出现右心功能损害,而无法维持足够的循环灌注,患者可能需要ECMO作为一种补救治疗,因此ECMO在急性呼吸衰竭治疗中越来越重要[16-17]。ECMO的主要适应证是尽管采用了最佳的常规治疗但死亡率仍很高的急性严重心肺功能衰竭,部分患儿虽然未达到严格的ECMO启动指征,但当预测有50%的死亡风险时,应考虑尽早行ECMO[13]。在本研究中,ECMO治疗急性呼吸衰竭的整体存活率为60.71%,与体外生命支持组织(Extracorporeal Life Support Organization,ELSO)报道的呼吸支持存活率相当[6]。
3.2本研究中,婴儿组(≤1岁组)与非婴儿组(>1岁组)相比,在ECMO支持时长、ECMO后机械通气时长及结局方面差异无统计学意义;性别亦不影响ECMO支持及ECMO后机械通气时长,且与ECMO的结局无关;在病原菌方面,细菌感染组、病毒感染组、细菌+病毒混合感染组及阴性组在上述指标比较亦无显著差异。进一步对比存活组与死亡组患儿ECMO治疗前P/F指数、乳酸水平、ECMO支持时长、ECMO前后机械通气时长,差异亦无统计学意义。李敏等[18]的研究指出免疫功能不全及肺部Murray肺损伤评分是影响VV-ECMO治疗重症肺炎所致肺源性ARDS预后的重要因素,但ECMO治疗前有创机械通气时间亦影响预后,与本研究的结论相悖,可能是因为研究人群的不同,以及本研究中ECMO支持的模式不仅仅是VV-ECMO模式,更多的是VA-ECMO模式。本研究结果显示VA-ECMO与VV-ECMO对结局有影响,且VV-ECMO存活率更高[100.00%(7/7)vs 47.62%(10/21)]。
3.3不同的病原学对ECMO前后P/F指数、ECMO前后乳酸的影响无差异,提示在严重肺部病变中,肺部功能改善和乳酸清除并不因病原学差异而改变,因为肺部疾病通常需要较长的时间去恢复[19]。本研究发现,不同的病原菌导致的肺损伤有差异(P<0.05)。Luyt等[20]的分析中也列举了ICU中不同病原菌发生ARDS的差异,显示不同病原菌对肺的损伤严重程度不同,铜绿假单胞菌、金黄色葡萄球菌、克雷伯菌属所致肺部感染是ARDS病因的前三位。本研究中细菌+病毒混合感染组Murray肺损伤评分最高,提示混合感染对肺脏的损伤更强。
3.4ECMO启动后可以即刻明显地改善患儿氧供,故本研究中患儿在ECMO前后P/F指数差异有统计学意义,而乳酸水平差异无统计学意义,究其原因是乳酸在体内的代谢需要时间,此外,ECMO前机体的缺氧状态,使乳酸代谢的器官(主要为肝、肾)发生功能障碍,影响其代谢速率[21]。
3.5塑型性支气管炎也有需ECMO支持治疗的报道[22]。在本研究6例甲型流感患儿中,合并肺炎链球菌感染3例,有5例发生塑型性支气管炎,表明合并其他细菌感染易使病情加重,且有发生塑型性支气管炎的风险[23],但ECMO介入后存活4例,死亡2例,存活率达66.67%,提示ECMO可提高病毒性肺炎继发呼吸衰竭患者的存活率,这与相关报道结果相似[24]。本研究11例(39.29%)死亡病例中,腺病毒7型患儿3例全部死亡,占病毒组死亡人数的60.00%(3/5),死亡率不容忽视。Prodhan等[25]的研究表明,对于需要ECMO支持的腺病毒感染儿童,其存活率为38%(62/163);与腺病毒住院死亡率独立相关的ECMO并发症包括:存在肺气肿[OR(95%CI):3.57(1.19~10.7)]、血pH<7.2[OR(95%CI):5.94(1.04~34.1)]和中枢神经系统出血[OR(95%CI):25.36(1.47~436.7)]。
3.6鉴于本文样本量偏少,且为回顾性研究,研究对象的选择和相关资料的收集不可避免地存在偏倚,未能做出有效的多因素分析结果,更多数据有待进一步临床研究。但ECMO作为儿童严重急性呼吸衰竭的挽救性治疗手段,为常规治疗无效的患儿提供了最后的选择,但整体存活率仍偏低,需进一步改善设备、改进技术,以降低死亡率。
综上所述,病原学情况对肺部Murray肺损伤评分有影响,但对ECMO支持时长、ECMO后机械通气时长及ECMO的结局无明显影响。此外,VA-ECMO与VV-ECMO模式对患儿的生存结局亦有影响。
