体外膜肺氧合辅助心肺复苏治疗儿童心搏骤停临床效果分析
2023-08-10任玉倩周益平单怡俊史婧奕
任玉倩, 崔 云, 周益平, 单怡俊, 史婧奕, 孙 汀, 熊 熙
体外心肺复苏(extracorporeal cardiopulmonary resuscitation,ECPR)的概念于1972年提出。1976年,首次将其作为传统心肺复苏(conventional cardiopulmonary resuscitation,CCPR)无效的心搏骤停(cardiac arrest,CA)患者的挽救性治疗措施。心肺复苏(cardiopulmonary resuscitation,CPR)期间通过实施体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)技术,可有效保证重要脏器灌注与充足的氧供,为自主循环的恢复提供时间[1]。成人回顾性研究及荟萃分析研究均显示ECPR可显著提高CA患者的出院存活率和远期生存率。2019年美国心脏协会(American Heart Association,AHA)CPR指南强调,具备ECMO技术流程、专业团队和设备的医疗机构,对于存在可逆病因的CA患者,可考虑使用ECPR技术[2]。目前国内儿童ECPR仍处在探索阶段,临床应用例数有限,抢救成功率不高,影响患儿预后的因素尚不明确。本文收集2015年12月至2022年12月上海市儿童医院儿童重症监护室(pediatric intensive care unit,PICU)收治的8例ECPR患儿的临床资料进行回顾性分析,总结临床特点,为临床提供参考。
1 资料与方法
1.1一般资料 回顾性分析2015年12月至2022年12月在上海市儿童医院PICU因CA接受ECMO辅助CPR治疗的8例患儿的临床资料。纳入患儿均符合ECMO辅助CPR支持指征:(1)CA病因可逆;(2)经积极常规CPR救治15 min未能恢复自主循环或恢复自主循环但血流动力学仍不稳定者[3]。ECMO辅助CPR支持的排除标准:(1)存在不可逆的严重神经系统损害;(2)无法控制的活动性大出血;(3)终末期肿瘤;(4)存在不能通过手术或其他方式救治的原发性疾病;(5)患儿家属不同意行ECMO辅助治疗。8例患儿中男2例,女6例,中位年龄75.40(53.00,143.00)月龄,中位体重22.00(15.00,43.00)kg。原发疾病:7例患儿为暴发性心肌炎,1例为脓毒性休克。8例患儿均为院内发生CA,3例暴发性心肌炎患儿于ECMO动静脉置管过程中发生CA,1例暴发性心肌炎为外院发生CA,持续CPR 112 min至我院ECMO团队到场建立ECMO。本研究经上海市儿童医院伦理委员会批准(2018R016 F01)。
1.2临床资料收集 通过医院电子病历系统收集患儿临床资料。(1)一般资料:年龄、性别、体重等;(2)临床观察指标:CA原因、CPR前血管活性药物评分(Vasoactive Inotropic Score,VIS)和儿童序贯器官衰竭评估(Pediatric Sequential Organ Failure Assessment,pSOFA)评分、CPR至ECMO转流时间间隔、初始可电击心律(患者第一个记录在案的节律为心室颤动或无脉性室性心动过速)、运行中并发症;(3)ECMO相关指标:ECMO置管方式、置管位置及运行时长;(4)实验室指标:ECMO转流前和转流24 h后pH值、乳酸(lactic acid,Lac)与器官功能指标;(5)临床预后:住PICU时间及结局等。
1.3ECPR方法及管理 CA患儿经CPR及药物救治,持续15 min未恢复自主循环,开始启动ECPR。所有ECPR患儿选择静脉-动脉(veno-arterial,VA)ECMO模式。根据患儿临床情况及血管内径尺寸分别选择经右侧颈内静脉/颈动脉和经股静脉/股动脉插管建立ECMO。颈动脉及股动脉插管一般由血管外科医师切开置管。颈内静脉及股静脉插管一般由重症医学科医师在床旁超声引导下进行穿刺置管。股动脉插管均建立同侧股动脉远端留置灌注管以保障该侧肢体血供。ECMO支持的起始流量设置为80~120 ml/(kg·min),依据患者血氧饱和度、平均动脉压(mean arterial pressure,MAP)、中心静脉氧饱和度(central venous oxygen saturation,SCVO2)及Lac调整ECMO血流量。采用静脉肝素泵注全身抗凝,保持活化凝血时间(activated clotting time,ACT)在180~220 s。ECMO转流期间,床旁心脏彩色多普勒动态监测心功能。若床旁超声显示心脏出现无效蠕动式收缩、左心房和左心室进行性增大和左心室湍流征,考虑左心膨胀,予放置左心引流管左心减压。每2~6 h评估瞳孔大小与对光反射,常规记录患儿生命体征以及ECMO运行情况。ECMO撤离:ECMO的血流量降至10~15 ml/(kg·min),气血比0.8∶1~1.5∶1,吸入氧体积分数21%,维持以下指标1~2 h以上:(1)正常心率和血压;(2)正常灌注压力[MAP-中心静脉压(central venous pressure,CVP),正常范围为(55+年龄×1.5)mmHg];(3)SCVO2>65%;(4)心指数(cardiac index,CI)3.3~4.0 L/(min·m2),左心射血分数(left ventricular ejection fraction,LVEF)>40%~50%;(5)血Lac<2.0 mmol/L。
1.4统计学方法 应用SPSS22.0统计软件进行数据处理。计量资料以中位数(最小值,最大值)[M(min,max)]表示,组间比较采用非参数秩和检验。计数资料以例数(百分率)[n(%)]表示,组间比较采用Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1CA患儿ECMO相关情况 3例患儿为右侧颈内静脉/颈动脉外科手术切开置管。5例为股静脉/股动脉置管,股静脉均采用穿刺置管,股动脉4例为切开置管,1例为穿刺置管(CA前股动脉已留置导管)。8例患儿中,CPR至ECMO转流时间最长者为院外ECMO转运患儿(150 min);时间最短者为ECMO穿刺置管过程中发生CA患儿,ECPR建立时间仅为18 min。5例患儿具有初始可电击心律,5例患儿ECMO转流前存在肾损伤。ECMO运行期间,6例患儿因肾损伤或液体超载行连续性肾脏替代治疗(continuous renal replacement therapy,CRRT),4例患儿因左心膨胀行左心减压。ECMO运行中位时长为50.50(3.00,210.00)h。观察8例患儿ECMO运行期间并发症,包括出血8例,弥散性血管内凝血(disseminated intravascular coagulation,DIC)6例,溶血3例,血栓1例,神经系统损伤(脑梗死)1例,股动脉置管侧下肢出现肢端缺血1例。ECMO成功撤离并出院存活3例,撤机成功率及出院存活率均为37.50%(3/8)。住PICU时间为3.50(1.00,56.00)d。见表1。出院后3个月随访3例存活患儿,脑梗死患儿患侧肢体肌力恢复正常,可正常生活;肢端缺血患儿患肢恢复可,无行走障碍,但剧烈运动受限;另1例患儿生活正常。
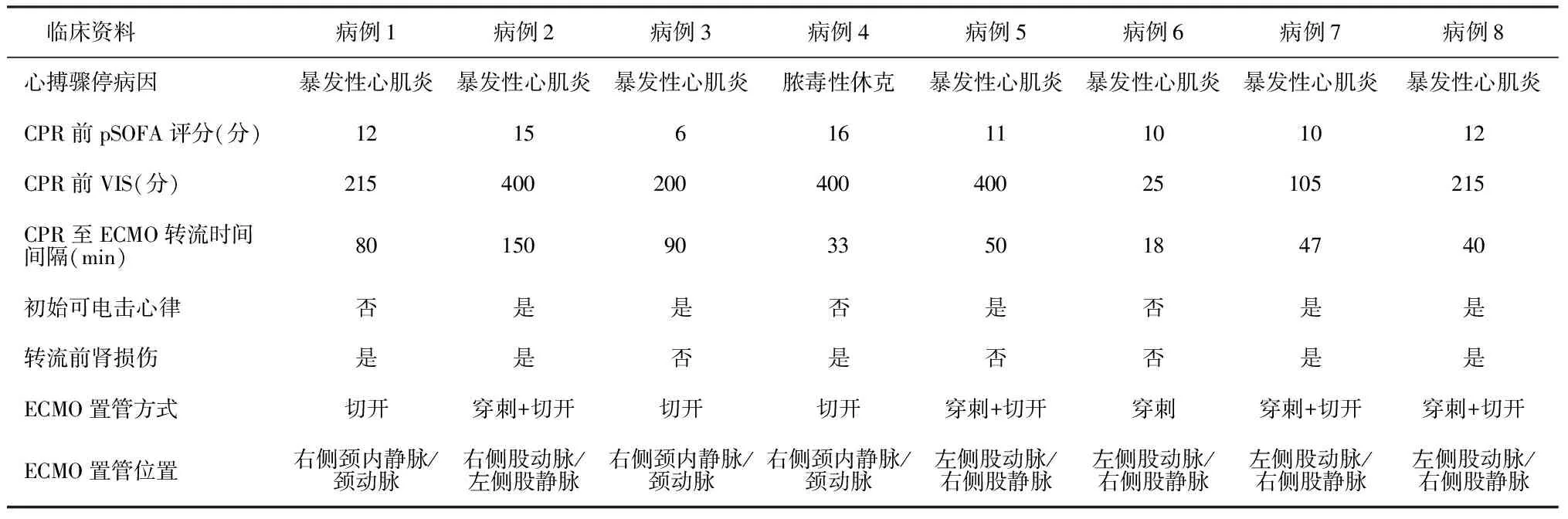
表1 ECPR患儿一般临床资料
2.2ECPR患儿转流前和转流24 h后实验室指标变化比较 患儿转流24 h后出现纤维蛋白原(fibrinogen,Fib)显著降低(P<0.05),肌酐(serum creatinine,Scr)显著上升(P<0.05),伴有肝酶显著升高(P<0.05)。血pH值、Lac及SCVO2在转流前后比较差异无统计学意义(P>0.05)。见表2。
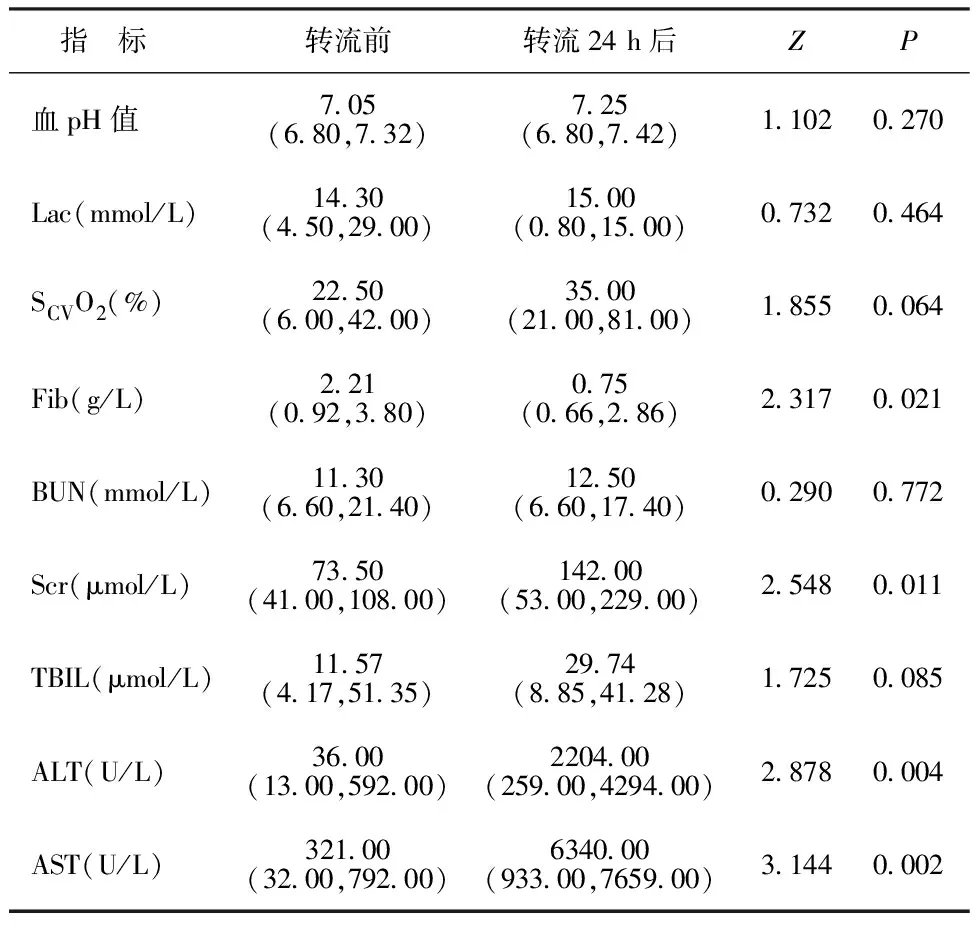
表2 8例ECPR患儿转流前和转流24 h后实验室指标变化比较[M(min,max)]
2.3存活组和死亡组ECMO转流前和转流24 h后血pH值和Lac水平比较 按预后分为存活组和死亡组,因为病例1的ECMO运行时间只有3 h,所以死亡组只有4例转流24 h后的pH和Lac数据。与死亡组患儿比较,存活组患儿ECMO转流24 h后Lac水平显著下降(P<0.05)。见表3。

表3 存活组和死亡组ECMO转流前和转流24 h后血pH值和Lac水平比较[M(min,max)]
3 讨论
3.1在美国,每年有超过15 000例儿童住院期间因发生CA需要CPR[4],其中PICU住院患儿中1.8%发生院内心脏骤停(in-hospital cardiac arrest,IHCA),且心源性疾病发生率更高[5]。近20年来,随着ECPR技术的发展,儿童IHCA的出院存活率由9%~13.7%[6]提升到35%~50%[7-8]。国际体外生命支持组织(Extracorporeal Life Support Organization,ELSO)报告,截至2023年4月,ELSO登记ECRP儿童6 729例,出院存活率为41%[9]。Lasa等[10]分析了美国心脏协会获取指南-复苏登记处2000—2011年连续12年院内CPR持续时间≥10 min患儿的临床数据,结果显示,3 756例患儿中84%采用CCPR,16%采用ECPR;CCPR组出院存活率为27%,18%患儿神经系统预后良好;ECPR组出院存活率为40%,27%神经系统预后良好。与CCPR相比,ECPR的出院存活率和良好神经系统预后的比例更高。本组研究结果显示ECPR患儿的出院存活率为37.50%,与既往研究报道相似。
3.2有研究指出,CPR至ECMO转流时间又称为低血流时间,是影响CA患者预后的重要因素。CCPR只能提供正常心输出量的25%~33%,随着CPR时间延长,CPR患者自主循环恢复的可能性降低[11]。在现有观察性研究中,发生CA到ECPR建立成功时间间隔越短,患者生存率越高,从CPR开始到ECMO建立时间每增加5 min,病死率增加4%[12],且ECPR建立时间与神经功能预后密切相关[13]。来自法国的一项研究显示,CCPR 20 min后仍不能恢复自主循环者开始ECPR较30 min后开始实施ECPR组患者生存率明显升高[14]。Reynolds等[15]多中心队列研究显示,经过9~21 min高质量CCPR后实施ECPR的患者,其神经功能预后最好。综上,实施ECPR的理想时间是进行CCPR 20 min以内,若CA患者通过CCPR恢复自主循环的可能性较低,则需要在10~15 min内完成是否进行ECPR的临床决策[16]。本研究显示存活患儿CPR至ECMO转流时间间隔相对较短,且提前留置动静脉管路节约ECPR建立时间,可能是预后良好的因素。尽管如此,复苏团队的协作能力和患者的自身因素存在差异,难治性CA患者启动ECPR的最佳时机尚无明确定义。
3.3本研究显示,ECMO转流24 h后患儿的Scr水平较转流前明显上升,差异有统计学意义(P<0.05),提示ECMO运行后易并发肾损伤。据报道,ECMO并发急性肾损伤(acute kidney injury,AKI)的发生率为26%~85%[17],且在VA-ECMO中比静脉-静脉(veno-venous,VV)-ECMO更常见(61% vs 46%)[18]。发生AKI的高危因素可能与ECPR前血流灌注差,缺血再灌注损伤,活性氧的产生,以及VA-ECMO期间平流损害肾皮质血流并上调肾素-血管紧张素-醛固酮系统,从而诱导全身血管收缩有关[19]。
3.4目前关于儿童ECPR预后影响因素的研究较少。一项关于儿童ECPR生存预测因素的系统评价和荟萃分析结果显示,在开始ECPR之前,Lac水平的增加与死亡率的相关性最高,其次是pH值下降[20]。Lac作为一种无氧代谢产物,已被证实是反映组织灌注的可靠指标,合并代谢性酸中毒最终导致多器官功能衰竭,死亡风险增加。启动前血pH值<6.60和Lac>18 mmol/L是强烈降低启动ECPR可能性的因素[21]。国内成人ECPR研究结果显示,生存组的起始Lac值及ECPR后6 h、12 h的Lac值均低于死亡组[22]。本组研究纳入患儿ECMO转流24 h后血pH、Lac水平较转流前无明显差异,但存活组转流24 h Lac水平显著下降(P<0.05),提示转流24 h后Lac水平显著下降可能提示预后良好。
儿童IHCA死亡率高,早期识别风险、提供高质量的CPR并及时行ECPR治疗可以最大限度地增加获得良好预后的机会。但目前关于ECPR的运用仍面临着诸多挑战,如何选择合适的病例、合适的时机(从CPR至ECMO转流的时间)、稳定器官功能和评估预后仍不明确。本研究为单中心小样本回顾性分析,研究结果有一定的局限性,亟需开展多中心、大样本的前瞻性随机对照研究,获得我国儿童ECPR高质量证据的临床实践方案。
