阿加曲班抗凝在儿童VA-ECMO中的应用效果分析
2023-08-10刘桂良庞小容黄翰武凌光满谭丙庚梁珍花吕立文
刘桂良, 王 敏, 庞小容, 黄翰武, 凌光满, 陈 莹, 谭丙庚, 梁珍花, 吕立文
体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)是挽救儿童心肺功能衰竭的有力措施之一,但并不是“救命神器”[1],有着较高的出血和血栓形成风险,影响临床结局。抗凝药物选择是优化儿童ECMO抗凝策略的重要一环。除了传统的肝素抗凝,近年来,直接凝血酶抑制剂,如阿加曲班逐渐应用于儿童ECMO抗凝[2],但相关研究数据较少。本研究回顾性分析5例接受静脉-动脉体外膜肺氧合(veno-arterial extracorporeal membrane oxygenation,VA-ECMO)治疗儿童的阿加曲班抗凝情况,分析其抗凝剂量和效果,为临床研究和应用提供参考。
1 资料与方法
1.1一般资料 回顾性分析2021年10月至2023年1月我院儿童重症监护室(pediatric intensive care unit,PICU)收治的5例接受VA-ECMO治疗儿童的临床资料和阿加曲班抗凝情况。其中男2例,女3例,中位年龄9月(1 d~11岁),体重5.7 kg(2.7~50.0 kg)。3例原发病为严重肺部感染,1例为先天性肺发育畸形,1例为心肌病。病例3和病例4分别为嗜肺军团菌和金黄色葡萄球菌引起的重症肺炎和脓毒性休克,存在粒细胞缺乏,感染指标显著升高,且并发弥散性血管内凝血(disseminated intravascular coagulation,DIC)和多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)。病例5为学龄期儿童,存在肝肾功能损伤,并接受了连续性肾脏替代治疗(continuous renal replacement therapy,CRRT)。见表1。5例患儿均因心/肺功能衰竭,达到ECMO救治指征后予VA-ECMO支持,其中1例为体外心肺复苏(extracorporeal cardiopulmonary resuscitation,ECPR)。
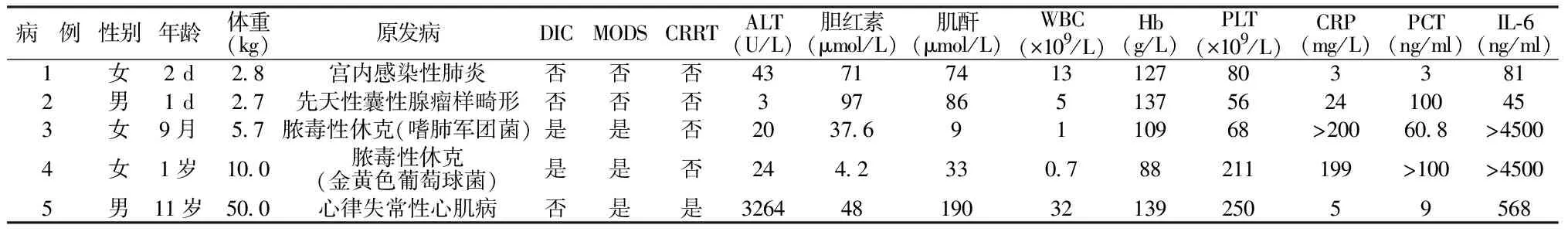
表1 5例患儿一般临床资料
1.2治疗方法 原发病均按照相关诊疗规范处理,ECMO管理(包括初始肝素抗凝)均按照《体外膜氧合在儿童危重症应用的专家共识》[3]进行。因抗凝血酶Ⅲ(antithrombin Ⅲ,AT3)低下、肝素抗凝效果差或出现可疑肝素诱导的血小板减少症(heparin-induced thrombocytopenia,HIT),更换为阿加曲班(南京正大天晴制药有限公司,国药准字H20193333)抗凝,并记录抗凝剂量、凝血指标、血制品用量、出血及血栓相关并发症及临床预后。
2 结果
2.1ECMO管理和预后 5例患儿均接受了VA-ECMO支持模式,支持时长96~874 h。3例需要更换ECMO环路,其中病例3支持时间长、抗凝不理想,共紧急更换环路3次。最终存活3例(2例预后良好),死亡2例。并发症方面,2例感染严重的患儿(病例3和病例4)出现了肢端皮肤坏死,2例(病例1和病例3)出现了ECMO相关急性脑损伤。5例患儿的ECMO环路均出现不同程度的附壁血栓。见表2。

表2 5例患儿ECMO管理和预后
2.2阿加曲班抗凝情况 5例患儿均初始使用肝素后改阿加曲班抗凝,其中4例年龄小的患儿(病例1~4)存在AT3低下(<60%),3例患儿(病例3~5)存在可疑HIT。病例1和病例2阿加曲班起始剂量较大,病例3~5起始剂量明显减少,活化部分凝血酶原时间(activated partial thromboplastin time,APTT)除病例1偏高外全部达标,5例激活全血凝固时间(activated clotting time of whole blood,ACT)均过高。更换阿加曲班后,血小板水平总体较前回升,但血制品用量未见明显减少。未出现阿加曲班直接相关的出凝血并发症。见表3。
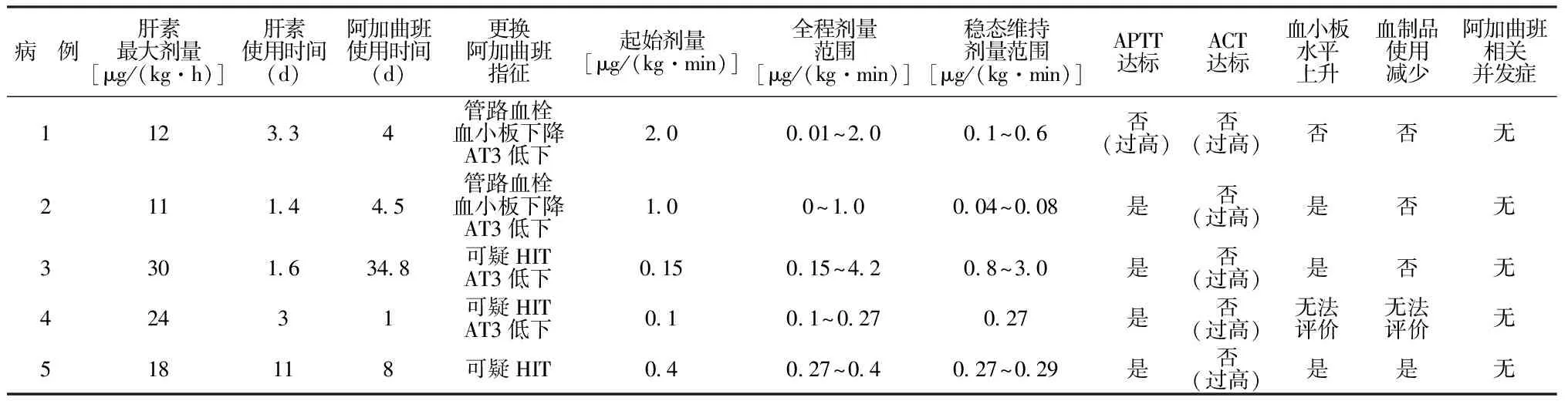
表3 5例患儿阿加曲班的抗凝情况
2.3患儿的动态抗凝过程 肝素和阿加曲班的给药剂量和对应监测指标(APTT、ACT和血小板)随时间的变化情况。总体上,病例1和病例2阿加曲班的剂量和凝血指标波动较病例3~5大。
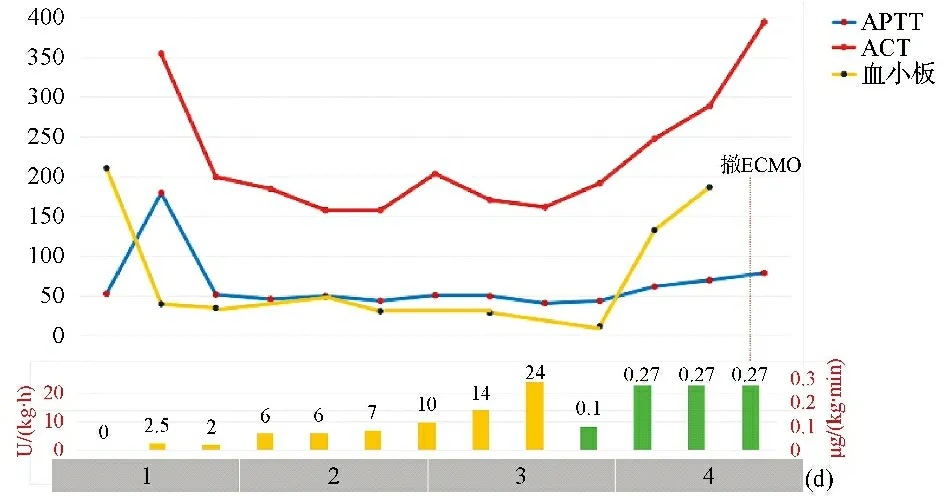
病例1 为新生儿,原发病为宫内感染性肺炎,发展至重度急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)、肺动脉高压和肺出血,因呼吸衰竭和难治性休克予ECMO支持,置管过程中突发心跳骤停,紧急行ECPR。肝素抗凝3 d 6 h,效果欠佳,在APTT和ACT总体达标情况下,出现血小板下降(20×109/L),AT3低下(<30%),D二聚体进行性升高,ECMO术口渗血,间断少量肺出血,肉眼血尿,管路附壁血栓增多。改阿加曲班抗凝后,APTT和ACT超过目标范围,但管路附壁血栓、血尿、血小板和D二聚体均无改善,并紧急更换ECMO环路1次,血制品输注量无减少。ECMO支持7 d 6 h后成功撤机并存活出院。患儿无颅内出血及脑梗死,但延续了病初的缺氧缺血性脑病。见图1。
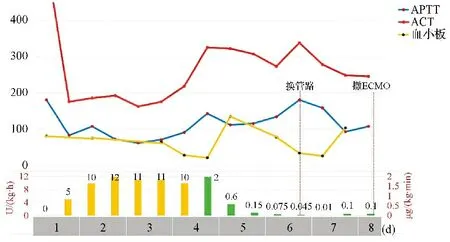
注:柱状图为抗凝药物剂量,左下纵轴和黄柱表示肝素剂量,右下纵轴和绿柱表示阿加曲班剂量
病例2 为34周+5 d早产儿,原发病为胸腔内巨大的先天性囊性腺瘤样畸形,因压迫性肺不张、纵隔移位,出现呼吸衰竭和休克,予VA-ECMO支持,肝素抗凝1 d 10 h后ECMO管路附壁血栓显著增加,血小板低下(20×109/L),予紧急更换ECMO环路,并改阿加曲班抗凝。次日,心胸外科行“开胸囊肿切除术”,术中胸腔渗血明显暂停抗凝12 h,出血停止后予极低剂量阿加曲班维持[0.05 μg/(kg·min)],监测APTT偏高(75~100 s),ACT较高(200~300 s),血小板较前有所上升。ECMO支持6 d后成功撤机,患儿无颅内出血及脑梗死,存活出院,预后良好。见图2。

注:柱状图为抗凝药物剂量,左下纵轴和黄柱表示肝素剂量,右下纵轴和绿柱表示阿加曲班剂量
病例3 为9月龄婴儿,原发病为嗜肺军团菌引起的重症肺炎和脓毒性休克,并发DIC和MODS,予VA-ECMO救治,肝素抗凝1 d 15 h,出现肝素抵抗[30 μg/(kg·h)],APTT不达标(35~45 s),血小板下降(23×109/L),AT3低下(39%~56%),ECMO术口渗血,肢端皮肤坏死。改阿加曲班抗凝后APTT延迟达标(约2 d后50~80 s),虽然此后APTT偏高(60~100 s),ACT过高(250~350 s),但患儿肢端皮肤坏死无改善,反复输注血小板后血小板数量仍下降,共更换ECMO氧合器3次。EMCO支持36 d 10 h后,头颅CT提示:严重缺血缺氧性脑病合并层状坏死。家属签字放弃治疗后死亡。见图3。
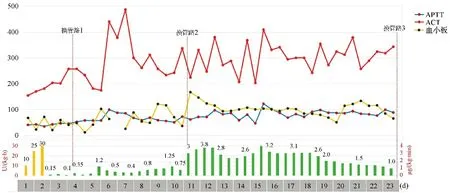
注:柱状图为抗凝药物剂量,左下纵轴和黄柱表示肝素剂量,右下纵轴和绿柱表示阿加曲班剂量
病例4 为1岁婴儿,原发病为金黄色葡萄球菌引起的重症肺炎和脓毒性休克,并发MODS和DIC,新冠病毒核酸阳性,有粒细胞缺乏,予VA-ECMO支持后血压维持欠佳并很快出现四肢肢端皮肤片状坏死。予肝素抗凝3 d,APTT不达标(41~52 s),血小板下降明显(12×109/L),AT3低下(31%~50%),改阿加曲班抗凝后APTT和ACT上升,但肢端皮肤坏死仍加重。因效果不佳,家属放弃治疗后死亡,未行头颅CT检查。见图4。
注:柱状图为抗凝药物剂量,左下纵轴和黄柱表示肝素剂量,右下纵轴和绿柱表示阿加曲班剂量
病例5 为11岁儿童,最终诊断为心律失常性心肌病,因心源性休克、心肺复苏术后,且并发MODS,予VA-ECMO+CRRT支持。肝素抗凝11 d,在APTT、ACT基本达标情况下,血小板反复下降(35×109/L),因可疑HIT,改阿加曲班抗凝,APTT达标(70~90 s),但ACT显著升高(280~380 s),出现少许皮肤瘀斑和短期酱油样尿。ECMO和CRRT运行良好,ECMO支持19 d后成功撤机,无颅内出血和脑梗死,预后良好。见图5。
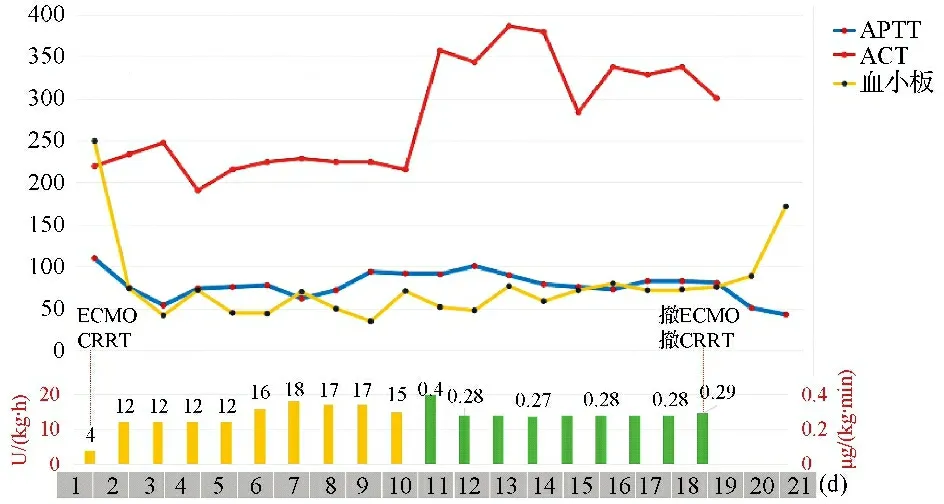
注:柱状图为抗凝药物剂量,左下纵轴和黄柱表示肝素剂量,右下纵轴和绿柱表示阿加曲班剂量
3 讨论
3.1阿加曲班在儿童ECMO中的应用现状 阿加曲班是直接凝血酶抑制剂,在成人HIT中已被推荐为首选的替代抗凝药物[4]。目前关于阿加曲班应用于儿童ECMO的数据较少,关于其剂量和抗凝效果仍然缺乏共识。本研究5例VA-ECMO儿童开始均予肝素抗凝,随后因AT3低下或可疑HIT,改为阿加曲班抗凝,并监测抗凝指标,包括APTT、ACT、D二聚体、血小板和血栓弹力图等,初步探讨阿加曲班的抗凝剂量、特点和效果。目前,肝素抗凝仍是儿童ECMO的首选抗凝药物,具有价格低廉、半衰期短、有快速拮抗剂(鱼精蛋白)等优点。但其抗凝效果个体差异大,有诱发HIT可能。新生儿和婴幼儿存在生理性AT3低下,肝素抗凝效果常难以保证,故近20年来儿童ECMO相关的出血和血栓并发症并无明显改善[5]。探索更优的抗凝策略一直是体外生命支持研究的热点,近10余年来,直接凝血酶抑制剂——阿加曲班在成人中的应用经验逐渐增多,并取得了较为肯定的效果[6-7],但其在儿童ECMO中的研究尚不充分,需要进一步研究。
3.2阿加曲班的药物剂量 阿加曲班属于直接凝血酶抑制剂,通过直接可逆性抑制凝血酶活性,从而发挥抗凝效果。因其不依赖AT3,对于低龄儿童或病情危重引起的低AT3水平在理论上应更具抗凝优势。本研究有2例新生儿和2例婴儿,均存在AT3显著低下,肝素抗凝效果欠佳,故更换为阿加曲班抗凝。目前,ECMO儿童的阿加曲班抗凝剂量尚无共识,成人推荐以2 μg/(kg·min)为起始剂量[8],儿童剂量在不同的研究中差异较大[9-11],但总体低于成人。本研究5例患儿阿加曲班的起始剂量差异大[0.1~2.0 μg/(kg·min)],归因于人为的经验性设定。起初2例新生儿,根据既往文献选用1~2 μg/(kg·min)的起始剂量,但APTT和ACT显著升高,需快速大幅下调剂量,造成抗凝指标的巨大波动,随后均予极小剂量维持[0.04~0.1 μg/(kg·min)],故此后3例患儿采用小剂量起步[0.1~0.4 μg/(kg·min)],使得抗凝过渡较为平稳,提示儿童的起始剂量应显著小于成人。随着经验积累,近年来成人的起始推荐剂量也呈下降趋势[0.05~2 μg/(kg·min)][12]。5例患儿的年龄和体重差别巨大,起始剂量是否据此调整尚无定论。有文献报道,阿加曲班的清除率与体重呈正相关[9],即当儿童体重越轻,阿加曲班的清除率降低,半衰期更长,所需剂量应更低,5例患儿的稳态抗凝剂量有这一趋势,但不完全符合,考虑可能与样本量过小有关。有研究发现,病情越危重,如合并MODS时,阿加曲班的剂量应减少,且与序贯器官衰竭(sequential organ failure assessment,SOFA)评分呈负相关[13]。病例3~5均出现MODS,但其稳态维持剂量反而比病例1和病例2更高,考虑除了体重因素外,可能与严重脓毒症的高凝状态有关。病例3和病例4均为明确病原菌引起的脓毒性休克,均并发DIC,肝素抗凝初期就出现了肢端皮肤坏死,进行性加重,考虑存在微小动脉血栓栓塞,虽有文献报道更换阿加曲班抗凝后缺血改善[14],但2例患儿均未能逆转,可能与更换阿加曲班偏晚或感染控制欠佳有关。有研究对比了初始使用阿加曲班和肝素在成人ECMO中的抗凝效果,发现前者不劣于肝素抗凝,且血小板受影响更少,氧合器寿命有所延长等[6,15]。对于存生理性AT3低下的低龄儿童,初始采用阿加曲班可能是值得探索的方向,避免了前期肝素抗凝效果差带来的不利影响。
3.3阿加曲班的抗凝监测 最新体外生命支持组织(Extracorporeal Life Support Organization,ELSO)抗凝指南指出,APTT是阿加曲班抗凝的标准监测指标,而不是ACT,因为后者的影响因素众多,包括血小板数量、纤维蛋白原水平等,并非单纯反映阿加曲班的抗凝效果[16]。但是Rajsic等[17]的分析指出APTT与儿童VA-ECMO的血栓事件缺乏相关性。提示不能单纯以APTT为指导,而应该综合分析各种凝血指标。本研究主要监测APTT,并结合ACT、D二聚体和血栓弹力图等指标,指导阿加曲班抗凝剂量的调整和血制品输注。发现APTT和ACT存在分离现象,即APTT基本达标后,ACT明显延长,可能与患儿的血小板数量低下有关。更换阿加曲班抗凝后,总体上血小板有所提升,但ECMO管路和氧合器寿命未见延长,且血制品输注量(主要是血浆、血小板)未见减少,与相关研究结果不一致[18],考虑可能与更换阿加曲班过晚有关。因为当前期肝素抗凝效果差时,ECMO环路或机体内可能已存在不同程度的微血栓,势必会造成凝血底物和血小板的持续消耗,形成恶性循环,此时更换阿加曲班也很可能无法逆转这一影响。同时,感染的控制情况和DIC状态也可能影响后续的抗凝效果。此时,积极输注血制品,重建凝血平衡和及时更换ECMO环路是必须但又迫不得已的选择。值得注意的是,有研究显示在应用较高剂量直接凝血酶抑制剂时,特别是HIT后使用直接凝血酶抑制剂,APTT对直接凝血酶抑制剂剂量呈非线性反应,即“平台效应”[19-20]。病例3使用阿加曲班抗凝时间长(约35 d),后期需更高的剂量[0.5~1 μg/(kg·min)至1.5~3 μg/(kg·min)]以维持APTT达标,提示临床中应警惕这种“平台效应”,及时调整药物剂量。鉴于高剂量阿加曲班下APTT的“平台效应”,稀释凝血酶时间(diluted thrombin time,dTT)可能是监测直接凝血酶抑制剂血药浓度的可靠指标,与APTT相比,dTT与直接凝血酶抑制剂剂量的相关性更强,有更稳定的剂量反应性[21],为今后阿加曲班的抗凝监测提供了新思路。
综上所述,本研究通过5例ECMO儿童阿加曲班的抗凝经验总结,初步认为当AT3低下、肝素抗凝效果欠佳或可疑HIT时,应果断及时更换阿加曲班抗凝,并以小剂量[(0.1~0.4 μg/(kg·min)]起步,随后根据患儿体重和凝血指标综合分析调整。鉴于婴幼儿AT3普遍低下,初始便选用阿加曲班抗凝是值得探索的方向。
