荧光淬灭剂TrueBlack Lipofuscin对珊瑚自体荧光的消除及其在免疫荧光标记中的应用
2023-08-09赖庆娜陈建明
赖庆娜,王 路,陈建明
(闽江学院、福建省海洋生物多样性保护与永续利用重点实验室,福建 福州 350108)
免疫荧光标记技术(Immunofluorescence Labeling Technology)是抗原-抗体反应与荧光素标记技术结合,用于检测抗原或抗体的方法,在荧光显微镜下,可以直接观察呈现特异荧光的抗原-抗体复合物及其存在的位置[1]。为了能够更加完好的保存抗原的免疫活性,常采用冰冻切片的方法对组织进行切片处理[2]。目前免疫荧光标记与冷冻切片技术的联合使用已经较为广泛和成熟,尤其是应用在活体荧光、脂质的表达和细胞膜抗原等方面[3]。然而,在组织切片中,自体荧光(autofluorescence,AF)常常干扰特定荧光信号的检测,已成为干扰免疫荧光染色和数据分析的常见问题。自体荧光是由于内部组织成分或外部处理导致组织在广泛的激发和发射光谱中自然发出的荧光,是组织或细胞样本在荧光检测过程中产生的与目的信号无关的背景荧光信号[4]。有些机体能够自然发出多个波长的荧光,跨越许多常用荧光报告物的发射光谱和激发光谱,包括抗体、染料、着色剂、探针和转基因蛋白质,使得特异性荧光和自体荧光很难被区分[5]。
珊瑚纲作为腔肠动物中最大的一个纲,具备先天免疫能力,对环境变化和压力胁迫具有一定的抗逆性,可通过复杂的细胞识别系统识别非自我组分并启动下游信号通路,最终产生免疫反应,如吞噬作用、凝血反应和抗菌防御等[6]。因此珊瑚是研究腔肠动物乃至无脊椎动物对环境应激反应的良好研究对象。珊瑚自体荧光来源主要包括共生虫黄藻(Symbiodinium)叶绿素、自身携带的荧光蛋白及其他衍生物产生的背景荧光[7-8]。虫黄藻叶绿素的激发光谱为488 nm,发射光谱为650~690 nm[9],较易激发自体荧光,这显著影响了珊瑚在免疫荧光标记实验中对特异性荧光的判断,而最简单有效的方法是通过避免激发自体荧光来减少非特异荧光的产生[10],但是目前在免疫荧光标记实验中很少有体外荧光基团能够提供与自发荧光基团完全不同的发射光谱[11]。这就限制了珊瑚冰冻切片免疫荧光实验效果,干扰抗体标记的目的蛋白荧光的观察[12]。
围绕这个问题,本研究以花伞软珊瑚(Xeniasp.)为研究对象,此种珊瑚因其快速的生长能力及高质量的基因组而广受关注,被认为是研究生态环境的良好模式生物[13]。此种珊瑚据研究并不含有荧光蛋白[14],但是仍存在明显的自体荧光,并且目前针对软珊瑚自体荧光的淬灭尚未查找到相关报道。已有的珊瑚免疫荧光实验中常采用酒精脱水的方法去除自体荧光[15],不仅费时费力,而且对于花伞软珊瑚自体荧光淬灭效果较差。本研究首次尝试在花伞软珊瑚冰冻切片免疫荧光染色中,使用一种在小鼠和人体组织切片中常用的TrueBlack Lipofuscin自体荧光淬灭剂[16-17](下文简称TrueBlack),并与已有研究中的酒精梯度脱水法进行比较,发现TrueBlack可以去除花伞软珊瑚自身以及虫黄藻叶绿素在内所产生的自发荧光,有效消除免疫荧光实验中的自体荧光干扰。本研究可为珊瑚后续的机理研究以及腔肠动物的研究提供新的技术支持。
1 材料与方法
1.1 珊瑚的培养
将花伞软珊瑚培养于循环海水水族箱中,设置水族箱中的海水温度为(25±1) ℃,盐度为32~35,pH=8.1。珊瑚养殖使用HQI-10000K金属卤化物灯(BLV-Nepturion)提供有效光辐射强度(PAR)180 μmol/(m2·s),光暗周期为12 h∶12 h[18]。
1.2 免疫组化切片染色
将珊瑚水螅体置于4%(体积分数,下同)的多聚甲醛中4 ℃过夜固定,PBST缓冲液清洗3次。将珊瑚组织块置于OTC中包埋,然后用冰冻切片机切片,切片厚度为6 μm。冰冻切片由PBS缓冲液清洗3次。0.25%Triton-X渗透10 min后再用PBS缓冲液清洗3次。用70%酒精将TrueBlack(cat:23007,Biotium)稀释成20×的工作液,将组织切片放置于TrueBlack工作液中孵育2~5 min后用PBS缓冲液清洗3次。组织切片在常温下用GB缓冲液封闭1 h[GB缓冲液:PBS;10%山羊血清;10% BSA;10 mmol/L NaN3]后,一抗[包括Lamp2a(cat:18528,abcam)、DM1a(cat:7291,abcam)、Tgn38(cat:166594,santacruze),使用GB缓冲液按1∶500(体积比,下同)稀释]4 ℃下避光孵育24 h。再用PBS缓冲液清洗3次。二抗[包括鼠抗(cat:S0100,兰博利德)和兔抗(cat:S0101,兰博利德)]使用TBS按1∶1 000稀释。常温孵育1 h后再用PBS缓冲液清洗3次。DAPI(工作液浓度为0.5 μg/ml)染色10 min,用PBS缓冲液清洗3次。最后用80%甘油封片,激光共聚焦显微镜SP8(Leica,德国)拍片。
1.3 酒精梯度脱水法
切片渗透处理后进行逐步洗脱,洗脱步骤和顺序如下:首先用50%酒精浸泡2 h,然后用70%酒精4 ℃过夜,再用95%酒精浸泡20 min,最后用100%酒精浸泡20 min。酒精脱水后用PBS缓冲液清洗后封片拍片[13]。
1.4 蛋白提取
用液氮研磨样品至粉末状(样品重量约0.1~0.2 g),用1 mL TRIzol快速覆盖冷粉末,添加研磨珠并在4 ℃下漩涡10~20 min。向样品中加入总体积1/5的氯仿,用力摇晃样品1 min,室温下静置5 min。4 ℃下,10 000 r/min旋转样品15 min。去除剩余的RNA水相。向剩余的有机层中添加0.3 mL 100%酒精,混匀样品,并在室温下放置2~3 min。4 ℃下4 000 r/min离心样品1 min沉淀DNA,取上清液加入1.5 mL异丙醇沉淀蛋白质,将样品在室温下放置10 min。在4 ℃下,将样品10 000 r/min离心10 min。去除上清液,并用0.3 mol/L盐酸胍溶液洗涤蛋白质颗粒两次。然后在4 ℃下离心5 min。用95%酒精加2.5%甘油混合液洗涤蛋白质两次。蛋白颗粒风干不超过10 min后将其溶解在样品缓冲液[2%(质量分数) SDS、2% 2-巯基乙醇、10%甘油、0.062 5 mol/L Tris-HCl、pH=6.8]中。
1.5 Western blot方法
收集到的蛋白样品,用BCA蛋白浓度测定试剂盒(B5000-500T,兰博利德)测定每个蛋白样品的蛋白浓度。在收集的蛋白样品中加入适量浓缩的SDS-PAGE蛋白上样缓冲液。电泳浓缩胶时使用低电压(80 V)恒压电泳,而在溴酚蓝进入分离胶时使用高电压(120 V)恒压电泳。溴酚蓝到达胶的底端处附近即可停止电泳。浸润和活化PVDF膜,设定转膜电流为300~400 mA,转膜30~60 min。转膜完毕后,立即把蛋白膜放置到预先加入的Western洗涤液中,漂洗1~2 min,以洗去膜上的转膜液。加入Western封闭液,在摇床上缓慢摇动,室温封闭60 min。去除封闭液,立即加入稀释好的一抗,4 ℃缓慢摇动孵育过夜。去除一抗后,立即加入稀释好的二抗,室温或4 ℃在侧摆摇床上缓慢摇动孵育1 h。ECL(enhanced chemiluminescence)显影,检测蛋白。
1.6 荧光强度计算方法和数据处理
使用莱卡SP8软件计算每一张切片的荧光强度。P<0.05表示具有差异显著。
2 结果与讨论
2.1 TrueBlack消除自体荧光效果
本研究首先尝试使用TrueBlack孵育,与传统酒精脱水的方法比较两种方法去除自体荧光的效果。图1为本研究中所使用的花伞软珊瑚明场下的放大图。图2为各荧光通道下TrueBlack法与酒精脱水法处理的珊瑚冰冻切片自体荧光去除效果比较。如图2所示,对照组在任何通道中都存在明显的自体荧光,在Cy5中可以清楚地观察到虫黄藻叶绿素产生的自发荧光。对每张切片采集5个视野,对图片进行自发荧光强度统计,结果如图3所示。酒精处理组和对照组相比,自体荧光有一定程度降低,酒精处理组各通道检测到的自体荧光强度平均值比对照组低57.2%(DAPI:57%,FITC:44.5%,RHOD:52.3%,TRed:81.4 %,Cy5:50.9%),但是仍可以明显观察到虫黄藻叶绿素自发荧光(图2中箭头指向部分)。与对照组和酒精处理组相比,TrueBlack处理组各通道检测到的自体荧光强度平均值比酒精处理组低52.4%(DAPI:50.7%,FITC:49.5%,RHOD:50.0%,TRed:52.2%,Cy5:59.6%),检测到的样品自体荧光最少,并且TrueBlack处理后,在不同通道下几乎检查不到虫黄藻叶绿素的荧光信号。由此判断,现有的珊瑚免疫组化研究中常采用的酒精脱水方法,并不能高效去除花伞软珊瑚的自体荧光,而使用TrueBlack处理样品则可显著消除花伞软珊瑚冰冻切片自体荧光。
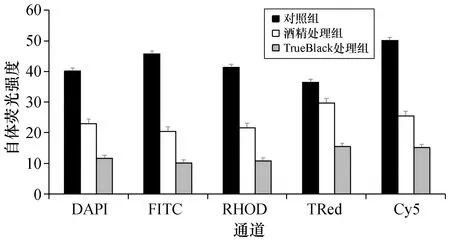
图3 各荧光通道下TrueBlack法与酒精脱水法处理的珊瑚冰冻切片自体荧光强度统计Fig.3 Autofluorescence intensity statistics of coral frozen sections treated with TrueBlack method and alcohol dehydration method under different fluorescence channelsP<0.05。
2.2 TrueBlack对特异性免疫荧光标记的影响
冰冻切片通过荧光标记对样品中待测抗原或抗体进行定性、定位和定量检测,因此需要探究TrueBlack是否会影响冰冻切片特异性免疫荧光标记。由于二抗普遍存在非特异性荧光干扰的情况[19],所以首先排除二抗非特异性荧光干扰。将软珊瑚冰冻切片渗透处理后TrueBlack孵育5 min,实验组分别由羊抗鼠(S0100)和羊抗兔(S0101)二抗孵育处理,对照组仅用配置羊抗鼠和羊抗兔的TBS缓冲液孵育处理(图4),对每张切片采集5个视野,对图片进行自发荧光强度统计(图5)。从图4和图5可以看出在各通道下实验组和对照组的荧光强度无显著差异,可排除二抗的非特异性干扰,同时在两个信号通路中,发现Cy5通道对二抗非特异性荧光的去除效果最好。另外珊瑚荧光蛋白的发射光谱和激发光谱如表1[20]所示,Cy5通道的激发光谱波段为630~650 nm,发射光谱波段为660~670 nm,这两个波段和表1中珊瑚荧光蛋白的激发光谱错开,对于其他珊瑚而言,Cy5通道还可能避免珊瑚荧光蛋白自体荧光的干扰。

表1 珊瑚荧光蛋白的激发光谱和发射光谱Tab.1 Excitation and emission spectra of coral fluorescent protein

图5 二抗对TrueBlack处理的珊瑚冰冻切片的自体荧光强度统计Fig.5 Statistics of the second antibody on the autofluorescence intensities of TrueBlack treated coral frozen sections P<0.05。
排除二抗非特异性荧光干扰后,选择3个对花伞软珊瑚特异性较强的一抗标记[Lamp2a、DM1a、Tgn38],对照组只做了DAPI处理,不做抗体处理,对照组和实验组在染料或者抗体处理之前都经过TrueBlack孵育5 min。从图6可以发现,3个实验组背景荧光和自体荧光基本去除。对每张切片采集5个视野,对图片进行自发荧光强度统计,其结果如图7所示,特异性荧光信号强度平均高于对照组205.3%,其中Lamp2a高出128.6%,DM1a高出304.3%,Tgn38高出183%。为进一步验证实验组中一抗和二抗为特异性标记,如图8所示,取这3种蛋白做Western blot验证。实验表明本研究中的抗体与抗原为特异性结合,免疫荧光信号来源于特异性标记荧光信号。

图7 TrueBlack处理的珊瑚冰冻切片抗体特异性荧光强度统计Fig.7 Statistics of antibody specific fluorescence intensity in TrueBlack treated coral frozen sections 柱状图从左往右对应图6(e)、(f)、(g)、(h)的荧光强度,P<0.05。

图8 Western blot验证抗体特异性Fig.8 The specificity of the antibody was examined by Western blotM:蛋白质电泳的标准蛋白 Marker,1:Lamp2a,2:DM1a,3:Tgn38。
2.3 讨论
免疫荧光技术中自体荧光的干扰在生物界相当普遍,如在鞭毛虫、腔肠动物、多毛类、甲壳类与鱼类中,而对切片自体荧光的去除无疑为样品进一步的组化研究提供了更好的保障。为了得出可靠有效的实验数据,科学家们尝试采用不同的方法来消除或抑制自体荧光,主要包括化学还原剂、光漂白和荧光淬灭剂。其中,化学还原剂主要针对醛与胺形成的化合物,但是化学还原剂在中性pH环境中不稳定,使得实验结果的可重复性低[21]。光漂白方法需要将样品长时间暴露于紫外光下,极易发生不可逆的光氧化,不能用于已经表达荧光的样品,且实验耗时较长,需要特定的仪器设备[22]。常用的荧光淬灭剂包括苏丹黑B、台盼蓝和乙醇胺等,主要通过与发光成分结合吸收入射光而降低自体荧光,但是苏丹黑B针对不同组织时,浓度及处理时间均需要摸索,较为耗时[23];台盼蓝只在488 nm激发光下才能消除自体荧光[24];乙醇胺消除自体荧光的效果较不佳[25],因此稳定可靠的成品试剂成为消除自体荧光的新选择。
本研究中所使用的花伞软珊瑚,已有科学家通过将其再生和单细胞RNA测序耦合,观察到内共生细胞的动态谱系进展,这不仅有助于揭示不同珊瑚吸收或失去内共生体的共同原理[15],也预示着在组装拼接的高质量基因组和转录组数据库研究背景下,花伞软珊瑚很可能成为研究内共生、快速生长等方面的潜在模式生物。这就急需建立成熟稳定的生物学技术以供研究使用。而TrueBlack法与酒精梯度脱水法相比,一方面保留了酒精脱水的优点,TrueBlack在使用前需要用70%的酒精溶解,所以TrueBlack工作液中含有酒精,有助于切片脱水彻底,另一方面又弥补了酒精脱水法对珊瑚自体荧光消除不显著的不足,尤其在去除虫黄藻叶绿素自发荧光方面,不仅简化了实验步骤,缩短实验时长,同时还降低了样品变形和细胞损失的可能性。总而言之,TrueBlack以其高效、便捷、可重复强等优势成为消除珊瑚自体荧光的理想选择。
值得注意的是,在已有研究中,TrueBlack是被设计用于淬灭脂褐质产生的自体荧光,脂褐质是免疫细胞在衰老、吞噬过程中在胞质内产生的沉积物[26],TrueBlack利用其疏水性有效结合富含脂质的脂褐质,吸收入射光而减少自体荧光的产生。同时也指出这款自体荧光淬灭剂对其他组织如诱导的荧光或者胶原质或弹性蛋白的内源荧光等自体荧光的降低没有显著效果。珊瑚虽然脂质含量较高[27],但是目前尚未有报道称珊瑚中含有脂褐质,且脂褐质主要存在于脊椎动物中[28]。有报道称软珊瑚中含有多种活性物质[29],猜测珊瑚体内可能存在与脂褐质类似的富含脂质的物质,而这种物质在免疫过程中可能扮演一定角色值得深入挖掘。TrueBlack高效去除珊瑚冰冻切片中自体荧光的能力或许可以为后续珊瑚的免疫研究提供新的思路。
3 结论
本研究发现使用荧光淬灭剂TrueBlack后,花伞软珊瑚组织切片中的自体荧光强度是传统的酒精梯度脱水法的52.4%,在珊瑚免疫荧光标记实验中TrueBlack实验组的特异性荧光强度为对照组的205.3%,并且珊瑚内虫黄藻叶绿素自发荧光也有较好的去除效果。由此推测TrueBlack与传统的珊瑚自体荧光去除方法相比,效果更佳。TrueBlack具有高效、便捷、可重复强等优势,或许将成为消除珊瑚自体荧光的新手段。
