拟穴青蟹MnSOD基因的克隆及表达分析
2023-08-09钟锦英傅明骏曾宪源王艺磊
钟锦英,傅明骏,曾宪源,王艺磊*
(1.集美大学水产学院,农业部东海海水健康养殖重点实验室,福建 厦门 361021;2.龙岩学院生命科学学院,福建 龙岩 364012)
氧化应激是指生物体内氧化与抗氧化作用失衡的一种状态。线粒体电子传递过程中产生活性氧(reactive oxygen species,ROS)。吞噬细胞的激活也可以刺激ROS的产生,这被称为呼吸爆发活动(respiratory burst)。当ROS产生的数量过多,机体抗氧化系统的平衡被打破后,会造成一系列的氧化应激损伤,如脂质过氧化、蛋白质失活和DNA的损伤等。因此,生物体建立起抗氧化系统来中和ROS的有害影响。
MnSOD可以使有氧呼吸的生物免受呼吸过程中产生的氧自由基的侵害,对于维持细胞的氧化平衡非常重要。根据定位的不同,MnSOD有两种类型,线粒体MnSOD(mtMnSOD)和细胞质MnSOD(cytMnSOD)[2-3]。mtMnSOD在真核细胞的线粒体、细胞质及细菌中都有发现,而cytMnSOD只在甲壳动物中发现。目前已经在甲壳动物如日本囊对虾(Marsupenaeusjaponicus)、中华绒螯蟹(Eriocheirsinensis)和中国明对虾(Fenneropenaeuschinensis)等中鉴定出许多MnSOD的同源物。已有研究表明,MnSOD在日本囊对虾[4],中华绒螯蟹[5]和中国明对虾[6]等甲壳动物的免疫调节中起到重要的作用。MnSOD被确定为参与超氧化物歧化酶链中的第一个成员[7]。已发现肽聚糖(peptidoglycan,PGN)[8]、副溶血弧菌(Vibrioparahemolyticus)[9-11]、ROS[12]、聚肌苷酸胞苷酸(polyinosinic-polycytidylic acid Poly I:C)[8]等可以上调MnSODs基因的表达。有研究还发现,在卵子发生和胚胎发育过程中,甲壳动物和鱼类的SOD的活性都呈现增加的趋势,这表明SOD基因在性腺的发育过程中发挥着重要的作用[13]。至今,从无脊椎动物到脊椎动物,已有许多关于MnSOD的研究报道。但是在虾蟹等甲壳动物中,关于MnSOD的研究尚显薄弱。
拟穴青蟹(Scyllaparamamosain)是我国海洋养殖产量最高的海水蟹类。青蟹的养殖面临抱卵率及成活率低、容易受环境影响而产生氧化应激等问题。本研究从拟穴青蟹性腺EST文库中获得SpmtMnSOD和SpcytMnSOD基因片段,运用RACE-PCR方法获得基因全长,并利用生物信息学的方法对其进行预测分析,运用实时荧光定量PCR技术分析MnSOD基因在不同组织、性腺发育过程以及在副溶血弧菌、PGN和Poly I:C诱导后的表达谱,为深入了解拟穴青蟹MnSOD基因在性腺发育和免疫应激中的作用奠定基础。
1 材料和方法
1.1 实验材料
拟穴青蟹购买自漳州市漳浦青蟹养殖场。按照性腺指数(gonado-somatic index,GSI)对其性腺发育进行分期,参照本实验室前期的方法将雄蟹性腺发育分为3个时期,雌蟹性腺发育分为6个时期[14]。经冰水浴麻醉后,取心、肝胰腺、血淋巴、鳃、肌肉、精巢、卵巢、脑神经节和胸神经节等放入RNA later中,后转存于-20℃冰箱中保存,用于后续基因表达实验。
选取体重100~120 g的青蟹,在海水养殖场暂养,每天喂食新鲜花蛤。7天后,取活力强的个体进行注射,开展动物应激实验。将青蟹分为4组:对照组(SP)注射50 μL生理盐水;实验组分别为注射50 μL的PGN(69554,fromBacillussubtilis1 mg/mL,Sigma)组、50 μL的Poly I:C(P9582,1 mg/mL,Sigma)组、50 μL的副溶血弧菌(1×106CFU/mL)组。均从青蟹游泳足基部进行注射,注射3、6、12、24 h后取肝胰腺、血细胞和鳃(n=5),方法如上所述。
1.2 总RNA的提取、逆转录及SMART-RACE扩增cDNA全长
采用Trizol 试剂(Invitrogen)提取样品的总RNA,采用M-MLV逆转录酶(Promega)将总RNA逆转录成cDNA。以3′和5′RACE cDNA 第一条链为模板,利用RACE特异引物(GSP1和GSP2,表1)和试剂盒通用引物(UPM和NUP)进行两轮PCR。PCR的扩增条件根据RACE试剂盒(Takara)的说明书来操作。将3′和5′RACE 扩增的目的产物送往上海生工生物工程有限公司测序。将已知的EST 序列、5′RACE序列和 3′RACE 序列进行拼接,得到基因的全长cDNA序列。
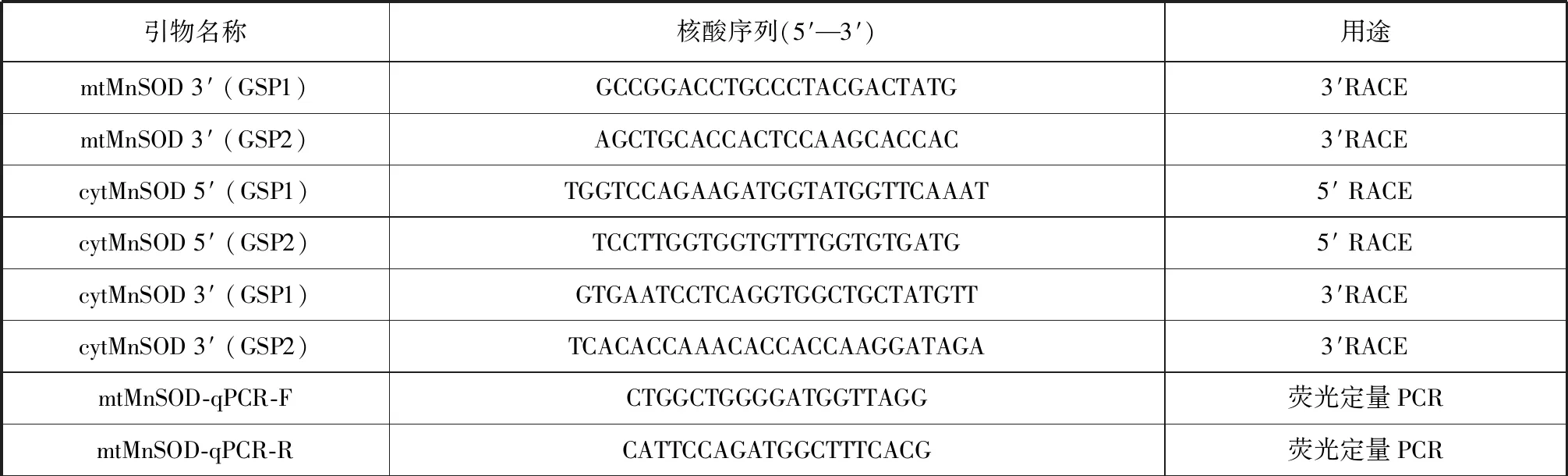
表1 本研究所使用的引物Tab.1 Primers used in this study
1.3 生物信息学分析
基因序列特征所使用的生物信息学软件均参照文献[14]进行。
1.4 实时荧光定量PCR
精卵巢各发育阶段的定量实验以18S rRNA为内参基因,各组织的表达和刺激后的定量实验以EF-1α为内参基因。反应体系:5 μL 2× Realtime PCR Master Mix(Takara),0.25 μL正向引物F(10 μmol/L),0.25 μL反向引物R(10 μmol/L),4.5 μL cDNA第一条链。定量反应条件为:95 ℃ 1 min;95 ℃ 20 s,60 ℃ 20 s,72 ℃ 20 s,40个循环。每组5只青蟹。根据定量PCR仪给的CT值,计算2-ΔΔCT值,基因表达水平表示为2-ΔΔCT的平均值 ± 标准误差的平均值,用SPSS 21.0软件对数据进行分析,使用单因素方差分析(ANOVA)组间的差异性,P<0.05表示具有显著性差异。
2 结果与讨论
2.1 MnSODs基因的全长克隆和序列分析
本研究克隆获得了2个拟穴青蟹MnSOD基因(SpmtMnSOD和SpcytMnSOD)的cDNA全长序列。SpmtMnSODcDNA(GenBank登录号:FJ605170)序列全长为1 154 bp,包括33 bp的5′ UTR、657 bp的ORF和464 bp的3′ UTR(包含polyA部分)。软件预测显示其编码218个氨基酸,包含16个氨基酸的信号肽序列,蛋白分子量约为24.18 kDa,等电点约为7.09。SpcytMnSODcDNA(GenBank登录号:GU213434)序列全长为1 184 bp,包括92 bp的5′ UTR、861 bp的ORF和231 bp的3′ UTR(包含polyA部分)。软件预测显示其编码286个氨基酸,无信号肽序列,位于细胞质中,蛋白分子量约为31.33 kDa,等电点约为6.31。根据结构预测(图1、2),SpmtMnSOD和SpcytMnSOD蛋白序列都包含有1个MnSOD 特征序列,分别为180DVWEHAYY187和243DVWEHAYY250;4个锰结合位点,分别为(H48、H96、D180、H184)和(H110、H158、D243、H247);3个丝氨酸磷酸化位点,分别为(S50、S104、S124)和(S19、S40、S190);4个酪氨酸磷酸化位点,分别为(Y31、Y56、Y190、Y197)和(Y7、Y47、Y118、Y277)。此外,SpmtMnSOD 可能存在1个苏氨酸(T8)磷酸化位点和3个N-豆蔻酰化基序列 (GGHINH、GSVENM、GSGWGW,图1)。

图1 拟穴青蟹SpmtMnSOD cDNA序列和推导的氨基酸序列Fig.1 cDNA and deduced amino acid sequence of SpmtMnSOD from Scylla paramamosain下划线为信号序列(氨基酸残基1~16),加框(180DVWEHAYY187)为MnSOD的特征序列,加粗及灰色背景(H48、H96、D180、H184)推测为Mn结合位点。

图2 拟穴青蟹SpcytMnSOD cDNA序列和推导的氨基酸序列Fig.2 cDNA and deduced amino acid sequence of SpcytMnSOD from S. paramamosain加框(243DVWEHAYY250)为MnSOD蛋白的特征序列;加粗及灰色背景(H110、H158、D243、H247)推测为Mn结合位点。
2.2 拟穴青蟹SpmtMnSOD和SpcytMnSOD在各组织中的表达特性
以EF-1α为内参基因,实时荧光定量PCR结果显示,SpmtMnSOD和SpcytMnSOD基因在各组织的表达存在明显差异。SpmtMnSOD基因在心脏的表达量最高,其次是鳃、卵巢和肝胰腺,其余组织的表达量较低[图3(a)]。SpcytMnSOD基因在肝胰腺的表达量最高,其次是卵巢、心脏和鳃,其余组织的表达量较低[图3(b)]。

图3 SpmtMnSOD和SpcytMnSOD在各组织中的表达情况Fig.3 Expression of SpmtMnSOD and SpcytMnSOD in different tissuesSpmtMnSOD和SpcytMnSOD都是将血中的表达水平设为1倍,柱上不同字母代表具有显著性差异(P<0.05)。
2.3 拟穴青蟹SpmtMnSOD和SpcytMnSOD在性腺各发育期的表达
以18S rRNA为内参基因,在卵巢发育的各阶段,SpmtMnSOD和SpcytMnSOD基因在O6期(完全成熟期)的表达量显著高于卵巢其它发育阶段(P<0.05)。在精巢发育的不同阶段,SpmtMnSOD和SpcytMnSOD的表达量都低,虽然呈上升趋势,但并无显著性差异(P>0.05,图4)。
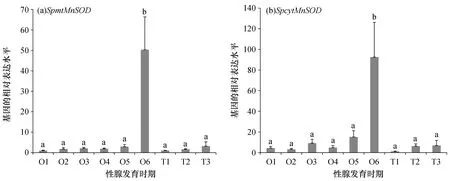
图4 SpmtMnSOD和SpcytMnSOD在性腺各发育期的表达谱Fig.4 Expression profiles of SpmtMnSOD and SpcytMnSOD during different stages of gonad developmentalO1至O6为卵巢各发育时期:O1为增殖期;O2为卵黄发生前期;O3为卵黄发生初期;O4为卵黄发生中期;O5为卵黄发生晚期;O6为完全成熟期;T1至T3为精巢各发育时期:T1为精原细胞期;T2为精母细胞期和精子细胞期;T3为成熟精子期;SpmtMnSOD和SpcytMnSOD都是将T1的表达水平设为1倍,柱上不同字母代表具有显著性差异(P<0.05)。
2.4 拟穴青蟹SpmtMnSOD和SpcytMnSOD在副溶血弧菌、PGN和Poly I:C刺激下的表达
在副溶血弧菌感染后(图5),SpmtMnSOD在12 h鳃中的表达量是对照组的2.0倍[P<0.05,图5(c)],在肝胰腺和血中变化不明显[图5(a)、(e)];SpcytMnSOD的表达量在12 h肝胰腺中是对照组的1.6倍[P<0.05,图5(b)],在3 h和12 h时的鳃中分别是对照组的1.8倍和2.4倍[P<0.05,图5(d)],在血中变化不明显[图5(f)]。

图5 肝胰腺、鳃和血中的SpmtMnSOD和SpcytMnSOD分别在副溶血弧菌(Vp)、PGN和Poly I:C刺激后的表达谱Fig.5 Expression profiles of SpmtMnSOD and SpcytMnSOD in hepatopancreas,gill and haemocytes after V. parahaemolyticus,PGN and PolyI:C challenge注射生理盐水(SP)组为对照组,“*”表示3、6、12、24 h的实验组与相应时间的对照组之间的显著性差异(P<0.05)。
在PGN刺激后,SpmtMnSOD的表达量在3、6、12 h时的肝胰腺中显著上升,分别是对照组的2.9、3.9、3.3倍[P<0.05,图5(a)],在鳃和血中的表达量虽有所上升,但未达到显著性差异(P>0.05);SpcytMnSOD的表达量在3、6、12 h时的肝胰腺中分别是对照组的1.8、1.6、2.7倍[P<0.05,图5(b)],在6、24 h时的鳃中分别是对照组的1.4、1.7倍[P<0.05,图5(d)],在6、12 h时的血中分别是对照组的4.0、2.8倍[P<0.05,图5(f)]。
在Poly I:C刺激后,SpmtMnSOD的表达量在6 h和12 h时的肝胰腺中分别是对照组的2.2倍和1.2倍[P<0.05,图5(a)],在3 h和6 h时的鳃中分别是对照组的5.1倍和2.4倍[P<0.05,图5(c)],在3 h和6 h时的血中分别是对照组的2.8倍和2.2倍[P<0.05,图5(e)];SpcytMnSOD的表达量在12 h时的肝胰腺是比对照组的2.9倍[P<0.05,图5(b)],在6 h和12 h时的鳃中分别是对照组的1.7倍和1.9倍[P<0.05,图5(d)],在3 h和6 h时的血中分别是对照组的2.1倍和2.0倍[P<0.05,图5(e)]。
2.5 讨论
2.5.1 拟穴青蟹SpmtMnSOD和SpcytMnSOD基因的序列特征及组织表达特性
SOD普遍存在于需氧生物体内,是机体抗氧化系统的第一道防线,能有效清除机体产生的过量超氧阴离子,保持机体内自由基代谢平衡,防御机体受到氧化损伤[1,15]。本实验从拟穴青蟹克隆获得2种MnSOD的cDNA全长,分别为SpmtMnSOD和SpcytMnSOD。MnSOD特征序列在拟穴青蟹SpmtMnSOD和SpcytMnSOD蛋白序列中均有发现,分别为180DVWEHAYY187和243DVWEHAYY250,保守的Mn离子结合位点在这2个蛋白序列中都存在,通过同源比对发现MnSOD在脊椎动物和无脊椎动物中的保守性都很高。荧光定量PCR的结果显示青蟹中SpmtMnSOD和SpcytMnSODmRNA普遍表达于各组织中,表明它们可能参与清除各种正常生理过程所产生的ROS和活性氧中间体(ROI)。青蟹SpmtMnSOD和SpcytMnSOD的mRNA在心脏的表达水平高于其他组织。在小鼠中活性氧ROS的产生增加和抗氧化物的储备量的下降等会引起心肌的梗死[16],推测SOD基因在保护心脏免受氧化应激起到重要的作用。
SpmtMnSOD和SpcytMnSOD的mRNA表达水平在卵巢、肝胰腺和鳃中的表达水平较高,这一结果与克氏原螯虾(Procambarusclarkii)和中华绒螯蟹鳃和肝胰腺中的表达相似[5,17-18]。在凡纳滨对虾(Litopenaeusvannamei)中,cytMnSOD在鳃和附肢的表达量相对较高[19],然而在日本囊对虾中,mtMnSOD和cytMnSOD在各组织的表达相对一致[4]。表达量的不同可能与物种差异以及各组织所执行的功能有关。卵巢在发育过程中需要积累大量的营养物质,这期间会产生大量的ROS,为了氧化还原系统的稳定性,需要大量的SODs来清除超氧自由基。有研究发现人体中抗氧化酶在卵母细胞成熟阶段高表达,这种储备可能是用于胚胎的发育[20]。这可能也是SpmtMnSOD和SpcytMnSOD在青蟹成熟的卵巢中表达量较高的主要原因。肝胰腺不仅是营养物质和脂类储存的主要场所,还是虾蟹生理活动的中心,因此需要一个较为完善的抗氧化系统来保证肝胰腺中物质和能量代谢的正常进行[21]。鳃的主要功能是呼吸作用,其呼吸上皮细胞内富含线粒体,呼吸过程会产生大量ROS;另一方面,鳃容易暴露于外界环境中,在外界环境各种因子的作用下也容易产生自由基以损害机体,因此,需要SODs清除过多的自由基以维持其体内自由基的动态平衡[21]。
2.5.2 拟穴青蟹SpmtMnSOD和SpcytMnSOD基因在应对副溶血弧菌、PGN和Poly I:C刺激下的免疫应激
无脊椎动物防御病原体主要依赖于先天免疫。先天免疫系统是由病原体触发的,并且是由模式识别蛋白(PRPs)介导。PRPs 可以识别入侵微生物表面的保守分子,如被确定为病原体相关分子模式(PAMPs)的副溶血弧菌、PGN和Poly I:C。PRPs与PAMPs的结合会触发一系列免疫反应,从而激活宿主免疫防御系统[22]。
先天性免疫防御系统的激活,会产生吞噬作用,这个过程会产生ROS,尽管适量的ROS会对宿主防御和信号传导有利,但是过量会产生氧化应激。对甲壳类动物的研究表明,MnSOD 对细菌或病毒的入侵表现出显著的反应[5,18]。鳃、肝胰腺和血细胞是甲壳类动物重要的免疫防御器官。在本研究中,青蟹在注射副溶血弧菌后,SpmtMnSOD和SpcytMnSOD的mRNA表达在鳃中都明显增加,这与副溶血弧菌侵入罗氏沼虾(Macrobrachiumrosenbergii)体内时,MnSOD的活性显著上升相一致[11]。副溶血弧菌感染后,SpcytMnSOD在肝胰腺中的表达上升,而SpmtMnSOD在肝胰腺的表达无明显变化,推测MnSOD在应对PAMPs 刺激的免疫防御中发挥了重要作用,二者不同可能是由于SpmtMnSOD本身在肝胰腺中就具有较高的活性,和/或较长的半衰期,足以应对副溶血弧菌的应激,所以其基因的表达没有明显的上升趋势。本研究中发现PGN刺激后,SpmtMnSOD的表达量在肝胰腺中显著上升,而SpcytMnSOD的表达量在肝胰腺、鳃和血中均有所增加,与孟凡伦等发现注射PGN可以提高中国对虾(Penaeuschinensis)的溶菌、抗菌、SOD活力的结果[23]相似,MnSOD表达量升高,推测其在青蟹的抗细菌感染中起到一定作用。
在Poly I:C刺激后,SpmtMnSOD和SpcytMnSOD的表达在肝胰腺、鳃和血中均有所增加,推测Poly I:C通过提高MnSOD活力,从而起到抗病毒感染的作用。血细胞中的呼吸爆发与SOD的表达已被广泛用于评估虾对病原体的防御能力[24]。血细胞对于无脊椎动物的先天性免疫反应极为重要,参与甲壳动物的细胞免疫和体液免疫,过量产生ROS可诱导溶酶体膜稳定性的退化,进而导致中华绒螯蟹血细胞数量减少[25];在凡纳滨对虾中,注射Poly I:C时,血细胞中的ROS表达增加,MnSOD基因的表达也上升[22],这与本研究中,血细胞中MnSOD基因的表达也是一致的。说明MnSOD基因在抗氧化应激和抗细菌、病毒感染中起到重要的作用。
3 结论
本研究发现拟穴青蟹SpMnSOD在性腺成熟期高表达,为卵子成熟和胚胎发育提供抗氧化防御作用。同时SpMnSOD的表达在应对外来病原菌入侵的不同时段表现为不同程度的升高,说明其参与了机体氧化还原系统的平衡,同时也参与了机体的先天免疫反应,在清除机体由免疫应激产生的过量的自由基中起到重要的作用。
