靶向超声造影技术及其在心血管疾病中的应用
2023-08-07吕昀徽王硕王小康郑晓冰陈皓生王欣崔永春
吕昀徽 王硕 王小康 郑晓冰 陈皓生 王欣 崔永春
1 超声造影剂的分类及其特点
超声造影剂是在超声成像中用来增强图像对比度的物质。一般为微米量级直径的包膜微气泡,核心成分多采用高分子量、低血液溶解度和低弥散度的氟碳气体[1]。根据超声造影剂囊膜成分将其分为脂质微泡、蛋白质微泡、聚合物微泡(PLGA)和表面活性剂微泡四类。
脂质体造影剂的壳膜分二棕榈酰磷酯酰胆碱(DPPC)和二硬脂酰磷脂酰乙醇胺(DSPE)两种。这类磷脂脂肪链长,高度饱和,柔韧性较强,在血液中寿命较长,脂类作为微泡的壳膜,虽不如高分子多聚物稳定,但其声学响应性好,形成的微泡易产生回波[2]。
第二类为蛋白质壳膜,这种壳膜以白蛋白为主,目前也常用溶菌酶、亲和素等生物活性蛋白。蛋白类造影剂稳定性较好、无毒、易制备。但其价格昂贵、热稳定性差。且该类造影剂内部气体与人血白蛋白混合后,容易引起过敏反应,严重会引起血压下降、休克,从而限制了其应用范围[2]。
此外,还有一些由乳酸-羟基乙酸共聚物、海藻酸盐、多聚糖等高分子材料通过其内部含有的高分子链的交联及交织作用构造而成的造影剂[3-4],这种造影剂生物相容性高,无毒性作用,可生物降解。并且拥有厚且机械强度高的聚合物外壳,这使得高分子材料造影剂在气体交换时不易坍塌,非常稳定,在水介质中可以储存数周。但因成像需较高的声学输出引起微泡的非线性振动,如毛细血管破裂、肺出血等[5]。
近期,有研究使用脂类、聚合物类、蛋白质氨基酸类等制作表面活性薄膜造影剂,表面活性物质既可减慢气体溶解,也可增加微泡的稳定性,其不足之处在于存放时间短且不宜包裹分子量小的气体。
新一代的超声造影剂应具有如下特点:(1)高安全性、低副作用,有明确的破坏阈值,有可预测性及可重复性,最终可降解或被较快地排出体外;(2)微泡大小均匀,足够小,小于红细胞的直径(7 μm),确保能通过肺毛细血管,进入动脉循环,达到造影效果而不会造成栓塞;(3)具有很强的散射特性,能产生丰富的谐波;(4)稳定性好,在血液内保留的时间允许超声成像显示其在组织内的灌注(增强)和廓清(消退)过程;(5)易于生产,便于储存,价格适宜。但是这种超声造影剂缺乏靶向性,不能长期停留在靶组织或靶器官中,导致在病变组织的血管显影中的停留时间较短,难以准确地诊断疾病。因此,人们研发出第三代靶向超声造影剂,通过微泡表面连接的特异性配体或抗体,与靶组织或靶器官相应的受体相结合从而实现靶向定位诊断或治疗,这已成为超声领域研究的热点[6]。
2 靶向超声造影剂
靶向超声造影剂大致结构如图1 所示。由三个基本结构单位构成:(1)以脂质、蛋白质、高分子多聚物或表面活性剂为主构成的壳膜;(2)内部填充一些氟碳气体;(3)外膜覆以特异性配体(多为抗体、多肽等)。靶向使超声造影微泡能够特异性结合并聚集于病灶部位,停留时间长;氟碳气体在水和血液中的溶解度较低,使其在血液中寿命较长,这些优点使靶向微泡聚集于目标组织或器官,降低生物毒性。还可实现药物定点释放、体内运输以及基因转染,增加局部浓度,减少其在非靶组织内聚集的毒性不良反应。
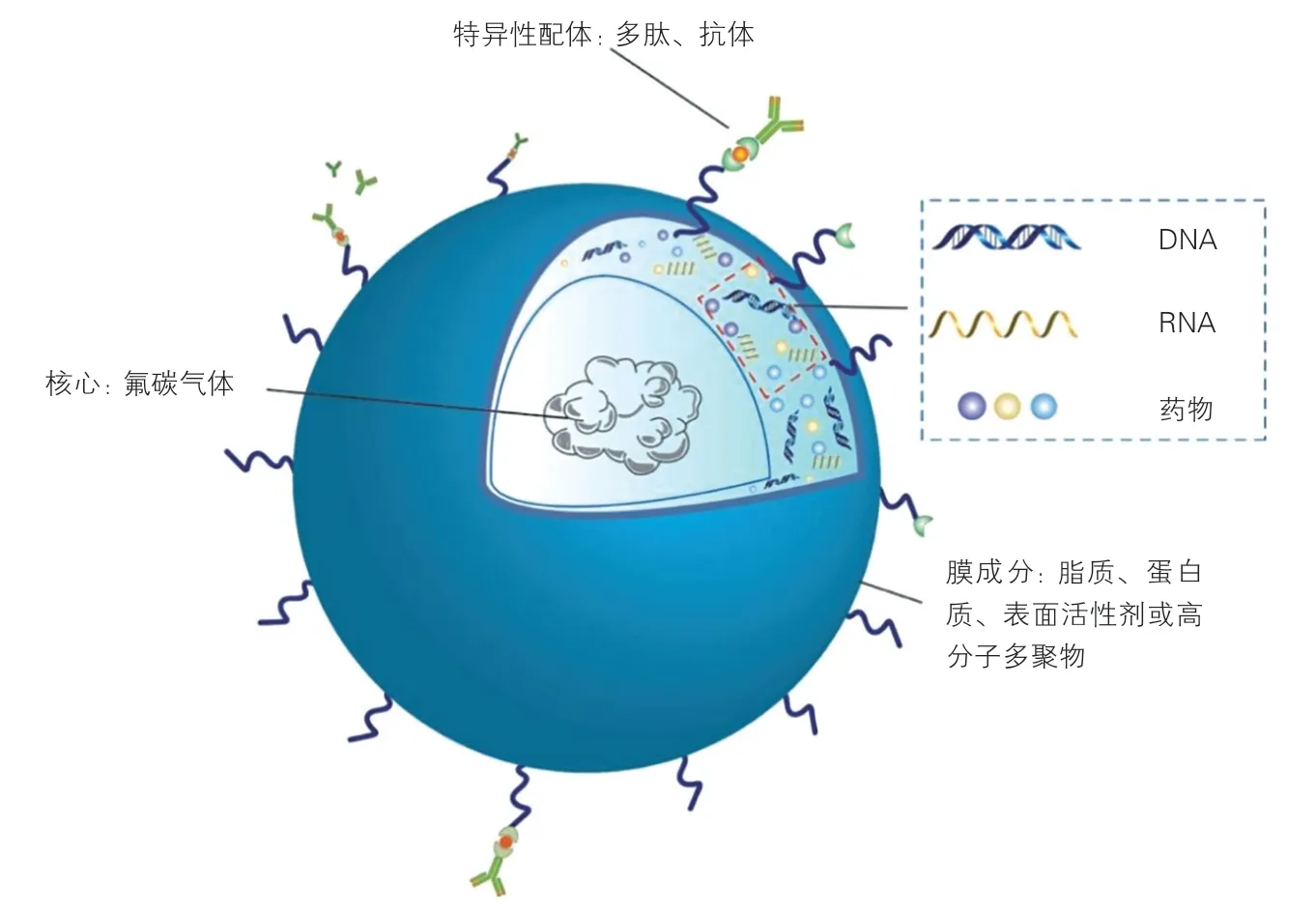
图1 靶向超声造影剂的结构示意图
制造靶向造影剂的关键步骤是将配体连于微泡表面,使其具有特异性结合靶器官或靶组织的能力。因此,选择合适的靶向配体是制备靶向性高、结合力强的靶向超声造影剂的关键。理想的配体应具备以下条件:(1) 高表达特异性;(2)高分泌性;(3)非免疫源性; (4)注入体内后高度稳定性;(5)高度耐受血流切应力等。
根据不同疾病表达的受体的特异性,选择的配体也各不相同。目前,国内外对不同心血管疾病特异性表达的受体均有所研究(表1):

表1 不同疾病的靶点及配体
(1)动脉粥样硬化、缺血再灌注损伤、移植排斥反应等引起的炎症中,E-选择素、P-选择素、细胞间黏附分子-1(ICAM-1)、血管内皮细胞黏附分子-1(VCAM-1)、连接黏附分子-A(JAM-A)[7-10]均可作为靶点,而配体多为抗上述靶点的单克隆抗体、寡糖基团、线性肽及糖蛋白等[11-13]。
(2)对于血栓而言,多肽是主要的配体,将一些5~10 个氨基酸的小片段多肽制备成靶向造影剂可以有很高的靶向特异性和很强的结合力。以往的配体多采用RGD(Arg-Gly-Asp)多肽,作为识别活化血小板的配体[14],近年有研究发现,用赖氨酸代替精氨酸,能够明显增强对活化血小板糖蛋白(GP)Ⅱb/Ⅲa 受体亲和性[10],KGD(Lys-Gly-Asp)氨基酸序列的肽段由于其仅作用于活化血小板GP Ⅱb/Ⅲa 受体,不会引起或干扰其他细胞类型介导的正常生理活动,是目前相对理想的血栓靶向造影剂配体[15-17]。纤维蛋白是血栓的主要成分,纤维蛋白可以作为微泡的特异性靶区,氨基酸序列为Cys-Arg-Glu-Lys-Ala(CREKA)的短肽是一种对纤维蛋白有高亲和力的多肽,稳定性强,药物富集率高,而将CREKA 里面的Glu 替换为Byn-Methy-Glu氨基酸序列,可以提高多肽抗水解能力[18-19]。
(3)对于新生血管,其靶点主要是整合素α5β1、整合素αVβ3、血管内皮生长因子(VEGF)和细胞黏附分子CD15 等分子,而配体主要是含RGD 氨基酸序列的寡肽或单克隆抗体等[20-21],BR55(bracco diagnostics)是目前唯一进入临床试验的分子靶向造影剂,其靶点是VEGF 受体-2(VEGFR-2)[22]。
配体与微泡表面连接方法有两类。第一类为共价连接法,包括直接结合法(离子键、物理吸附等)、交联剂连接法、系链连接法等;第二类是非共价连接法,主要指以生物素-亲和素法为连接桥梁,对连接双方进行生物素、亲和素修饰,以达到连接的目的。
3 靶向超声造影技术在心血管疾病中的应用
微泡所能荷载递送的治疗药物和基因种类繁多且领域广泛,可以将药物和基因递送至靶区组织或器官,超声靶向微泡爆破(UTMD)是利用高机械指数的超声照射,使微泡快速膨胀、收缩、破裂,微泡内释放出药物,同时产生的空化效应使血管内皮细胞间隙和细胞膜通透性增大,显著增加了靶组织或器官中基因或药物的局部浓度,有效增强了治疗效果。靶向造影剂主要分为诊断型、治疗型及多功能靶向造影剂。微泡是一种良好的递送载体,可将生物活性分子(如药物、纳米颗粒、疫苗和治疗性基因)靶向和特异性递送到超声可及的器官或组织中通过特异性反应,实现靶向造影剂基因转染或药物治疗。
3.1 血栓性疾病的诊断与治疗
血栓是血流在心血管系统血管内面剥落处或修补处的表面所形成的小块,造成血管部分或完全堵塞,引发静脉血栓栓塞症和动脉粥样硬化性血栓形成。外科手术或服用溶栓药物虽然可以溶解血栓,但外科手术是具有侵入性的,有很多并发症,条件限制条件导致风险较大。超声具有无创、便捷、快速的特点,可以靶向显示血栓、释放溶栓药物及监测血栓的溶解情况。
自1976 年Trübestein 等[23]首次成功将超声溶解动脉血栓应用到临床以来,超声溶栓就成为了超声领域的重要研究内容。Hagisawa 等[24]制备了靶向微泡携带RGD 肽序列,可以与糖蛋白GP Ⅱb/Ⅲa受体结合,活化血小板溶解血栓,通过体内实验和体外实验发现其均能显著增强血栓的靶向显影。Guo 等[25]研制了一种cRGD(Arg-Gly-Asp-D-Tyr-Cys)多肽修饰的微泡,这种微泡可以特异性地靶向并显示聚集在内皮细胞表面的活化的血小板,证明了GP Ⅱb/Ⅲa 受体可作为血栓生物标志物,用于超声分子成像检测。这种血栓靶向微泡可将溶栓药物直接递送至血栓附近,并通过UTMD 使药物发挥作用,是一种全新的革命性的血栓治疗方法[26]。
3.2 炎症
在微泡注射进入体内后,中性粒细胞和单核细胞会被激活并吞噬微泡,但微泡的声学特性并不会被破坏。在心肌缺血中,血管内皮细胞普遍存在炎症反应,缺血再灌注可导致心肌细胞表面的ICAM-1、P-选择素等炎症因子的表达明显增加[27]。纪丽景等[28]将携带抗P-选择素单抗靶向微泡注入缺血再灌注鼠体内,发现能有效地对损伤情况进行评价。Yan 等[29]发现与非缺血性心肌相比,再灌注的缺血心肌中 ICAM-1 表达大量增加,其使用抗ICAM-1单抗靶向微泡注入缺血再灌注小鼠体内,可靶向结合到心肌缺血再灌注损伤区域,辅助诊断再灌注晚期的心肌缺血。
3.3 动脉粥样硬化
动脉粥样硬化在病理上大致分为三个阶段:(1)早期脂肪条纹阶段;(2)进展期纤维斑块阶段;(3)晚期粥样易损斑块阶段。不稳定斑块的破裂会增加心肌梗死、脑卒中、猝死的风险,因此,尽早发现不稳定斑块尤为重要。血管内皮细胞损伤出现的炎症反应是动脉粥样硬化病变形成的关键环节。Li 等[30]研究发现,ICAM-1 靶向的超声纳米泡造影剂可以反映动脉粥样硬化病变不同阶段的炎症损伤程度,在早期诊断和准确评估动脉粥样硬化病变的炎症损伤程度方面具有一定潜力。VCAM-1 也是良好的靶点,Punjabi 等[31]在研究中发现,携带VCAM-1 的靶向微泡在动脉粥样硬化小鼠和人动脉内膜上的信号显著增强,这种微泡可以特异性地激活内皮细胞,实现超声显影,发现早期动脉粥样硬化斑块,从而判断动脉粥样硬化斑块是否稳定。
3.4 心肌梗死
靶向超声微泡破坏已被证明可以改善充质干细胞(MSC)归巢,增加缺血心肌中基质细胞衍生因子1(SDF1)表达,Fujii 等[32]将含有SDF1 的微泡联合UTMD 技术治疗急性心肌梗死大鼠,证明该方法可趋化干细胞,增加血管密度。靶向超声介导基因转染心肌组织可以避免直接注射法带来的有创性和现有载体的局限性,使心肌中有关血管生长因子基因高效表达,促进缺血心肌血管的新生。Sun 等[33]研究发现,利用靶向超声造影技术向缺血心肌输送脯氨酰羟化酶2(PHD2)短发夹RNA(shRNA)修饰的骨髓间充质干细胞(BMC),可改善心肌毛细血管通透性,改变缺血心肌局部微环境,促进干细胞归巢。Wei 等[34]将携带半乳糖凝集素-7(galectin-7)小干扰RNA(siRNA)的微泡用于治疗急性心肌梗死大鼠,增强了BMC 归巢能力,改善了心肌微环境。Chen 等[35]研究发现,UTMD 技术延迟向缺血心肌输送BMC,可显著减轻缺血再灌注后的心脏重塑,增大毛细血管密度,促进心肌细胞增殖,促进血管生成并诱导VEGF 分泌。
3.5 心脏移植急性排斥反应
心脏移植技术的不断完善和免疫抑制剂的开发应用使得心脏移植逐渐成为治疗终末期心力衰竭的有效方法。然而,心脏移植过程中易引发急性排斥反应,导致患者死亡。近年研究发现,将UTMD联合心肌超声成像可以定量评估急性排斥反应的程度。王卓等[36]使用了ICAM-1 修饰微泡,该微泡能够特异性聚集在心脏移植后的急性排斥反应发生区域,同时使用UTMD 产生声孔效应,使siRNA 直接进入细胞内,从而提升siRNA 转染率,有效地抑制急性排斥反应。Kondo 等[37]研究发现,细胞亲和性靶向微泡和抗ICAM-1 抗体靶向脂质微泡,能够从细胞和分子水平检测心脏移植后急性排斥反应的病理和代谢改变,为诊断心脏移植后急性排斥反应提供了新方法。
4 总结与展望
靶向超声造影剂的出现使分子成像逐步从MRI、CT、正电子发射断层扫描(PET)、血管造影等昂贵或侵入性检查逐渐向价廉、快捷、无创、无辐射相关风险、无已知副作用、很少导致患者不适感的超声分子成像转变,超声分子成像具有低免疫原性、低毒性、无创、器官组织特异性、可重复作用等诸多优点。因此,超声成像在临床诊断中使用频率最高,超声造影剂可以显著增强超声图像的分辨率和对比度,是医学超声的第三次革命。
在着眼于临床应用前景的同时,还需要进一步解决一些困难:(1)目前多数开展的实验为动物实验。考虑到人类环境的复杂性和异质性,UTMD 的应用仍需要进一步的临床试验。(2)不同部位或器官影响了治疗方案的选择,因此,考虑器官的免疫异质性和个体遗传背景,选择匹配良好的微泡是UTMD 治疗策略不可忽视的一部分。(3)目前市售的微泡仅用于增强成像,与药物、基因和疫苗结合的新型微泡需要优化和适应,以供将来临床应用。(4)需要继续研究 UTMD 的最佳参数。治疗效果不仅与超声参数如频率、力学指标、照射时间有关,还与微泡剂量、环境温度、空气湿度、组织类型等非超声因素有关。适当的微泡类型和声学参数是治疗方案的关键部分。
利益冲突:所有作者均声明不存在利益冲突
